Полиорганосилоксаны представляют собой кислородсодержащие кремнийорганические полимеры, кремний-кислородный скелет которых построен из чередующихся силоксановых 81—О-связей, обрамленных алкильными или арильными органическими радикалами:
Уникальные свойства полиорганосилоксанов, в первую очередь, исключительно высокая термостойкость вплоть до 400— 500 °С, определяются специфическим характером связи 51—О и ее влиянием на органические заместители, соединенные с атомом кремния.
Связь Б!—О во всех соединениях четырехвалентного кремния обусловлена о-связыванием х. р-гибридизованных электронов атома кремния с р-элек — тронами кислорода и дополнительным я-взаимодействием неподеленных р-электронов кислорода с Зй-орбиталями кремния—(р —й) „-сопряжение.
Образованные 5- и р-электронами четыре тетраэдрические о-связи атома кремния придают ему сходство с ближайшим соседом по периодической таблице — углеродом. Возможность ря—йя-связывания вносит резкие различия в структуру и свойства соответствующих соединений кремния и углерода: кремний, элемент третьего периода, имеющий свободные З^-орбитали, играет роль акцепторов электронов при образовании донорно-акцепторной
—Рл-СВЯЗИ.
Длина связи —О равна 0,16± 0,003 нм. Эта величина значительно
 Меньше, чем длина связи —О, подсчитанная теоретически, исходя из аддитивности атомных радиусов (0,18 нм). Укорочение связи —О можно объяснить в значительной степени как ее ионным характером, так и частичной двоесвязанностью, возникающей в результате рп—£?л-взаимодействия. Степень двоесвязанности зависит от природы заместителей у атомов кремния и кислорода.
Меньше, чем длина связи —О, подсчитанная теоретически, исходя из аддитивности атомных радиусов (0,18 нм). Укорочение связи —О можно объяснить в значительной степени как ее ионным характером, так и частичной двоесвязанностью, возникающей в результате рп—£?л-взаимодействия. Степень двоесвязанности зависит от природы заместителей у атомов кремния и кислорода.
Термическая стабильность силоксанов обусловлена высокой энергией и ионным характером силоксановой связи.
Силоксановая связь — одна из наиболее прочных связей, образуемых кремнием. Она намного прочнее связи С—С.
Энергия связи —О оценивается величинами 422—494 кДж/моль в зависимости от характера заместителя при атоме кислорода: в!—О—
Ш)———- 493, 51—0—(С) —
424 кДж/моль. Прочность связи —С—С составляет всего лишь 262 кДж/моль.
Силоксановая связь характеризуется высокой гибкостью. Вращение вокруг связи —О в силоксанах является практически свободным (потенциальный барьер составля-
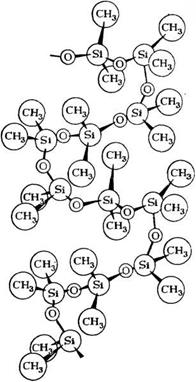
Рис. 4.1. Кристаллическая структура полиднметилсилоксана
Ет около 1 кДж/моль), однако наличие боковых заместителей всегда накладывает определенные ограничения: гибкость поли — силоксановой молекулы уменьшается при замещении метальных групп у атома кремния пропильными или фенильными. Макромолекула полиорганосилоксанов имеет спиралевидную форму (рис. 4.1) и образует своеобразный клубок с выступающими наружу углеродными радикалами. Такая форма макромолекулы объясняет многие физические свойства полиорганосилоксанов — гидрофобность, сжимаемость, слабое межмолеку — лярное взаимодействие, которое, в свою очередь, обусловливает низкие значения температурного коэффициента вязкости и поверхностного натяжения.
Природа органических групп И, обрамляющих атомы кремния, заметно влияет на свойства полиорганосилоксанов. Увеличение длины алкильных радикалов приводит к повышению эластичности полимера, его растворимости в органических растворителях и гидрофобизирующей способности; однако при этом понижается стойкость к термоокислительной деструкции и нагреванию; фенильные радйкалы способствуют повышению термостойкости полимера.
 8 сентября, 2013
8 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 