Полимеризация непредельных соединений (мономеров) протекает по цепному механизму и проходит стадии инициирования, роста, обрыва или передачи цепи. Последние две реакции приводят к прекращению роста макромолекулы.
Для получения полимеров можно использовать мономеры, содержащие кратные связи (С=С, С = С, С=0, С=1М), а также циклические мономеры. В зависимости от типа первичных активных центров цепная полимеризация может быть радикальной или ионной. В соответствии с этим растущие полимерные цепи представляют собой макрорадикалы, макрокатионы или макроанионы. Растущие цепи таких типов возникают в результате присоединения активного агента (инициатора, катализатора) к непредельному мономеру с образованием продукта присоединения — вторичного активного центра, на котором происходит дальнейший рост цепи:
К-
X
|
Сн2=сн- I X |
![]() К+(Н+) +
К+(Н+) +
К—СН2—СН (1.57)
X
А-(И-)
А—СН2—СН
Где Я’, К+ (Я+), А“(Я-)—соответственно радикальный, катионный и анионный первичные активные (реакционные) центры.
В результате такого присоединения происходит разрыв я-свя — зи углерод—углерод и переход ее в о-связь (переход атома углерода из состояния $р2-гибридизации в состояние «р3-гибридиза- ции). При этом в зависимости от инициирующего реагента на концевом атоме углерода появляется неподеленный электрон (образуется свободный радикал), возникает дефицит электронов (карбкатион) или их избыток (карбанион).
После каждого элементарного акта реакции полимеризации происходит регенерация активного центра на концевом атоме углерода, что является характерной особенностью цепной полимеризации.
Активные центры на углероде имеют различную структуру. Углеродные радикалы (R*), как правило, имеют плоскую струк — 4 туру и неспаренный электрон на р2-орбитали (в зависимости от } заместителя она может содержать и s-орбитальный вклад), к Карбкатионы (R+), иногда называемые ионами карбония, также < обладают плоской структурой; центральный атом углерода | 5р2-гибридизован и имеет вакантную р2-орбиталь. Карбанио — j ны (R-) имеют пирамидальную структуру с 5р3-гибридизован — ;• ным центральным атомом углерода.
Растущие макрорадикалы стабилизируются очень многими заместителями — как электроноакцепторными, так и обладающими эффектом сопряжения. Мономеры с такими заместителями у двойной связи, как —CI, —CN, —hCOOR, —COR, —Ar,
—CH=CH2 и т. п., легко полимеризуются по радикальному механизму. Эти же заместители стабилизируют карбанионы путем делокализации их заряда. Поэтому мономеры подобных типов I в ряде случаев полимеризуются и по анионному механизму. Карбкатионы (R+) легче атакуют непредельные связи с повышенной электронной плотностью в мономерах с электронодо — норными заместителями (алкильные группы, RO—, RS—, R2N—, Аг— и —СН=СН2), которые к тому же хорошо стабилизируют образующиеся карбкатионы. Вследствие этого мономеры с элек — тр. онодонорными заместителями легко полимеризуются по катионному механизму.
При оценке способности мономера к полимеризации нужно учитывать и пространственные (стерические) трудности, зависящие от числа и размеров заместителей при непредельной связи. ^
Влияние пространственных трудностей проявляется в изменении величин энтальпии полимеризации некоторых мономеров. Чем выше тепловой эффект реакции, тем легче полимеризуется Я мономер. С целью создания активных центров в реакционную ( массу вводят инициаторы (при радикальных) или катализаторы (при ионных или координационно-ионных процессах). Инициировать полимеризацию можно также с помощью ионизирующего I излучения (радиационная полимеризация), света (фотополиме-1 ризация) или электрического тока. s
На стадии роста цепи происходят последовательные одно-» типные реакции присоединения молекул мономера {М) к актив — ному центру (М*):
М*+М —>- М*2; М*2+М —►
—М*з, …. М*х+М —► м**+1
(1-58)3!
%
В определенных условиях реакция (1.58) может быть обратима. Исходя из известного положения термодинамики
0=Я — ГЯ. (1.59)
Для реакции полимеризации можно вывести следующее уравнение (индексы п и м означают полимер и мономер):
Д0 = 0П — 0„= (Я„ — Ям) — Г(5„ — Ям) =ДЯ — ТАБ, (1.60)
Где О—энергия Гиббса (изобарно-изотермический потенциал); Н — энтальпия; Т — абсолютная температура; 5 — энтропия.
Если полимер обладает меньшей энергией Гиббса, чем мономер, то АО отрицательно, и полимеризация может протекать самопроизвольно. При положительном Ай полимеризация самопроизвольно не протекает. При некоторой критической (предельной) температуре система может находиться в равновесии, и тогда Аб = 0. Перечисленные состояния можно записать следующим образом:
Мономер———- »-Полимер (ДО отрицательно);
Мономер ч——— Полимер (ДО положительно);
Мономер Полимер (Д0=0).
При равновесии ДС = 0, и тогда предельная температура Тпреа составит:
Тпред =ДЯр/Д5р, (1.61)
Где ДЯР и Д5Р — изменения энтальпии и энтропии при росте цепи, считая на повторяющееся звено.
Можно записать уравнение (1.58) реакции роста цепи с учетом ее обратимости:
*р
М%+М М+1. (1.62)
КА
Где и кл — константы скорости реакций роста и деполимеризации цепи.
Можно записать, приняв [М**-м] « [М**], следующее выражение для константы равновесия реакции (1.62):
£д [М*Л[М] [М1
Поскольку реакция полимеризации (рост цепи) экзотермич — на, константа равновесия (1.63) при повышении температуры будет уменьшаться, а равновесие (1.62) будет сдвигаться влево в сторону снижения выхода полимера. Известно, что ДС = ДС°-+- +У?7’1п/С, где Дб0 — энергия Гиббса в соответствующих стандартных состояниях. Это состояние для мономера — жидкость или его одномолярный раствор, для полимера — аморфное или слабокристаллическое состояние или же его одномолярныи рас
твор (в расчете на повторяющееся звено). Поскольку в состоянии равновесия ДС = 0, можно записать:
|
(1.64) (1.65) |
![]() ДО0=Д№> — 7Л5°=ЯГ 1п К. Из уравнений (1.63) и (1.64) получим:
ДО0=Д№> — 7Л5°=ЯГ 1п К. Из уравнений (1.63) и (1.64) получим:
ГпРед=ДЯ°/,(Д5°+Я1п [М]Кр).
Уравнение (1.65) показывает зависимость критической (равновесной) концентрации мономера [М]Кр от предельной темпе — ■ ратуры ТпРед. Линейная зависимость 1п[М]кр от 1/Т (с отрица — — тельным наклоном прямой, поскольку ДЯ° отрицательно) показывает, что с повышением температуры возрастает равновесная концентрация мономера.
Полимеризация мономера в растворе при заданной темпера — . туре протекает только до положения равновесия, т. е. до дости — жения концентрации мономера [М]кр, соответствующей его I Тпред. Поэтому для получения полимера с высокой молекулярной ■ массой реакцию нужно проводить при высоких начальных кон — ‘ центрациях мономера максимальной степени чистоты. Однако при температурах >Тпрев, полимер получить нельзя. I
Для реакции (1.62) кинетические уравнения скорости реак — ] ций роста (иР) и деполимеризации (уд) можно записать в еле — ] дующем виде: 1
|
|
(1.66)
Где [М*] — концентрация активных центров.
Суммарная скорость реакции полимеризации будет равна разности скоростей реакций роста и деполимеризации:
|
(1.67) |
![]() Ис = ир — Уд= (ЫМ] — *д) [М*].
Ис = ир — Уд= (ЫМ] — *д) [М*].
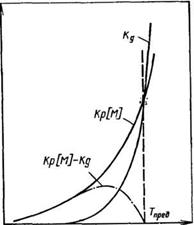
Как видно из рис. 1.9, с увеличением температуры скорость полимеризации увеличивается, так как растет кр. После опреде — ; ленной температуры начинает проявляться и реакция деполиме — ^ ризации (растет кл). И, наконец, при Тпрей наступает момент, | когда ур = ид, и процесс полимеризации достигает равновесия. 1 Для большинства ненасыщенных соединений Гпред при полиме — | ризации их в массе высока. Например, для этилена 7’пред=624, 1 тетрафторэтилена— 1370, метилметакрилата — 470 К. ^
Обрыв цепи происходит вследствие гибели активного центра Ъ при реакции его с другим активным центром или иным вещест — ? вом А или при его мономолекулярном превращении:
|
М*х+м* М%+А |
|
(1.68) |
![]() Инертные продукты (полимеры).
Инертные продукты (полимеры).
Рис. 1.9. Зависимость £р[М] и кЁ от к температуры. Объяснение см. в тексте
 При передаче цепи активный центр переносится на другую молекулу В (на мономер, растворитель, полимер, случайные примеси), которая может начать (или не начать) рост новой полимерной цепи:
При передаче цепи активный центр переносится на другую молекулу В (на мономер, растворитель, полимер, случайные примеси), которая может начать (или не начать) рост новой полимерной цепи:
М*+в —»- М+В*. (1.69)
Если передачи цепи не происходит, то длина кинетической (энергетической) цепи процесса (число молекул мо — т, К
Номера, прореагировавших с
Одним Активным центром) равна длине материальной (полимерной) цепи, т. е. числу повторяющихся звеньев в образовавшейся макромолекуле. При передаче цепи длина кинетической цепи может быть больше длины материальной.
 30 августа, 2013
30 августа, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 