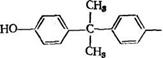
Исходным сырьем для получения диановых эпоксидных олигомеров служат 4,4′-дигидроксидифенилпропан (диан), кристаллический продукт с т. пл. 155°С и эпихлоргидрин (1,2-эпокси — 3-хлорпропан) — жидкость, не смешивающаяся с водой (т. кип. 115—116 °С).
В основе промышленного способа получения эпоксидных диановых олигомеров положена реакция эпихлоргидрина с 4,4′-дигидроксидифенилпропаном с последующим дегидрохлорированием образующихся хлоргидриновых эфиров. Реакция проводится в присутствии гидроксида натрия (обычно в виде водного раствора), играющего роль катализатора и дегидрохлорирующего агента [реакция (5.7)].
Идеальную структуру диановых эпоксидных олигомеров можно представить следующей формулой:
Н2с—- СН—сн2—г—о—И—О—СН2—СН—СН2—"]—О—Я—0—СН2—СН—сна,
Где И — ^ ^—С—^ у ; п~ в зависимости от условий проведения
Процесса меняется в пределах от 0 до 200.
Как видно из этой формулы, по строению основной цепи диановые эпоксидные олигомеры относятся к простым полиэфирам с боковыми гидроксильными группами (число которых в молекуле соответствует коэффициенту п) и двумя концевыми эпоксидными группами. С увеличением молекулярной массы содержание эпоксидных групп в олигомере уменьшается, а гидроксильных групп — возрастает (до определенного предела).
Продукты взаимодействия эпихлоргидрина с 4,4/-дигидрок — сидифенилпропаном, имеющие молекулярную массу, соответствующую верхнему пределу п, практически не содержат эпоксидных групп [их содержание не превышает десятых долей % (масс.)] и только по формальному признаку (методу получения) их относят к эпоксидным полимерам. Они получили название фенокси-смолы.
 Для получения первого члена гомологического ряда с п—0 (диглицидиловый эфир диана) необходим более чем десятикратный избыток эпихлоргидрина. Реакция протекает в две стадии: вначале происходит образование дихлоргидринового эфира диана (ДХГ), а затем — его дегидрохлорирование [реакции (5.9) и (5.10)]:
Для получения первого члена гомологического ряда с п—0 (диглицидиловый эфир диана) необходим более чем десятикратный избыток эпихлоргидрина. Реакция протекает в две стадии: вначале происходит образование дихлоргидринового эфира диана (ДХГ), а затем — его дегидрохлорирование [реакции (5.9) и (5.10)]:
О
Он + 2нас^^снсн2а —>-
—— =- С1СН2СНСН20—С——- $ —ОСН2СНСН2С1 (5.9)
ОН СН3 ОН
ДХГ
ДХГ+2№ОН V Н2С—————— СНСНаО—/~Л-ОСН, СН— СН4+
|
|
При уменьшении количества эпихлоргидрина молекулярная масса олигомера увеличивается. Глицидиловые эфиры 4,4′-ди — гидроксидифенилпропана благодаря наличию эпоксидных групп способны реагировать с фенольным компонентом с увеличением длины цепи:
|
Р |
![]() N8011
N8011
TOC o "1-5" h z н2с сн—сн„—о—я—о—сн,—сн—сн,+но—и—он >
—> Н2С—— СН-СН,—О—Я—О—СН,—СН—СНЯ—О—Я—ОН, (5.11)
I
СНа
Свободная фенольная группа образовавшегося по реакции (5.11) соединения I взаимодействует с эпихлоргидрином аналогично реакции (5.9), и после дегидрохлорирования образуется олигомерный продукт с я=1. Дальнейшее увеличение цепи по аналогичной схеме приводит к образованию олигомеров с «=1,2,3,… и т. д.
Возможен и другой путь роста цепи за счет гомоконденсации соединения I по эпоксидной и фенольной группам. Увеличение степени поликонденсации в этом случае будет иметь кратность, равную 2(п=0,2,4, …).
Таким образом, принципиальная схема синтеза диановых эпоксидных олигомеров представляет собой последовательное чередование реакций. присоединения эпоксидной группы к фенольному компоненту и регенерирования эпоксидной группы при дегидрохлорировании.
Механизм реакции эпоксидной группы с фенольным гидроксилом в условиях основного катализа был рассмотрен ранее. Эта реакция экзотермична, ее тепловой эффект ДН=—71,5 кДж/моль.
Регенерирование эпоксидной группы происходит за счет дегидрохлорирования хлоргидриновых эфиров. По существу, превращение хлоргидринов в эпоксидные соединения представляет собой реакцию получения простых эфиров из алкилгалогенидов и алкоголятов щелочных металлов по Вильямсону и протекает по механизму нуклеофильного замещения галогена алкоголят — ионом. Циклический эфир (эпоксидное кольцо) образуется вследствие того, что как ОН-группа, так и галоген являются частью одной и той же молекулы. По этому признаку это превращение можно отнести к типу реакций, протекающих с участием соседних групп. В присутствии — ОН-иона (водный раствор МаОН) небольшая часть спиртовой группы хлоргидрина существует в виде алкоголят-иона, который вытесняет (замещает) галоген, находящийся
У другого углеродного атома той же молекулы с образованием циклического эфира:
С1 С1
—СН—СНя+НО — =[8]=> —СН—СН* + Н20 (5.12)
|
ОН О- —сн—сн2 С1 |
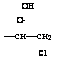 СГ
СГ
|
(5.13) |
В результате реакции дегидрохлорирования концентрация щелочи уменьшается и образуется №С1. Реакция дегидрохлорцрования эндотермична (АН = 118 кДж/моль), однако благодаря растворению продуктов реакции общий тепловой эффект оказывается слабоэкзотермичным: ДЯ=—17 кДж/моль
Следует отметить, что приведенная здесь схема синтеза эпоксидных олигомеров является идеализированной и не включает в себя реакций, приводящих к ограничению роста цепи и дефектности по функциональности. Молекулярная масса олигомеров всегда меньше теоретически рассчитанной с учетом мольного соотношения эпихлоргидрин: диан, что видно из приведенных ниже данных:
Мольное отношение эпнхлор — гидрин : диан
1,5
1,33
Эпоксидный
Эквивалент*
170/249
312/516
454/730
Мольное отношение эпихлоргидрин : диан
1,25
Эпоксидный
Эквивалент*
596/862
738/1180
Завершенностью процессов конденсации и дегидрохлорирования и рядом побочных реакций. К их числу относятся в первую очередь гидролиз эпихлоргидрина и концевых эпоксидных групп растущих макромолекул. Ряд химических превращений, протекающих при гидролизе эпихлоргидрина, можно представить следующей системой последовательно-параллельных реакций, приводящих в конечном счете к образованию глицерина:
СН2—СН—СН2 + НаО ► СН2—СН—СН2, (5.14)
I TOC o "1-5" h z / но" I I I
С1 О С1 он он
СН2—СН—СН2 9- СН2—СН—СН2 + СГ, (5.15)
I I I но — | ||
С1 он он он он он
СН2—СН—СНа+НО" —— V Н2С СН—СН2 + СГ + НаО, (5.16)
I I I / I
С1 он он о он
НгС СН—СН2 + НаО —СН2—СН—СН2. (5.17)
ОН он он
V 1 — ‘ 1
Гидролиз концевых эпоксидных групп приводит к образованию гликолевых фрагментов на концах растущей макромолекулы:
-ОИО—СНа—СН—СН2+НаО ——- * “ОИО—СН2—СН—СН2. (5.18)
/ но" II
О ОН ОН
Появление в структуре молекулы олигомера неомыляемого хлора может быть следствием как протекания реакции по вторичной гидроксильной группе:
И—О—СН»СНСН2С1 + Н2С— СНСНгО—И ——- >
И—О—СНа—СН—О—СН2СНСНаО—И, (5.19)
ОН
(!:н2С1
Так и аномального раскрытия а-оксидного цикла:
СН* СН, СН2ОН
-ЦЗ-Ш+НаС———————— СНСНаС! ——- ► ~С —^ ^—О—СН
Сн3 ~ V Ан,’-‘ СН2С1
(5.20)
При глубоких степенях превращения реакция (5.19) приводит к образованию разветвленных макромолекул.
Диановые эпоксидные олигомеры принято делить на три группы: низко — (Л1„ = 350—500), средне — (М„ = 500—1500) и высокомолекулярные (М„=1500—5000). Особую группу продуктов конденсации эпихлоргидрина с 4,4/-дигидроксидифенилпропаном составляют фенокси-смолы. Состав и характеристика диановых эпоксидных олигомеров и полимеров приведена в табл. 5.1.
Условия проведения технологического процесса получения эпоксидных диановых олигомеров определяются их молекулярной массой.
Синтез низкомолекулярных эпоксидных олигомеров проводят в большом избытке эпихлоргидрина, необходимом для подавления реакции роста полимерной молекулы. Это обстоятельство определяет специфические особенности процесса. Будучи введенным в реакционную массу в значительном количестве (по сравнению с другими компонентами), эпихлоргидрин одновременно выполняет функции и реагента, и растворителя. Синтез олигомера до сравнительно высоких степеней завершения процесса протекает в однофазной системе.
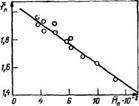
Синтез олигомеров средней молекулярной массы, высокомолекулярных и фенокси-смол проводится гетерофазно в вод- но-органической среде с добавкой или без добавки органического растворителя. Молекулярная масса полученного олигомера зависит в первую очередь от соотношения исходных реагентов (эпихлоргидрина, дигидроксидифенилпропана и щелочи) и состава органической фазы. В состав органической фазы предложено вводить бутанолы, циклогексанон, толуол и ацетон. Из данных, приведенных на рис. 5.2, видно, что при использовании бутанолов, особенно трет-бутанола (кривая 3), молекулярная масса образующегося олигомера при прочих равных условиях максимальна. Наибольшей оказывается и скорость ее нарастания, что связано с участием спирта-растворителя в — реакции эпоксидной группы с фенолят-анионом дигидроксидифенилпропана [см. реакцию (5.2)].
При использовании в качестве растворителя спирта максимальная молекулярная масса достигается при эквимольном соотношении дигидроксидифенилпропан : эпихлоргидрин (1:1) (рис. 5.3), поэтому можно считать, что в этом случае процесс протекает в кинетической, а не в диффузионной области.
Учитывая экономические и технологические факторы, при проведении конденсации эпихлоргидрина и дигидроксидифенилпропана, в качестве спирта-растворителя обычно используют н-бутанол или изопропанол.
Следует отметить, что рассмотренный выше метод гетеро — фазной поликонденсации эпихлоргидрина и дигидроксидифенилпропана не является единственно возможным путем полу-
|
Молекулярная Масса |
Содержание эпоксидных групп, % (масс.) |
Содержание гидроксильных групп, % (масс.) |
Содержание полимергомологов различной степени полимеризации (я), % (масс.) |
Температура размягчения, °С |
Вязкость при 40 °С, 10а Па’С |
|||
|
0 |
1 |
2 |
З |
|||||
|
350—400 |
24,8-21,5 |
0,1-0,8 |
92—85 |
8-15 |
2—3 |
0 |
— |
800—2000 |
|
400—600 |
21,5—14,5 |
0,8—2,5 |
85—50 |
15-20 |
8-10 |
5—10 |
— |
20 000—60 000 |
|
600—800 |
14,5—10,0 |
2,5-4,6 |
50—20 |
12—16 |
8—11 |
45—50 |
— |
2000(100°С) |
|
800—1000 |
10,0—8,0 |
4,6—5,1 |
20—13 |
12—14 |
9—12 |
55—60 |
50—55 |
— |
|
1000—1400 |
8,0—6,0 |
5,1—6,0 |
13-8 |
7—9 |
8—10 |
70—75 |
55—70 |
— |
|
1400—1800 |
6,0—4,0 |
6,0—6,5 |
6—4 |
6—8 |
8-10 |
80—85 |
70—85 |
— |
|
1800—3500 |
4,0—2,0 |
6,5—6,8 |
4,2 |
3-5 |
5-8 |
83-90 |
85—100 |
— |
|
30 000—60 000 |
0,9 |
6,8 |
— |
_ |
_ |
«100% |
_ |
_ |
|
|
|
05 ■ 10 |
![]()
|
15 ЭХГ1Д9П |
![]() Рис. 5.2. Зависимость молекулярной массы от продолжительности процесса при 70 °С и мольных соотношений компонентов диан : эпихлоргидрин : ЙаОН =
Рис. 5.2. Зависимость молекулярной массы от продолжительности процесса при 70 °С и мольных соотношений компонентов диан : эпихлоргидрин : ЙаОН =
— 1:1:2 при различных составах органической фазы:
1 — н-бутанол; 2 — вгор-бутанол; 3 — грет-бутанол; 4 — толуол; 5 — циклогексанон
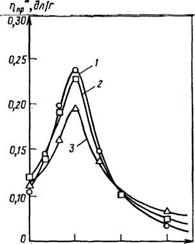
Рис. 5.3. Зависимость молекулярной массы от мольного соотношения реагентов при 70 °С и соотношении диан : КаОН= I :2 (продолжительность реакции 60 мин) в различных растворителях:
1 — к-бутанол; 2 — егор-бутанол; 3 — грег-бутанол
Чения средне — и высокомолекулярных олигомеров. Они могут образовываться также и при взаимодействии низкомолекулярных олигомеров с дигидроксидифенилпропаном по схеме:
Н2с— снсн2о-г—я-осн2снсн2о->я-осн2сн-ш2+но-я-он-*-
|
V |
![]() 4 ‘ I /
4 ‘ I /
СНСН20—Г—Я—0СН2СНСН20—1—Я—ОСН2СН—Ша, (5.21)
|
V |
![]() V [ он т+2 сн3
V [ он т+2 сн3
|
Где I? |
![]() 0+0- СНз
0+0- СНз
Этот процесс обычно проводят в расплаве при температурах 160—210°С, часто в присутствии катализаторов — третичных аминов. Этот способ получения диановых эпоксидных олигомеров принято называть методом сплавления.
Олигомеры, полученные методом сплавления, отличаются более широким молекулярно-массовым распределением, чем олигомеры, синтезированные из эпихлоргидрина и дигидрокси- дифенилпропана. Так, для двух олигомеров, полученных методами конденсации и сплавления, со средней молекулярной массой 1000 отношение М^Мп соответственно равно 1,1 и 2,43.
Метод гетерофазной конденсации эпихлоргидрина с дигид — роксидифенилпропаном имеет целый ряд преимуществ по сравнению с методом сплавления. Прежде всего, он универсален и позволяет получать полимеры с очень широким диапазоном молекулярных масс (от 600 до 60000). Процесс ведут в мягких условиях (при 70—80 °С) и получают олигомеры, более однородные по составу (узкое молекулярно-массовое распределение). Этот метод позволяет осуществить синтез олигомеров в одну стадию и открывает возможность проведения процесса непрерывным способом.
Синтез низкомолекулярных эпоксидных олигомеров (с молекулярной массой 350—500), которые получают при большом избытке эпихлоргидрина, одновременно играющего роль растворителя, проводят следующим образом. В реактор загружают эпихлоргидрин и дигидроксидифенилпропан и при работающей мешалке порциями загружают ШОН в виде 40%-ного водного раствора. Температура реакционной массы постепенно повышается до 65—75 °С. По окончании процесса (через 8— 16 ч) непрореагировавший эпихлоргидрин отгоняют под вакуумом, олигомер растворяют в толуоле и толуольный раствор промывают водой для удаления ЫаС1. Затем толуол отгоняют под вакуумом при 140—150 °С.
Полученный низкомолекулярный эпоксидный олигомер представляет собой (см. табл. 5.1) низковязкую жидкость с высоким содержанием эпоксидных групп и используется в лакокрасочной промышленности в основном для получения эпоксидных материалов с высоким содержанием основного вещества или без растворителей.
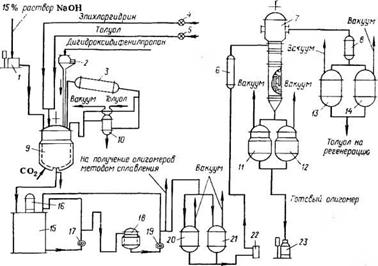
Синтез средне — и высокомолекулярных олигомеров методом гетерофазной конденсации эпихлоргидрина и дигидроксидифе — нилпропана в настоящее время осуществляется периодическим и непрерывным способами, причем первый является более распространенным. Периодическая технологическая схема производства среднемолекулярного эпоксидного дианового олигомера гетерофазной конденсацией приведена на рис. 5.4.
В реактор 9, снабженный пароводяной рубашкой, загружают дигидроксидифенилпропан и эпихлоргидрин. Реакционную массу нагревают до 50 °С и постепенно, следя за тем, чтобы температура не поднималась выше указанной, загружают гидроксид натрия в виде 15%-ного водного раствора. Реактор при этом охлаждают водой из-за возможного перегрева реакционной
|
Рис. 5.4. Технологическая схема производства диановых эпоксидных олигомеров методом конденсации эпихлоргидрина и дигидроксидифенилпропана периодическим способом: 1 — весовой мерник; 2— автоматические порционные весы; 3, 8, 16 — конденсаторы; 4, 5 — жидкостные счетчики; 6 — подогреватель; 7 — тонкопленочный роторный испаритель; 9 — реактор с пароводяной рубашкой; 10 — разделительный сосуд; 11, 12 — сборники; 13, 14 — вакуум-приемники; 15 — промежуточная емкость; 17, 19 — шестеренчатые насосы; 18 — тарельчатый фильтр; 20, 21 — сборники фильтрованного раствора олигомера; 22 — насос-дозатор; 23 — тара |
Массы (реакция экзотермична). По окончании загрузки ЫаОН температуру постепенно повышают до 70—80 °С и ведут процесс в течение заданного времени. Затем в реактор 9 добавляют толуол, перемешивают при температуре 30—55 °С (до полного растворения олигомера) и дают отстояться реакционной массе, в результате чего она расслаивается: верхний слой — раствор олигомера в толуоле, и нижний — водно-солевой слой. Нижний слой отделяют, а оставшийся раствор олигомера нейтрализуют диоксидом углерода. Далее проводят осушку раствора олигомера отгонкой от него оставшейся воды в разделительный сосуд 10 в виде азеотропной смеси с толуолом. Осушенный олигомер сливают из реактора в емкость 15 и оттуда насосом 17 передают на фильтрацию (схема предусматривает возможность многократной фильтрации до отсутствия ионов хлора). Для выделения олигомера из толуольного раствора толуол отгоняют в тонкопленочном роторном испарителе 7, работающем в непрерывном режиме под вакуумом при 120°С. В испаритель раствор олигомера подают из сборников 20 и 21 посредством дозировочного насоса 22 через подогреватель 6. Отогнанный толуол собирают в приемники 13 и 14, а олигомер — в сборники 11 и 12, из которых он направляется на фасовку.
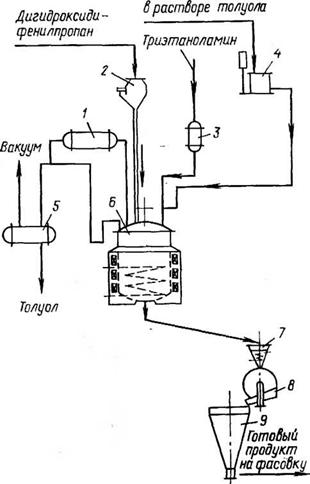
На рис. 5.5 представлена технологическая схема производства среднемолекулярного эпоксидного олигомера методом сплавления.
По этой схеме синтез олигомера проводят в реакторе с электроиндукци — онным обогревом 6. В качестве исходных компонентов при синтезе олигомера
Рис. 5.5. Технологическая схе — .ма < производства — диановых эпоксидных олигомеров методом сплавления:
1
|
Исходный олигомер |
![]()
 — конденсатор; 2 — автоматические порционные весы; 3 — ОбъеМ — ный мериик; 4 — весовой мерник; 5 — вакуум-приемник; 6 — реактор с электроиндукционным обогревом; 7 — обогреваемый приемник расплава олигомера; 8 — барабан-кристаллизатор; 9 — приемный бункер
— конденсатор; 2 — автоматические порционные весы; 3 — ОбъеМ — ный мериик; 4 — весовой мерник; 5 — вакуум-приемник; 6 — реактор с электроиндукционным обогревом; 7 — обогреваемый приемник расплава олигомера; 8 — барабан-кристаллизатор; 9 — приемный бункер
«спользуют дигидроксидифе — нилпропан и раствор олигомера с молекулярной массой 600 в толуоле. Использование олигомера в виде раствора облегчает его загрузку в аппарат. Обычно используют осушенный и отфильтрованный 40%-ный раствор олигомера, который является промежуточным продуктом технологического процесса получения этого олигомера (см. схему на рис. 5.4). Первой операцией технологического процесса является отгонка толуола от раствора исходного эпоксидного олигомера. Для этого в реактор 6 загружают необходимое количество раствора олигомера из весового мерника 4 и при температуре до 120 СС отгоняют толуол в приемник 5. Для более полного удаления толуола процесс можно вести под вакуумом. После отгонки толуола в реактор вводят дигидроксидифенилпропан, катализатор (триэтаноламин) и ведут процесс, осуществляя контроль по температуре размягчения продукта реакции. По окончании процесса олигомер сливают через обогреваемый приемник 7 на барабан-кристаллизатор 8, с которого он ссыпается в приемный бункер 9 и направляется на фасовку.
 9 сентября, 2013
9 сентября, 2013  admin
admin 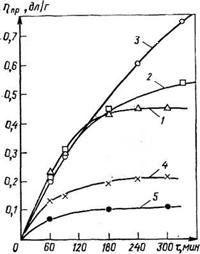
 Опубликовано в рубрике
Опубликовано в рубрике 