Для получения эпоксидных олигомеров типа глицидиловых эфиров фенолов в качестве исходного фенольного компонента используют также фенолоформальдегидные олигомеры ново — лачного типа. Структуру эпоксидированных новолачных олигомеров можно представить следующим образом:
|
-СН, |
|
2» |
|
О |
|
О—сн2—НС—————— СН2- О—СН2-НС |
|
/ О |
|
■сн, |
|
О—СН2—НС |
|
|-сн2- |
|
/ О |
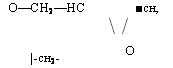 |
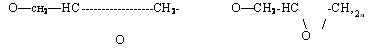 |
|
|
![]()
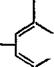
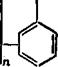
Где п=»0 —10.
В отличие от диановых эпоксидированные новолачные оли> гомеры имеют более высокую функциональность (обычно в пределах 2,2—12), поэтому их принято называть полиэпоксидами.
Химические реакции, лежащие в основе процесса синтеза таких олигомеров, аналогичны реакциям, рассмотренным для диановых олигомеров. Процесс протекает в две стадии: вначале идет присоединение эпихлоргидрина к фенольному гидроксилу, а затем — дегидрохлорирование образовавшихся хлор — гидриновых эфиров.
Технология процесса получения эпоксидированных ново — лачных соединений имеет, однако,- некоторые особенности. При получении этих олигомеров используют следующие соотношения исходных компонентов:
Содержание, Содержание, моли % (масс.)
TOC o "1-5" h z Новолачный олигомер 1* 14,5
Эпихлоргидрин 6 75
№ОН (твердый) 1,7 10,5
* В эквивалентах ОН-групп.
Как видно из приведенных данных, эпихлоргидрин берут в значительном избытке (в шестикратном по отношению к фенольной гидроксильной группе), поэтому он одновременно является и растворителем. Процесс можно вести как в присутствии водного раствора щелочи 20—40%-ной концентрации, так и в присутствии твердого ЫаОН. В последнем случае удается предотвратить протекание целого ряда побочных реакций, связанных с присутствием в реакционной системе воды.
Измельченный новолачный олигомер растворяют, в эпихлоргидрине (соотношение ОН : эпихлоргидрин равно 1 : 5) при 55—60 °С, после чего в реактор при работающей мешалке загружают твердый №ОН из расчета 1,1 моль на. одну фенольную гидроксильную группу. Температуру поднимают до 75 °С и ведут процесс поликонденсации в течение 2 ч, после чего нейтрализуют реакционную массу диоксидом углерода до нейтральной реакции по фенолфталеину. К реакционной массе добавляют оставшееся количество эпихлоргидрина и отделяют выпавший осадок 1>1аС1 фильтрованием. Для более полного завершения реакции дегидрохлорирования проводят повторную обработку реакционной массы твердым МаОН (дополнительно вводя 0,6 моль последнего) при 60—65 °С в течение 1 ч. Раствор олигомера в эпихлоргидрине нейтрализуют С02 и отмывают водой до отрицательной реакции на ионы хлора, после чего отгоняют избыточный эпихлоргидрин при остаточном давлении 80 кПа, постепенно повышая температуру от 90 до 120 °С.
Свойства эпоксиноволачных олигомеров определяются в основном структурой исходного новолачного соединения (табл. 5.2).
Как видно из приведенных данных, содержание эпоксидных групп в эпоксиноволачных олигомерах (а следовательно,
Число фенольных ядер в исходном но-
Волачном соединении внешний внд содержание эпок — сидных групп, %
Содержание общего хлора, %
|
|
||
|
|||
|
|||
И эпоксидный эквивалент) не изменяется в зависимости от молекулярной массы. Число эпоксидных групп в молекуле определяется числом фенольных звеньев исходного новолачного соединения.
Большое число эпоксидных групп в эпоксиноволачных олигомерах и их более плотная упаковка обусловливают высокую плотность сшивки структурированных материалов, что, в свою очередь, приводит к получению покрытий с высокими защитными свойствами.
 9 сентября, 2013
9 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 