Эпоксидные соединения легко реагируют как с нуклеофильными, так и с электрофильными реагентами. Их высокая реакционная способность обусловлена большой напряженностью трехчленного цикла. Так, в молекуле оксида этилена Н2С—СН2,
Простейшем представителе эпоксидных соединений, один из углов с атомом С в вершине составляет 59°18′ вместо нормального —109°28′. Энергия напряжения цикла равна 54,4 кДж/ /моль.
Раскрытие эпоксидного цикла представляет собой реакцию нуклеофильного замещения (5^2) при атоме углерода, причем группой, которая замещается, является атом кислорода цикла.
При атаке производных оксида этилена И—СН—СН2 нук-
Леофильный реагент НВ преимущественно атакует менее замещенный атом углерода кольца, т. е. место, где а-заместители не создают пространственных препятствий («нормальная» реакция). «Аномальное» замещение, т. е. замещение у более замещенного атома углерода, происходит лишь в незначительной степени:
|
Я—СН—СН2 + НВ— |
|
V |
|
|
|
|
Протекание реакции облегчается в присутствии протонодо — норных соединений (реагента НВ или растворителя), осуществляющих электрофильную сольватацию кислорода эпоксидного цикла. Поляризация С—О-связи при образовании водородносвязанных комплексов облегчает последующую атаку нуклеофильным агентом НВ. С учетом электрофильного содействия НВ (или растворителя) реакция протекает по многоцентровому механизму через тримолекулярное переходное состояние:
Я—СН—СН2 + НВ
О
НВ
‘Я—СН—СН2-ВН_
У
НВ
Я—СН—СН»В+ НВ
ОН
(5.2)
Реакция катализируется как кислотами, так и основаниями. Основный катализ эффективен для таких слабых нуклеофильных агентов, как вода, спирты ИОН, фенолы РЬОН, карбоно-
Общем виде можно представить следующим образом:
Катализатор ОН~
TOC o "1-5" h z КХН + СНаСНСНаС! ————— >- НХСН2СНСН2С1 —— ►
О ОН
—- ► ЯХСН2СНСН2 + НС1. (5.7)
/
О
Исходными протонодонорными соединениями могут служить двух- и многоатомные фенолы, спирты, карбоновые кислоты, амины, как, например, 4,4′-дигидроксидифенилпропан (диан), 4,4,-дигидроксидифенилметан, резорцин и его алкилзамещен — ные, новолачные фенолоформальдегидные олигомеры, этилен-, диэтиленгликоли, глицерин и другие полиатомные спирты, фта — левые кислоты, анилин, 4,4/-диаминодифенилметан.
Продукты реакции характеризуются наличием концевых глицидиловых групп вида —ХСН2СН—СН2. Условия протекания
Процесса определяются реакционной способностью протонодо- норного агента ЯХН. Реагенты с высокой нуклеофильностью типа алифатических и ароматических аминов реагируют с эпи — хлоргидрином в мягких условиях в отсутствие катализаторов. При реакции эпихлоргидрина с фенолами и карбоновыми кислотами применяют основные катализаторы, увеличивающие их нуклеофильность. Вследствие относительно высокой кислотности фенола и карбоновых кислот реакция протекает специфично, и хлоргидриновые эфиры образуются количественно. Реакция эпихлоргидрина со спиртами при основном катализе осложняется полиприсоединением по вторичной гидроксильной группе, избежать которого удается только при значительном избытке спирта. Поэтому реакцию эпихлоргидрина со спиртами часто проводят в присутствии кислых катализаторов, а образующиеся хлоргидриновые эфиры дегидрохлорируют щелочью.
В зависимости от условий проведения процесса и характера исходного протонодонора по этому методу получают моно — и диглицидиловые производные спиртов, фенолов, карбоновых кислот и аминов, эпоксидные олигомеры и полимеры различной структуры с молекулярной массой до 60 000 (например, так называемые фенокси-смолы).
Наибольшее распространение в промышленности получили эпоксидные олигомеры на основе 4,4′-дигидроксидифенилпро — пана (диановые эпоксидные олигомеры).
Большое разнообразие эпоксидных пленкообразующих на основе протонодонорных соединений, включая их модифицированные производные, видно из схемы:
|
|
 9 сентября, 2013
9 сентября, 2013  admin
admin 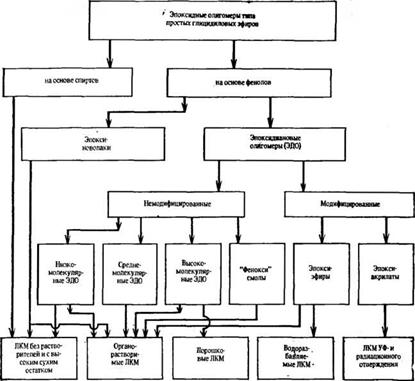
 Опубликовано в рубрике
Опубликовано в рубрике 