Практически все неорганические твердые тела и многие органические по химическому характеру их поверхности могут быть отнесены к твердым кислотам или основаниям. Поверхности многих из них обладают амфо — терными свойствами. Так, например, такие пигменты и наполнители, как диоксид титана ТЮ2, оксид хрома Сг203, сульфид цинка гпБ, сульфат бария Ва804, сульфат кальция Са804, относятся к твердым кислотам. Оксид магния М§0 является твердым основанием. Поверхности оксида цинка ТпО, оксида алюминия А1203, оксида кремния 8Ю2, карбоната кальция СаС03, силиката алюминия А1203 — и8Ю2 обладают амфотерны — ми свойствами. Наличие на поверхности пигментов труднорастворимых фосфатов, основных сульфатов придает ей кислотный характер. Многие смешанные оксиды, такие, как оксиды магния и кремния, цинка и кремния, сурьмы и кремния, образующиеся на поверхности пигментов при некоторых способах модифицирования, проявляют амфотерный характер.
Кислотно-основные свойства поверхности пигментов имеют существенное значение в процессах пигментирования, так как они во многом определяют адсорбционные явления в системе. Особенно важно их значение при пигментировании водоразбавляемых материалов. В ряде случаев сильно выраженные кислотные или основные свойства исключают применение того или иного пигмента в среде анион — или катионактивных пленкообразователей или воднодисперсионных красок. Постоянное расширение ассортимента пленкообразователей требует все большей и большей специализации пигментов, в том числе и по их поверхностным свойствам.
Для теоретически обоснованного выбора пигментов при получении пигментированных материалов необходима характеристика их поверхности и целенаправленное ее изменение.
Для полной характеристики кислотно-основных свойств поверхности необходимо знать число активных центров, отнесенное к единице массы или единице поверхности пигмента, распределение этих центров по силе и их тип. Силу кислотных и основных центров оценивают по способности поверхности твердого тела переводить адсорбированные молекулы основания в кислотную форму или, соответственно, молекулы кислоты в сопряженную основную за счет реакций с переносом протона в случае кислотных или основных центров бренстедовского типа или за счет
перехода электронной пары в случае льюисовских центров. Сила центров оценивается функцией кислотности Гаммета #0. Для бренстедовских центров она равна:
Я0=-1£Г(он+/б/Твн+)
Где оц*- — активность протона; /в — коэффициент активности основания; /Вц* — коэффициент активности сопряженной кислоты.
Для льюисовских центров:
Дэ~ 1£Т(°а/в//ав)
Где яд — активность кислоты Льюиса; /3 — коэффициент активности основания; /дВ — коэффициент активности сопряженной кислоты.
Сила кислотных или основных центров оценивается при помощи индикаторов Гаммета [87, с. 14, С. 4Ъ] визуальным или спектрофотометрическим методом. Для этой цели используют также методы адсорбции газообразных соединений и их термической десорбции. Концентрацию кислотных центров определяют с помощью метода аминного титрования с индикаторами Гаммета или с использованием для построения кривой титрования калориметрического метода [87, с. 27].
Для измерения бренстедовской кислотности и основности применяют метод, заключающийся в измерении числа протонов или гидроксильных ионов, перешедших в водный раствор при взаимодействии твердой поверхности с водными растворами нейтральных солей, таких, как хлорид натрия или калия, ацетат аммония. Известен и ряд других методов оценки силы и концентрации кислотных и основных ценров [81, с. 20; 88, с. 79].
Химические свойства поверхности пигмента определяются как его химическим составом и кристаллическим строением, так и предысторией пигмента, методом его получения и модифицирования, а также условиями хранения. Так, поверхность диоксида титана обладает кислотными группами бренстедовского типа, причем анатазная модификация характеризуется большей кислотностью, чем рутильная. Еще большей кислотностью обладает поверхность диоксида титана, полученного гидролизом тетрахлорида титана. На поверхности образца, прокаленного при 500 °С; обнаружено [87, с. 69] 0,06 ммоль/г кислотных центров с силой Н0 < < +4,8, 0,05 ммоль/г кислотных центров с силой Н0 < +3,3 и 0,03 ммоль/г с силой Н0 <+1,5. С ростом температуры прокалки резко убывает кислотность поверхности. При 600 °С полностью исчезают кислотные центры с силой Н0 <+1,5, при 800 °С — и кислотные центры с силойЯ0 < +3,3.
|
;Т1—О—Н |
![]()
|
Т1—0—Н |
![]()
|
Т1 |
![]()
|
П |
![]()
|
ТС |
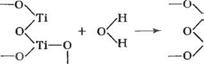
![]() Изменение химических свойств поверхности диоксида титана можно рассматривать [89, с. 147], предполагая образование мостиковых (I) и концевых (Н) гидроксильных групп, возникающих при диссоциации адсорбированной воды на поверхности:
Изменение химических свойств поверхности диоксида титана можно рассматривать [89, с. 147], предполагая образование мостиковых (I) и концевых (Н) гидроксильных групп, возникающих при диссоциации адсорбированной воды на поверхности:
Поверхность оксида цинка, полученного окислением паров металлического цинка кислородом воздуха, характеризуется слабой кислотностью [87, с. 67]. На ней содержится всего 0,004 ммоль/г кислотных центров
С силой 4,8<//0 <6,8. Однако прокаливание оксида цинка на воздухе при температуре выше 300 °С в 2,5 раза увеличивает число кислотных центров на поверхности. Это связано, по всей вероятности, с обогащением поверхностных слоев кристалла атомами кислорода и нарушением стехиометричности. В то же время поверхность оксида цинка, полученного гидролизом хлорида цинка и прокаленного при 400 °С, обладает сильным кислотным характером: более 2 ммоль/г кислотных центров с силой #0 <+6,8, около 2 ммоль/г с силой Н0 <+4,8, около 0,5 ммоль/г с силой Н0 <+3,3 и 0,25 ммоль/г с силой Н0 <+1,5. Оксид цинка, прокаленный при температуре выше и ниже 400°С, характеризуется значительно меньшей кислотностью. Кислотные центры на поверхности оксида цинка, в отличие от диоксида титана, являются льюисовскими. На поверхности оксида цинка обнаружены и основные центры умеренной силы.
При синтезе диоксида титана сернокислотным способом соединения цинка используются как в качестве рутилизирующих добавок, вводимых на стадии солевой обработки метатитановой кислоты, так и в качестве модифицирующих добавок на стадии поверхностной обработки. Поэтому поверхностные слои кристаллической решетки содержат атомы цинка, т. е. практически представляют собой смешанные оксиды титана и цинка. Поверхность такого смешанного оксида значительно отличается по кислотно-основным свойствам от поверхности индивидуальных оксидов. В отличие от поверхности индивидуальных оксидов поверхность смешанного оксида характеризуется наличием кислотных центров как бренстедовского, так и льюисовского типа; концентрация кислотных центров выше, а сами центры имеют значительно большую силу даже при общем содержании оксида цинка в смешанном оксиде около 5%. На поверхности смешанного оксида имеются кислотные центры с силой Н0 < <+3,3, Н0 < 1,5 и Н0 <— 3. Применение для модифицирования поверхности диоксида титана соединений магния приводит к появлению основных центров, а введение фосфорной кислоты на стадии солевой обработки метатитановой кислоты при получении анатазной модификации усиливает кислотный характер поверхности пигмента.
Кислотность поверхности сульфида цинка также в значительной степени зависит от температуры прокаливания. При повышении температуры прокаливания от 300 до 650 °С значительно снижается количество кислотных центров: с силой //0 <+6,8 с 2,8 до 0,06 ммоль/г, с силой Н0 <+4,8 с 2,5 до 0,06 ммоль/г, с силой Я0 <+4 с 1,5 до 0,01 ммоль/г. Непрокаленный сульфид цинка имеет на поверхности значительно меньшее количество кислотных центров.
Кислотность оксида хрома зависит от того, в какой атмосфере, окислительной или восстановительной, проводилась термическая обработка пигмента. В любом случае оксид хрома обладает весьма сильным кислотным характером поверхности, на которой обнаружены центры с кислотной силой #0<+3, #0<- 3 и Я0<—8. Образцы, прокаленные в атмосфере кислорода при температуре 500 °С, имеют на поверхности вдвое больше кислотных центров, чем образцы, прокаленные в атмосфере водорода. Высказано предположение [87, с. 70], что кислотные свойства оксида хрома, прокаленного в атмосфере кислорода, вызваны дефектами кристаллической структуры, которые ответственны и за полупроводниковые свойства оксида хрома.
Способы получения и последующей обработки оказывают очень сильное влияние на поверхностные свойства технического углерода. Свойства поверхности технического углерода определяются наличием на ней фенольных, лактоновых. хиноидных, карбоксильных и других групп. На поверхности технического углерода присутствую! гакже остатки не — разложившегося сырья в виде полициклических углеводородов. Высокая реакционная способность поверхности технического углерода приводит к значительной хемосорбции некоторых пленкообразователей, а также солей тяжелых металлов, используемых в качестве сиккативов. Наличие на поверхности фенольных групп ингибирует полимеризацию по радикальному механизму. Это,’ а также хемосорбция сиккативов в ряде случаев затормаживает процессы отверждения лакокрасочных покрытий и увеличивает расход сиккативирующих добавок.
Повышенное содержание связанного кислорода на поверхности технического углерода благоприятно сказывается на его диспергируе — мости в среде пленкообразователей и улучшает ряд свойств лакокрасочного покрытия, в частности блеск и степень черноты (что связано с лучшей диспергируемостью и меньшей склонностью к флокуляции). Для увеличения количества связанного кислорода на поверхности технического углерода разработаны различные способы его окисления.
На свойства поверхности пигментов очень сильное, а иногда решающее влияние оказывают примеси в готовом продукте исходных веществ или побочных продуктов, образующихся в ходе синтеза. Так, сильный кислотный характер железоокисных пигментов, получаемых гидролизом или термическим разложением сульфатов железа, чаще всего обусловлен наличием на поверхности плохо растворимых основных сульфатов. По зтой причине оксиды и гидратированные оксиды железа имеют высокую гидрофильность, вызывающую значительное поглощение влаги из воздуха. Это ухудшает ряд свойств железоокисных пигментов, в частности их диспергируемость в органических средах, приводя к сильному проявлению флокуляции. Применение зтих пигментов для водоразбавляемых лакокрасочных материалов требует их тщательной отмывки и модифицирования.
С целью модифицирования поверхности ряда пигментов, таких, как диоксид титана, железоокисные пигменты, свинцовые крона, их обрабатывают солями алюминия и кремниевой кислоты. При зтом на поверхности формируется модифицирующий слой, состоящий из смешанных оксидов алюминия и кремния с различным алюмосиликатным модулем.
На поверхности оксида алюминия имеются как кислотные, так и основные центры. Кислотные центры льюисовского типа, характеризующиеся силой Н0 <+3,3, Н0 <+1,5 и Но <—3 обусловлены наличием на
поверхности не полностью координированных атомов алюминия, которые при гидратации превращаются в кислотные центры бренстедовского типа [87, с, 581:
SHAPE \* MERGEFORMAT ![]()
![]()
![]() —О—А1+—О— + НОН———— —О—А1—О •
—О—А1+—О— + НОН———— —О—А1—О •
У’1
Основными центрами на поверхности оксида алюминия являются способные к обмену адсорбированные гидроксильные группы.
На поверхности оксида кремния имеются силоксановые группы (I), проявляющие слабую льюисовскую основность, и силанольные группы (II), имеющие кислотный характер (#0 < +4,8):
|
— Si —Si — |
|
/| II /| |
|
|
||
|
![]()
После прокаливания кислотно-основные свойства поверхности окси — ца кремния сильно понижаются, и она становится гидрофобной.
Силикаты алюминия, в отличие от индивидуальных оксидов алюминия и кремния, характеризуются наличием кислотных центров очень большой силы (#0 <— 8,2). В этом случае, как и в случае двойных солей гитана и цинка, наблюдается увеличение кислотного характера поверхности по сравнению с индивидуальными оксидами.
На поверхности силиката алюминия имеются кислотные центры как Зренстедовского так и льюисовского типа. Льюисовским кислотным центром является координационно-ненасыщенный атом алюминия, а 5ренстедовским — гидратированный льюисовский центр.
Концентрация кислотных центров на поверхности смешанных окси — Юв алюминия и кремния зависит от алюмосиликатного модуля. С рос — :ом содержания кремния в алюмосиликате содержание льюисовских кнтров убывает, а содержание бренстедовских центров проходит через максимум, соответствующий 70%-ному содержанию 8Ю2.
 7 сентября, 2013
7 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 