В реальных условиях эксплуатации нефтяных и газовых месторождений оборудование обычно соприкасается с эмульсиями типа «масло в воде» или «вода в масле». В сильнообводненных скважинах встречается обычно эмульсия первого типа, а в слабообводненных — второго типа. На первый взгляд может показаться, что в эмульсиях типа «вода в масле» коррозии не должно быть, поскольку нефть или углеводородный конденсат сами по себе, как правило, не отличаются агрессивными свойствами. Однако, как будет ниже показано, коррозия в них наблюдается и подчас довольно сильная. Объясняется это тем, что эта система при больших скоростях потока, очевидно, разрушается и металл периодически соприкасается с электролитом. Правдоподобность такого механизма подтверждается возможностью электрохимических измерений в эмульсиях типа «вода в масле». Высокая растворимость коррозионно-активных газов (О2, СО2, H2S) в углеводородах также способствует усилению коррозии.
Коррозию металлов в эмульсионных системах в связи со значительными экспериментальными трудностями начали изучать лишь в последнее время. Известно, что чем больше нефти в двухфазной системе, тем меньше коррозия. Однако носитель защитных свойств в подобных сложных системах до сих пор неизвестен. Поэтому большой интерес представляет исследование защитных свойств индивидуальных углеводородов. Такие сведения также важны для целенаправленного синтеза ингибиторов.
Для того чтобы понять коррозионное и электрохимическое поведение металлов в эмульсионных системах электролит — углево-
у,0м’1-см’1 дород, очень важно знать тип
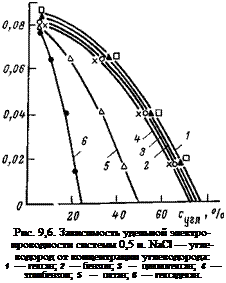 эмульсии. Его можно определить методом измерения удельной электропроводности. Если электропроводность растворов настолько мала, что ее не удается измерить, эмульсию относят к типу «вода в масле». На рис. 9,6 показано, как изменяется удельная электропроводность у эмульсий в зависимости от содержания в них углеводородов. Как видно, чтобы снизить электропроводность системы до нуля, требуется ввести в 0,5 н. NaCl около 80% гексана, бензола, циклогексиламина или этилбензола. Лишь углеводороды парафинового ряда октан и гексадекан способны образовать эмульсии типа «вода в масле» при меньшем содержании углеводорода в электролите, причем чем выше молекулярный вес углеводорода, тем меньшее количество его требуется для снижения электропроводности (сравните октан с гексадеканом).
эмульсии. Его можно определить методом измерения удельной электропроводности. Если электропроводность растворов настолько мала, что ее не удается измерить, эмульсию относят к типу «вода в масле». На рис. 9,6 показано, как изменяется удельная электропроводность у эмульсий в зависимости от содержания в них углеводородов. Как видно, чтобы снизить электропроводность системы до нуля, требуется ввести в 0,5 н. NaCl около 80% гексана, бензола, циклогексиламина или этилбензола. Лишь углеводороды парафинового ряда октан и гексадекан способны образовать эмульсии типа «вода в масле» при меньшем содержании углеводорода в электролите, причем чем выше молекулярный вес углеводорода, тем меньшее количество его требуется для снижения электропроводности (сравните октан с гексадеканом).
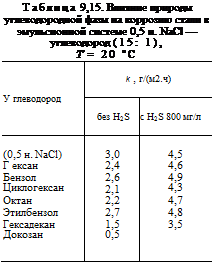
Образование эмульсии типа «вода в масле» и отсутствие электропроводности не гарантируют, однако, от коррозионного воздействия на металл электролита, что можно видеть из рис. 9,7. В отсутствие стабилизатора эмульсии любое соударение мицеллы о металл приводит к ее разрушению и смачиванию металла электролитом. В связи с этим полное подавление коррозии наблюдается лишь при 100%- ном содержании углеводорода. Однако природа углеводорода заметно влияет на коррозию: чем больше длина цепи молекулы углеводорода, тем меньше коррозия (табл. 9,15).
Как видно, алифатические углеводороды проявляют повышенные ингибирующие свойства. Увеличение (Молекулярного веса способствует более эффективному замедлению скорости коррозии стали (доказан>гексадекан > циклогексан > октан > гексан).
Алициклический углеводород цик
логексан эффективнее тормозит коррозию, чем гексан и бензол.
Однако в присутствии сероводорода все эти соединения оказываются малоэффективными. Лишь гексадекан уменьшает коррозию. Объясняется это тем, что низкомолекулярные соединения подавляют заметно лишь коррозионные процессы, протекающие с кислородной деполяризацией. В присутствии же сероводорода коррозионный процесс начинает протекать со значительной долей водородной деполяризации, а углеводород в связи с высокой растворимостью в нем H2S способствует его подводу к металлической поверхности. Поэтому для подавления сероводородной коррозии необходимо использовать высокомолекулярные соединения или другие соединения, адсорбция которых обусловлена неэлектростатическими силами.
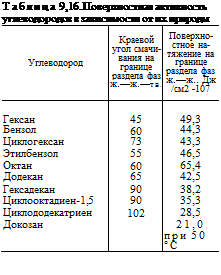
Способность индивидуальных углеводородов подавлять коррозию находится в прямой связи с их поверхностной активностью (табл. 9,16). Увеличение молекулярного веса алифатических углеводородов способствует, как это показано в табл. 9,16, снижению поверхностного натяжения на границе фаз, что облегчает образование эмульсии типа «вода в масле» и затрудняет коррозионное воздействие электролита на металл. Кроме того, увеличение молекулярного веса углеводорода повышает степень гидрофобизации поверхности, что также должно снижать коррозию.
 |
 |
Наличие непредельных связей в молекуле углеводородов облегчает адсорбцию, что хорошо иллюстрируется емкостными измерениями (рис. 9,8). Насыщенный углеводород додекан, адсорбируясь за счет сил физической адсорбции, снижает емкость и смещает минимум емкости к отрицательным значениям потенциала. Однако в присутствии циклододекатриена — углеводорода с тем же числом
углеродных атомов, как у додекана, но имеющим три двойные связи, положение резко меняется: емкость двойного электрического слоя сильно падает и, кроме того, она сохраняется на минимальном уровне в широкой области потенциалов (от 0,1 до 0,7 В). Это свидетельствует о том, что в адсорбции циклододекатриена помимо сил электростатического взаимодействия участвуют и силы специфической адсорбции за счет свободных электронов я-связей молекулы. Такой углеводород должен оказаться эффективным ингибитором в широкой области потенциалов.
![]()

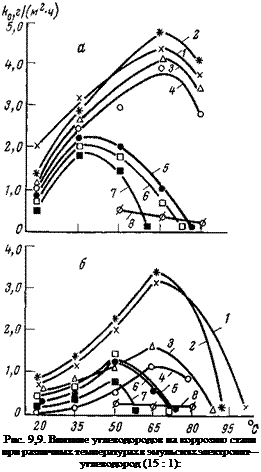
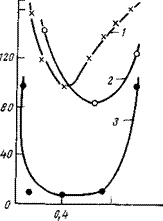 Защитные свойства углеводородов проявляются еще сильнее при повышенных температурах. В нашей работе совместно с Велиевой [205] был обнаружен интересный эффект, заключающийся в способности некоторых углеводородов практически полностью подавлять коррозию при повышенных температурах, в то время как при нормальной (20 °С) она в присутствии этих же углеводородов еще развивается. Так, гексан, бензол, циклогексан, октан и этилбензол подавляют почти полностью коррозию в интервале температур 61—90°С (2=97-^99%). Кроме того, обнаружено, что углеводороды способны не только снижать скорость коррозии, но и смещать максимумы на кривых зависимости скорости коррозии от температуры к более низким температурам (рис. 9,9).
Защитные свойства углеводородов проявляются еще сильнее при повышенных температурах. В нашей работе совместно с Велиевой [205] был обнаружен интересный эффект, заключающийся в способности некоторых углеводородов практически полностью подавлять коррозию при повышенных температурах, в то время как при нормальной (20 °С) она в присутствии этих же углеводородов еще развивается. Так, гексан, бензол, циклогексан, октан и этилбензол подавляют почти полностью коррозию в интервале температур 61—90°С (2=97-^99%). Кроме того, обнаружено, что углеводороды способны не только снижать скорость коррозии, но и смещать максимумы на кривых зависимости скорости коррозии от температуры к более низким температурам (рис. 9,9).
Обнаруженный эффект подавления коррозии мы связываем с явлением азеотропии. Указанные выше углеводороды образуют с водой азеотропные смеси, кипящие ниже температуры кипения воды (гексан/вода — 69,5 °С; бензол/вода — 69,3 °С; циклогек — сан/вода — 69,5 °С; октан/вода — 89 °С; этилбензол/вода — 91 °С). В результате происходит деаэрация воды при более низких температурах и снижение благодаря этому коррозии. Однако имеется и специфическое влияние самих углеводородов, поскольку в кипящих водных электролитах коррозия не снижается до такого значения, как в эмульсионных системах. Что касается докозана, который не образует азеотропных смесей, то механизм его действия иной. Он не удаляет кислород из системы, а замедляет коррозию благодаря адсорбционному взаимодействию с металлом.
Достоверность предлагаемого механизма подтверждается тем, что в 0,5 н. СНзСООН обнаруженный эффект не регистрируется: коррозия с ростом температуры непрерывно увеличивается как в
чистом электролите, так и в эмульсионной системе (в последней с несколько меньшей скоростью). Объясняется это тем, что процесс коррозии в уксуснокислом электролите протекает в основном с водородной деполяризацией и поэтому уменьшение растворимости кислорода в азеотропных смесях уже большой роли не играет. Если же снизить концентрацию уксусной кислоты до 0,0066 н„ обнаруженный эффект появляется, так как доля кислородной деполяризации возрастает.
 |
Поскольку высокомолекулярные соединения эффективно подавляют коррозию в эмульсионных системах, следует ожидать, что хорошими ингибиторами будут полимеры. Опыты показали, что
 а — Н20 (диет.)
а — Н20 (диет.)
 2 — этилбензол; 3 — октан; 4 — бензол; 5 — циклогексан; 6 7 — гексадокозан; 8 — докозан; б — 0,05 н. NaCl
2 — этилбензол; 3 — октан; 4 — бензол; 5 — циклогексан; 6 7 — гексадокозан; 8 — докозан; б — 0,05 н. NaCl
2 — этилбензол; 3 — октан; 4 — гексадекан; 5 — циклогексан; зол; 7 — гексан; 8 — докозан.
Рис. 9,10. Влияние алкилбен-
зилтриэта но л а м монийхл ор ид а
на емкость стального электро-
да в 0,5 н. НС1 + 100 мг/л H2S
(фон):
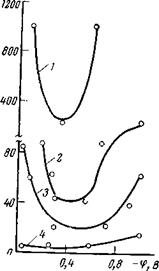 1 — фон; 2 — 100; 3 — 300; 4 —
1 — фон; 2 — 100; 3 — 300; 4 —
500 мг/л ингибитора.
полимеры, введенные в нефть в незначительных концентрациях (100 мг/л), подавляют на 90—95% коррозию стали в двухфазной системе 0,5 н. NaCl — нефть. Примечательно, что с ростом температуры защитные свойства полимеров возрастают. Это свидетельствует о химическом взаимодействии ингибиторов с металлом.
Для сероводородных сред эффективными ингибиторами
|
Таблица 9,17. Влияние концентрации алкилбензилтриэтаноламмонийхлорида на коррозию и наводороживание стали (Ст. 3)
* t = 80 °С. ** Наводороживание изучали при 20 °С в отсутствие С02. *** Числитель — скорость коррозии или наводороживание; знаменатель — защитный эффект, %. • |
являются также эфироаминоспирты и четвертичные соли аммония. Эффективность последних хорошо иллюстрируют данные, представленные в табл. 9,17. Оказалось, что достаточно ввести 200 мг/л алкилбензилтриэтаноламмонийхлорида
[R—~У—CH2N(СН2СН2ОН)з]С1 в модельные среды, имитирующие продукцию сероводородных газоконденсатных скважин (№ 1 табл. 9,17) или продукцию сероводородных нефтяных скважин (№ 2 табл. 9,17), чтобы получить почти 100%-ный защитный эффект [206]. Эта же концентрация ингибитора на 71,5—86,0% понижает наводороживание. Если же концентрацию ингибитора довести до 500 мг/л, то можно достигнуть 90%-ной защиты от на — водороживания. Емкостные измерения (рис. 9,10) показали, что алкилбензилтриэтаноламмонийхлорид очень хорошо адсорбируется на поверхности железа, причем по мере увеличения концентрации ингибитора в электролите степень заполнения поверхности возрастает, а область потенциалов, в которой наблюдается устой чивая адсорбция, расширяется.
 10 сентября, 2015
10 сентября, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 