;Поликонденсация карбамида с формальдегидом проходит в несколько стадий: присоединение формальдегида к карбамиду (гидроксиметилирование), приводящее к образованию метилольных производных карбамида, и их поликонденсация. Карбамид Н2Й—СО—МН2 имеет два реакционных центра типа ч ВН2 и теоретически может присоединить до четырех молекул. формальдегида.
При проведении реакции в нейтральной или щелочной среде (рН^7) первоначальными продуктами взаимодействия карбамида с формальдегидом являются метилольные производные:
TOC o "1-5" h z О О
II Н II
Нам—С—Ш2+СНаО 4=^ Нг1Ч—С—1ЧНСН2ОН (3.49)’
*-1
Монометилолкарбамид О О
II *2 II
Н21Ч—С—ШСН2ОН + сн20 ———— НОСН2Ш—С—ЫНСНаОН (3.50)
*-2
Аш-диметилол карбамид
О о СН2ОН
TOC o "1-5" h z II Н II /
Н2Ы—С—ШСН2ОН + СН20 н2ы—С—(3,51
*-3
СН2ОН
Асим-диметил олкарбамид
О о СН2ОН
II *4 II /
Носн2—ын-с—кн—СН2ОН + СН20 носн2—ш—с—
К-л
СН2ОН
Триметилолкарбамид (3.52)
О сн2он о СН2ОН
II / *5 II /
Н2М—С—+СН20 -1=ъ НОСН2ЫН—С—(3.53) *-* сн2он сн2он
Триметилолкарбамид
О сн2он НОСН2 О СН20Н
НОСНз—ЫН—С—N^ + СН20 /Ы—С—
*-в /
СН2ОН носн2 СН2ОН
Тетраметилолкарбамид (3.54)
Данные о величинах констант равновесия отдельных реакций, найденных при температуре 40 °С (pH 7), приведены ниже:
„ . Константа равновесия,
Реакция образования % л/моль
Монометилолкарбамида = 1 -103
Сши-диметилолкарбамида 7С2=2,5- Ю2
Асши-диметилолкарбамида /С3=0,2-102
Триметилолкарбамида:
Из сил-диметилолкарбамида /С4=0,2-102
Из асим-диметилолкарбамида К&—2-Ю2
Тетраметилолкарбамида Ке^К^.
Как видно из приведенных данных, все эти реакции (кроме образования монометилолкарбамида) являются практически обратимыми. Из-за низкой величины константы равновесия Кб вероятность образования тетраметилолкарбамида невелика.
При соотношении формальдегид : карбамид = 2,5 : 1 (pH 8,5) основными продуктами реакции являются сши-диметилол — и триметилолкарбамид (рис. 3.13). Тетраметилолкарбамид, как и следовало ожидать, не образуется. При увеличении соотношения формальдегид: карбамид лишь возрастает относительная доля триметилолкарбамида по сравнению с сгш-диме- тилолкарбамидом, однако тетраметилолкарбамид не образуется (рис. 3.14). Во всех случаях доля асим-диметилолкарбамида невысока.
Из данных по составу продуктов очевидно, что при введе-
|
|
|
£,%{тп) — 5,%(мол) |
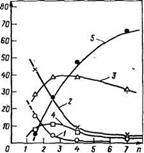 •Рис. 3.13. Изменение состава продуктов реакции карбамида с формальдегн — .дом (соотношение 2,5: 1) во времени при pH 8,5 и 70 °С:
•Рис. 3.13. Изменение состава продуктов реакции карбамида с формальдегн — .дом (соотношение 2,5: 1) во времени при pH 8,5 и 70 °С:
Л — карбамид; 2 — моиометилолкарбамид; 3 — симметричный диметилолкарбамид; 4 — асимметричный диметилолкарбамид; 5 — триметилолкарбамвд
Рис. 3.14. Зависимость состава продуктов реакции карбамида с формальдегидом при pH 8,5 от соотношения компонентов п (формальдегид: карбамид) (продолжительность реакции 30 мин, температура 70 °С):
./ — карбамид; 2 — моиометилолкарбамид; 3 — сим — диметилолкарбамид; 4 — асим-р. чме — тилолкарбамид; 5 — триметилолкарбамид
Нии метилольной группы уменьшается реакционная способность образующейся иминной группы. Именно поэтому мала доля ааш-диметилолкарбамида в сравнении с долей ош-диметилол — карбамида в составе продуктов реакции.
Влияние метилольных групп на реакционную способность оставшихся ЫН-групп в карбамиде часто объясняют образованием внутримолекулярных водородных связей. Однако следует отметить, что это объяснение не совсем верно, поскольку как в симметричном, так и в асимметричном диметилолкарбамиде
Возможно образование двух водородных связей —О—Н…О^
Ш ^О…Н—стабилизирующих молекулу:
Н Н Н
І
|
Рис. 3.15. Зависимость константы скорости реакции гидроксиметилирования карбамида К от pH при различных тем — /0 пературах: /-35“С; 2 — 40°С (К-6 10*) |
|
К, лЦмО/П’С) |
![]()
 Если бы значения констант равновесия определялись в основном возможностью образования водородных связей, константы Ка и Кб были бы близки; в действительности же они различаются на порядок. По-видимому, реакционная способность определяется в основном электронной плотностью на атоме азота.
Если бы значения констант равновесия определялись в основном возможностью образования водородных связей, константы Ка и Кб были бы близки; в действительности же они различаются на порядок. По-видимому, реакционная способность определяется в основном электронной плотностью на атоме азота.
Поскольку карбамид является слабым основанием, некаталитическая реакция гидроксиметилирования протекает с невысокой скоростью: при pH 7 и 30 °С составляет 0,56- •10~4 л/(моль-с). При катализе основаниями реакция заметно ускоряется (рис. 3.15). Особенно эффективен основной катализ при рН>8. Основной катализ сводится к активированию нуклеофильного агента (карбамида) за счет отрыва протона от атома азота с образованием соответствующего аниона:
|
|
||
|
|||
Который затем легко реагирует с формальдегидом:
|
О н II — / —С—№1+ 0=с/ Н О II М—с—гчн—сн2о+н2о ^ |
 О
О
1М—С—ІМН—сн20; (3.57)
/
О
N—С—ЫНСНгОН + ОН. (3.58)
|
О |
![]() Метилольные производные карбамида при рН>7 относительно стойки вплоть до температуры порядка 60°С. При более высокой температуре они конденсируются с образованием диметиленэфирной связи:
Метилольные производные карбамида при рН>7 относительно стойки вплоть до температуры порядка 60°С. При более высокой температуре они конденсируются с образованием диметиленэфирной связи:
О
—га—с—ш—сн*он+носн2—г^н—с—ш—
О о
II II
-Ш—С—МН-СН.,—О—СН2—МН—С—Ш— 4- н20. (3.59)
Эта реакция не подвержена основному катализу.
Принципиально возможен и кислотный катализ реакции карбамида с формальдегидом (см. рис. 3.15), при котором карбамид реагирует с протонированной молекулой формальдегида. При этом могут образоваться не только метилольные) производные карбамида, но и метиленкарбамид:
Н н-^- ХС=0 + Н+^=± /С=0 (з. ео)
ОН ^ ОН
И-
>N-€—N4- "^С^6н:*=±:>н—с—М-СН.,—6н2 (3.61)
Н н
О н
>М~С-Г^-СНгОН + Н+ (3.62)’
0 I [ монометилолкарбамид
;гч-с—к-сн2-он2
О
С—N=0112 + Н20 + Н+ (3.63) метиленкарбамид
Метиленкарбамид — побочный продукт, не участвующий в образовании олигомера. Содержание его в составе продуктов реакции определяется величиной pH и типом растворителя. В безводных средах и при низких величинах pH метиленкарбамид является основным продуктом реакции. При проведении реакции в водной среде и более высоких значениях pH (рН~4) доля метиленкарбамида снижается, но все же остается довольно высокой.
В водной среде возможен гидролиз метиленкарбамида [реакция (3.63) обратима], однако доля его незначительна из-за плохой растворимости метиленкарбамида в воде.
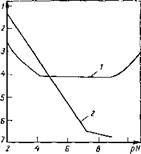
В то же время образующиеся метилольные производные в кислой среде легко конденсируются. Поликонденсация мети — лольных производных подвержена кислотному’ катализу и скорость ее резко возрастает при снижении pH с 7 до 2 (рис. 3.16).
Сущность кислотного катализа сводится к протонированию метилольной группы и образованию катиона с делокализован-
ным положительным зарядом, способного легко реагировать с амино-, имино — и метилольными группами:
|
|
|
(3.64) |
Реакция с амино — и иминогруппами карбамида приводит к образованию продуктов с метиленовыми мостиками:
|
;М—с—Ш—СН2—К—( + НгО, |
|
О |
|
О |
|
|
||
|
![]()
![]()
![]()
А при реакции с метилольными группами — к образованию продуктов с диметиленэфирными мостиками:
|
|
|
I! р М—с—1МН—СН2—ОН + НО—СН2—Ш—( =г=8= |
|
О |
|
О |
|
О |
![]()
|
О |
![]()
При рН<4 преобладает реакция (3.65), приводящая к образованию метиленовых связей, а при 4<рН<7 образуются как метиленовые, так и диметиленэфирные связи [реакция (3.65) и (3.66)]. Эти реакции являются основными при образовании олигомера.
Рассмотренные закономерности реакции карбамида с формальдегидом положены в основу технологии процессов получения карбамидоформальдегидных олигомеров. Как правило, синтез олигомеров проводят в две стадии. Вначале на первой стадии получают метилольные производные карбамида. Исходные вещества — формальдегид и карбамид — берут в мольном соотношении 2,5 : 1, при котором карбамид полностью вступает в реакцию, а основным продуктом гидроксиметилирования является диметилолкарбамид с примесями моно — и триметилол — карбамида (см. рис. 3.13, 3.14). Формальдегид обычно используют в виде водного раствора — формалина. Реакцию проводят в нейтральной или слабощелочной среде. При проведе-
Рис. 3.16. Зависимость констант скорости реакции К образования мономети — лолкарбамида (/) и его конденсации с карбамидом (2) от pH при 35 °С
 Нии процесса величина pH может сильно изменяться, поэтому необходимо тщательно контролировать этот показатель.
Нии процесса величина pH может сильно изменяться, поэтому необходимо тщательно контролировать этот показатель.
При введении в реакционную массу карбамида, являющегося слабым основанием, pH несколько повышается. Затем по мере вступления карбамида в реакцию происходит постепенное снижение pH. Кроме того, pH может снижаться за счет побочных реакций с участием формальдегида (особенно при рН>7). Это, в первую очередь, реакция Канниццаро:
Он
2СНгО+НаО ——— * СН3ОН+ НСООН, (3.67)
А также окисление формальдегида кислородом воздуха:
Он
2СН20+02 ———- ► 2НСООН. (3.68)
В средах, близких к нейтральным, доля этих реакций сводится к минимуму. Поэтому обычно pH поддерживают на уровне 7—7,5 добавлением аммиака или триэтаноламина. Гидрок — симетилирование карбамида проводят при температуре до 60 °С, при которой скорость конденсации метилольных производных сравнительно невысока. Реакцию ведут практически до полного израсходования карбамида. Проведение этой стадии в кислой среде нецелесообразно, поскольку при кислотном катализе реакция осложняется образованием метиленкарбамида [см. реакцию (3.63)].
Вторую стадию процесса — конденсацию метилольных производных — проводят при кислотном катализе, эффективном для этой реакции. Поскольку при низких значениях pH конденсация протекает слишком быстро даже при комнатной температуре и трудно поддается контролю, чаще всего ее проводят при pH 4,5—6 и умеренных температурах (70—90 °С). Под — кисление реакционной массы, учитывая относительно высокую величину pH, проводят слабыми карбоновыми кислотами — щавелевой, муравьиной и др.
Равновесный характер реакций конденсации метилольных производных обусловливает необходимость достаточно полного удаления воды из реакционной системы отгонкой, причем эту
Операцию безусловно нельзя считать лишь осушкой олигомера, поскольку при ее проведении происходит дальнейшее углубление процесса поликонденсации олигомера за счет сдвига равновесия реакций (3.65) и (3.66) в правую сторону.
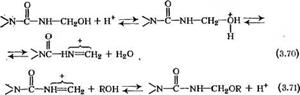
При получении модифицированных карбамидоформальде — гидных олигомеров наряду с разобранными выше реакциями большое значение имеет и реакция этерификации метилольных производных:
О
|
О
|
II
И—с—Ш—СН2СЖ + Н20. (3.69)
Эта реакция протекает как в кислой, так и в сильно щелочной средах, причем на практике ее проводят преимущественно в кислой среде. Механизм реакции можно представить следующим образом:
|
|
При синтезе модифицированных карбамидоформальдегид — ных олигомеров на первой стадии получают метилольные производные в нейтральной или слабощелочной среде. Полученные метилольные производные этерифицируют спиртами при рН<7. Предпочтителен режим pH 4,5—5,5 и температура 90°С. Для подкисления реакционной массы используют муравьиную, щавелевую кислоты или фталевый ангидрид. Спирты берут в избытке, обеспечивающем необходимую степень этерификации олигомера. Сразу после подкисления происходит быстрая этерификация метилольных групп вплоть до приближения к состоянию равновесия [см. реакцию (3.70) и (3.71)]. В дальнейшем преобладает реакция поликонденсации, которую обычно проводят с одновременной отгонкой воды. Скорость обезвоживания оказывает большое влияние на соотношение скоростей этерификации и поликонденсации, а следовательно, и на свойства олигомера.
В реакции поликонденсации принимают участие метилольные группы. Этерифицированные группы менее реакционноспособны и в процессах поликонденсации обычно не принимают участия.
Карбамидоформальдегидные олигомеры представляют собой в основном линейные олигомерные продукты, состоящие из звеньев вида
|
~—N—СНа—О—СН2—— 1 |
— — |
——N—СН2— — |
|
1 С=о |
II |
С=о |
|
Ш-сн2оя |
1 Ш—СН2(Ж_ |
В них содержится также небольшое количество разветвленных фрагментов — производных триметилольных производных карбамида.
Карбамидоформальдегидные олигомеры являются термореактивными и способны к дальнейшей самоконденсации, приводящей к образованию трехмерной структуры (особенно при рН<7).
Немодифицированные карбамидоформальдегидные олигомеры растворяются в воде, что обусловлено наличием в них гидрофильных метилольных групп и в значительной мере — невысокой молекулярной массой этих олигомеров. Свойства модифицированных олигомеров определяются главным образом природой спирта-модификатора. При использовании в качестве модификатора метанола, этанола и этилцеллозольва получают олигомеры, хорошо растворимые в воде и спиртах, но не растворимые в углеводородах. При увеличении длины алкильного радикала спирта-модификатора растворимость олигомеров в воде ухудшается, но улучшается растворимость в углеводородах. Так, олигомеры, модифицированные н-бутанолом, хорошо растворяются в углеводородах, но не смешиваются с водой. Спирты с большей длиной алкильного радикала для модификации карбамидоформальдегидных олигомеров обычно не используются, поскольку этерификация этими спиртами затруднена из-за их плохой растворимости в реакционной смеси.
Различие в растворимости отдельных видов карбамидоформальдегидных олигомеров дает возможность использовать их для получения как органо-, так и водорастворимых (водоразбавляемых) лакокрасочных материалов.
В лакокрасочной промышленности наибольшее применение находят органорастворимые олигомеры, модифицированные н-бутанолом.
 7 сентября, 2013
7 сентября, 2013  admin
admin 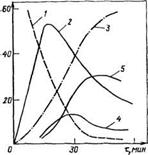
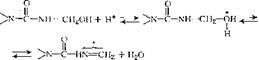
 Опубликовано в рубрике
Опубликовано в рубрике 