Поликонденсация меламина с формальдегидом состоит из серии последовательно-параллельных реакций: гидроксиметили-
Рования меламина и последующей конденсации его метилольных производных.
Гидроксиметилирование меламина происходит по аминогруппам. Присутствие трех реакционных центров типа ВН2 в молекуле меламина дает возможность присоединять к нему до шести молекул формальдегида с образованием гексаметилол — меламина:
1М(СНгОН)2
(СН2ОН)К/ [(СН2ОН),
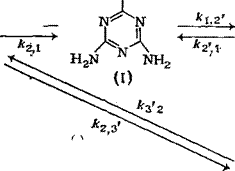
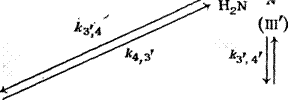
Схема последовательно-параллельных реакций гидроксиме — тилирования меламина, включающая образование продуктов с различной степенью замещения, приведена на рис. 3.17: Это
Равновесные реакции и протекают они с небольшим экзотермическим эффектом (—ДЯ=13 кДж/моль формальдегида).
Ниже приведены константы равновесия реакций гидрокси- метилирования меламина М (£=48°С; pH9):
Кмл 26,5 ЛГ2.з 4,4 /Сз,4 2,9 /С4.г, 1,3
Я. 2 12,0 Кгз’1,8 , *у4’0,47 К4′ в 21,0
ЛГ,;, 0,85 /С2;,з’ 24,5 7,2 /С*.’. 0,6
Уменьшение констант равновесия в ряду Кму, Кх,2‘, Кг. з; Кз,4; Кь, ь /Сб,6 (соответственно 26,5; 12,0; 4,4; 2,9; 1,3 и 0,6) свидетельствует о затруднении гидроксиметилирования с увеличением степени замещения.
Константы скоростей прямых реакций гидроксиметилирования 103 л/(моль-ч) при 48 °С и рН-9 приведены ниже:
*м,, 14,6 *2,з 5.83 *4.5 3,83
*1,2 18,4 Аг. з’8,34 *(з+з’м 4,0
*1.2′ 9,7 *2,(з+з1 > 15,7 *5,6 1,65
Как видно из приведенных данных, константы скорости первого (&М.1) И второго (*1,2) присоединения выше, чем константы скорости последующих присоединений. Особенно мала константа скорости образования гексаметилолмеламина (&5,б). В то же время различия в величинах констант равновесия и скоростей отдельных реакций не настолько значительны, чтобы исключить конкурентную способность какого-либо вида взаимодействия. Поэтому в результате гидроксиметилирования обычно образуется смесь продуктов с различным числом метилольных групп в молекуле. Состав смеси в значительной степени зависит от исходного соотношения формальдегида и меламина в реакционной системе (табл. 3.3). Изменение сос-
Мн2
|
~ АКЛ *5/ А-ы^ 111^ и г<хти Г* >т/^Т_Г пи П Т 14 Т |
|
N(01^0^2 К*? |
|
, _*4»5 . АЛ |
|
Нон2сын 14 га2 (И) |
|
ЫНСН2ОН <_Аг Лкл |
|
Лл |
|
Кнсн2он |
|
№4,3 |
|
3,4 |
|
АЛ |
|
ЫН, |
|
(и’) |
|
|
||
|
|||
 |
|||
|
|||
 |
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
 |
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
|||
|
5*, %(мол)
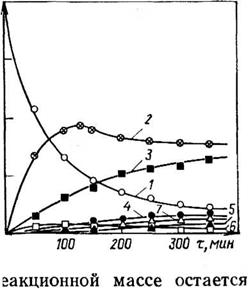 Рис. 3.18. Изменение состава продуктов ЮО реакции меламина с формальдегидом (соотношение 5:1) во времени при pH 9 (5 — степень превращения); обо — 7,- значения — по схеме на рис. 3.17:
Рис. 3.18. Изменение состава продуктов ЮО реакции меламина с формальдегидом (соотношение 5:1) во времени при pH 9 (5 — степень превращения); обо — 7,- значения — по схеме на рис. 3.17:
/ — мела мин (М); 2 — монометилолмеламин (I);
3—Ы^’-диметилолмеламин (II); 4 —
Триметилолмеламин (III); 5 — М. Й.М’.М" — тет — раметилолмсламин (IV); 6 — М, М-днметилолмел — 50 амин (1Г); М. М.М’-триметилолмеламин (III’)
25
Тава продуктов в ходе процесса гидроксиметилирования можно проследить по рис. 3.18 и 3.19.
Как видно из приведенных о данных, при соотношении формальдегид: меламин, равном 1, в р< значительное количество непрореагировавшего меламина ( — 60%). При соотношении, равном 3, основными продуктами являются моно — и диметилольные производные меламина. При увеличении указанного соотношения до 5—7 в составе продуктов наряду с моно — и диметилольными производными содержится значительное количество три — и тетраметилольных производных. Гексаметилолмеламин обнаруживается в составе продуктов лишь при соотношении формальдегид: меламин >10, но доля его остается невысокой; даже при увеличении этого соотношения до 30 образуется лишь около 12% гексаме — тилолмеламина.
|
Таблица 3.3. Состав продуктов гидроксиметилирования меламина при различных исходных соотношениях формальдегид: меламин (pH 9, 1=40°С, х=24 ч)
|
|
* Обозначения продуктов — см. рис. 3.17. |
Причиной значительного содержания в составе продуктов производных с невысокой степенью замещения являются низкие значения констант равновесия реакций гидроксиметилиро — ваиия. Поэтому для того, чтобы получить продукты с достаточно большим числом метилольных групп в молекуле при отсутствии непрореагировавшего меламина, необходим значительный избыток формальдегида. Как видно из данных табл. 3.4, меламин полностью вступает в реакцию лишь при соотношении формальдегид : меламин">7.
Гидроксиметилирование меламина с заметной скоростью протекает даже в отсутствие катализатора при температурах 35—50 °С. Реакция подвержена катализу кислотами и основаниями.
Основной катализ сводится к повышению нуклеофилыюсти меламина за счет отрыва протона от одной из NH2-rpynn:
TOC o "1-5" h z N N
С—NH2+OH — С—NH + H20; (3.72)
N H N
/ Ч — М — Ar / Ч
С—NH+ ,С=0 С—NH—СН20~. (3.73)
Трудность отрыва протона от такого сильного основания, каким является меламин, обусловливает эффективность основного катализа лишь при высоких значениях pH (>9,5).
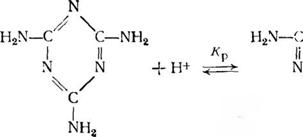
Специфика меламина как сильного одноосновного основания особенно заметно проявляется при кислотном катализе. В присутствии кислоты меламин практически полностью пре-
|
Рис. 3.19. Изменение состава продуктов реакции меламина с формальдегидом (соотношение 30: 1) во времени при pH 9 (5 — степень превращения); обозначения по схеме на рис. 3.17: I — Ы^’-диметилолмеламин (II); 2 — К, К’,М"-триметилолмеламин (III); 3 — Ы. Ы.Н’-три — метнлолмеламин(ІІГ); 4 — М, М,К’,М"-тетраметилолмеламин (IV); 5 — М, К,М’,М/,М"-пента- метилолмеламин (V); 6 — гексаметилолмеламин (VI) |
Вращается в одноосновную сопряженную кислоту:
|
С—ЫН* ЫН |
|
/ |
|
С |
|
II |
|
Ын2 |
|
|
|
|
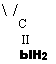 |
|
+
Константа равновесия этой реакции л;105. Поэтому добавление кислоты в количестве до 1 1Моля на 1 моль меламина (pH>2) не только не приводит к увеличению скорости реакции, но даже, напротив, замедляет ее из-за низкой активности протонироваипой формы меламина (рис. 3.20). В силу изложенного кислотный катализ оказывается эффективным лишь при условии, что соотношение кислота : меламин больше единицы (рН<2). В этом случае возможно активирование формальдегида по механизму кислотного катализа:
N Н Нч + N
^ ЧС-Ы^ + ;С^ОН ш—СН2ОН + Н+ (3.75)
Поэтому скорость реакции гидроксиметилирования меламина при pH<2 резко возрастает.
Поликонденсация метилольных производных меламина начинается сразу же после их образования. Эта реакция может сопровождаться образованием метиленовых (—СН2—) и ди — метиленэфирных (—СН2—О—СНг—) мостиков:
|
(3.76) |
![]() И—ЫН—СН2ОН+НаЫ—И ** ^ И—ЫН—СН2—’ЫН—И + Н20;
И—ЫН—СН2ОН+НаЫ—И ** ^ И—ЫН—СН2—’ЫН—И + Н20;
2И—ЫН-СН2ОН ^ Я—ЫН—СН2—О—СН2—ЫН—И+НгО, (3.77)
Где И — остаток меламина.
Механизм этих реакций, в значительной мере подверженных кислотному катализу, может быть представлен следующим образом:
К—ЫН—СН2ОН+Н+ =** [И—ЫН=СН2
|
(3.78) |
![]() *—■ И—ЫН—СН2]+Н20,
*—■ И—ЫН—СН2]+Н20,
I
Рис. 3.20. Зависимость логарифма константы скорости реакции гидро — ксиметилирования К меламина от pH при катализе НС1. Концентрация формальдегида и меламина составляет 0,094 моль/л; соотношение концентраций катализатора НС1 и меламина при pH 2,2—1
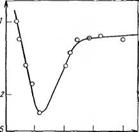 Относительная доля реакций (3.76) и (3.77) определяется условиями проведения процесса (pH, исходное соот — ’ 0 2 4 "6 е pH ношение формальдегид: мела-
Относительная доля реакций (3.76) и (3.77) определяется условиями проведения процесса (pH, исходное соот — ’ 0 2 4 "6 е pH ношение формальдегид: мела-
Мин).
Следует отметить относительно малую устойчивость диме — тиленэфирных мостиков, которые сравнительно легко обратимо разрушаются [см. реакцию (3.77)], а также могут превращаться в метиленовые, например при рН>7, по схеме:
R—NH—СН2—О—СНо—NR + ОН R—N—СН2—О—СН2—NR + Н20,
I i
(3.81)
R—N—СН2—О—СН2—NH—R ^
^ R—N=CH2+0—СН2—NHR’, (3.82)
R—N =СН2 + Н—N— *=ь R—NH—СН2—N—R’. (3.83)
I I
Н н
Наибольшая скорость образования метиленовых мостиков наблюдается при pH, близком к 4 (рис. 3.21).
Продукты конденсации меламина с формальдегидом представляют собой термореактивные продукты разветвленной структуры, содержащие функциональные СНЬОН — и NH-rpyn — пы. Триазиновые циклы в этих олигомерах связаны между собой метиленовыми и, отчасти, диметиленэфирными мостиками.
Рассмотрим теперь основы технологии получения мелами — ноформальдегидных олигомеров с учетом разобранных выше закономерностей реакций, протекающих при их синтезе. Так же, как и в случае карбамидоформальдегидных олигомеров, процесс целесообразно проводить в две стадии. Гидроксимети — лирование меламина проводят чаще всего с использованием водного раствора формальдегида при избытке последнего, достаточном для полного вступления меламина в реакцию и преимущественного образования ди — и триметилольных производных с небольшой долей тетраметилольных производных.
Рис. 3.21. Зависимость концентрации * метиленовых мостиков [—СН2—] на
1 моль меламина С от pH при различной продолжительности конденсации ди — метилолмеламина при 50 °С:
|
[—сн2 — ]1моль |
![Основные закономерности синтеза меламиноформальдегидных олигомеров подпись: [—сн2 — ]1моль](/img/705/image542.gif) У —30 мин; 2— 1ч; 3 — 1,5 ч; 4 — 3 ч; 5 —
У —30 мин; 2— 1ч; 3 — 1,5 ч; 4 — 3 ч; 5 —
17 ч
0,5
Из изложенного выше очевидно, что соотношение исходных веществ формальдегид : меламин должно быть не менее 7 (чаще всего используют соотношение, равное 8). Меламин плохо растворяется в воде и водном растворе формальдегида при низких температурах, что обусловливает необходимость повышения температуры на стадии гидро — ксиметилирования до 70—80 °С. При повышении температуры в свою очередь исключается необходимость использования ка тализатора, и эту стадию процесса проводят при pH около 8, не допуская его уменьшения ниже 7. Снижение величины pH происходит за счет тех же побочных реакций, протекающих с участием формальдегида, что и в случае карбамидоформальде — гидных олигомеров. Такое снижение величины pH может привести к резкому уменьшению скорости процесса (см. рис. 3.20) за счет превращения меламина в неактивную форму сопряженной кислоты.
Поликонденсацию метилольных производных проводят при кислотном катализе и величинах pH, обеспечивающих достаточно высокую скорость процесса поликонденсации (pH 4,5— 5,5). Равновесный характер реакций поликонденсации метилольных производных меламина обусловливает необходимость удаления воды в конце процесса для сдвига равновесия в правую сторону. Обычно воду удаляют отгонкой.
Процесс получения модифицированных спиртами меламино — формальдегидных олигомеров не имеет особых отличий от процесса получения аналогичных карбамидоформальдегидных олигомеров: вначале проводят гидроксиметилирование меламина (pH 8—8,5 и температура 80 °С), а затем — одновременно этерификацию метилольных производных и их поликонденсацию при pH 4,5—5,5 и 85—90 °С.
Как и в случае карбамидоформальдегидных олигомеров, для модификации меламиноформальдегидных используют различные спирты: метанол, этанол, этилцеллозольв и н-бутанол.
В структуру модифицированных меламиноформальдегидных олигомеров помимо функциональных —СН2ОН — и ГМН-групп входят также этерифицированные метилольные группы СНгОИ.
Свойства олигомера могут варьироваться в широких пределах в зависимости от вида спирта-модификатора и его количества, введенного в состав олигомера.
 7 сентября, 2013
7 сентября, 2013  admin
admin 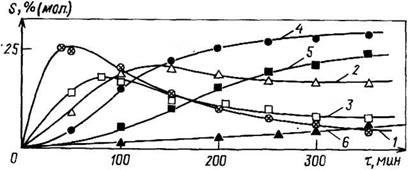
 Опубликовано в рубрике
Опубликовано в рубрике 