Радикальная полимеризация инициируется начальными активными центрами радикального типа. Для их генерирования в реакционной смеси можно использовать внешнее воздействие на мономер (нагревание, фотолиз, радиолиз) или получение свободных радикалов из различных соединений, называемых инициаторами. В подавляющем большинстве случаев применяют инициаторы, вводимые непосредственно в исходную реакционную смесь.
Инициирующими веществами служат соединения, имеющие в молекуле лабильные связи О—О, N—Н, С—N и др., при гемолитическом разрыве которых возникают свободные радикалы. Энергия диссоциации связи инициаторов обычно должна составлять 100—170 кДж/моль, поскольку такие соединения распадаются на радикалы с технологически приемлемой скоростью.
Практическое применение (из-за доступности и достаточной стабильности) нашли пероксиды, гидропероксиды и некоторые азосоединения.
Пероксидные инициаторы распадаются на радикалы по реакции:
ШОИ —>- 2ИО* (1.70)
Возможен вторичный распад радикала ИО» с образованием радикала более простой структуры. Однако в присутствии не
Предельных соединений вторичный распад подавляется, и первичный радикал взаимодействует в основном с мономером. Чаще других используют ацилпероксиды — пероксид бензоила, пероксид ацетила, алкилпероксиды — пероксид изопропилбензола (кумола), пероксид грег-бутила.
Гидропероксиды подвергаются гемолитическому распаду по реакции
ИООН —ИО-+НО — (1.71)
Из гидропероксидов чаще применяют гидропероксид изопропилбензола, гидропероксид грег-бутила.
Инициаторами могут быть и неорганические пероксиды — Н2О2, персульфаты и другие соединения. Так, персульфат широко используется при эмульсионной полимеризации в водной среде:
-ОзБ—О—О—БОз — —► гОБО-г. (1.72)
Разложение диацильных пероксидов ускоряется в присутствии аминов, образующих с ними окислительно-восстановительные системы, (редокс-системы), которые можно применять при пониженных температурах (<50 °С). Например, пероксид бензоила в присутствии восстановителя Ы, Ы-диметиланилина распадается во много раз быстрее, чем в его отсутствие.
В состав редокс-систем могут входить Н2О2, органические пероксиды и гидропероксиды и каталитические количества наф — тенатов Со, Си, РЬ. В этих условиях происходит попеременно окисление и восстановление металла самим гидропероксидом:
Ноон——- ► КО — + НО-
Ме"+ ——
1 —- V Меп+1
Иоон I (1.73)
2
• ‘
ИОО — + Н+
При этом, общая скорость процесса определяется реакцией 2.
Большое значение как инициаторы имеют азосоединения. Симметричные азосоединения распадаются гомолитически конкурентно по обеим связям С—N. а несимметричные — главным образом по одной связи в зависимости от стабильности образующихся радикалов:
И—К=К—И —»- + или
И—N=N1—И’ —И.-НК’Ыа. (1.74)
Так, широко используемый 2,2′-изобис(изобутиронитрил)ди — нитрил азоизомасляной кислоты — легко распадается при умеренных температурах.
Каждый инициатор применяют в оптимальном температурном интервале, в котором скорость разложения является технологически приемлемой (период полураспада должен составлять
3— 5 ч). Ниже приведены оптимальные температуры для некоторых инициаторов (°С):
TOC o "1-5" h z Динитрил азоизомасляной кислоты 50—70
Пероксид бензоила 70—95
Пероксид ацетила 70—90
Гидропероксид кумола 130—140
Пероксид трет-бутила 120—140
При радикальной полимеризации присоединение мономера к радикальному центру растущей полимерной цепи вновь приводит к образованию свободного радикала (макрорадикала). Поскольку этот радикал не отличается от предыдущего, происходит как бы регенерация свободного радикала, и поэтому процесс радикальной полимеризации можно рассматривать как цепную неразветвленную реакцию. Для этой реакции в данном случае характерна такая длина полимерной цепи, которая определяется числом прореагировавших молекул мономера в расчете на один свободный радикал, образовавшийся при реакции инициирования.
Для радикальной полимеризации можно составить общую кинетическую схему процесса в присутствии инициатора. При этом делают следующие допущения:
1) реакционная способность радикалов не зависит от длины полимерной цепи, которая при этом достаточно велика;
2) в реакционной системе устанавливается стационарное состояние в тот момент, когда скорости возникновения и гибели радикалов уравниваются.
Как и все цепные реакции процесс полимеризации проходит следующие стадии.
Стадия инициирования. Молекула инициатора I распадается с образованием первичных радикалов Я*:
*1
I Ш — (1.75)
*2
Радикал И* взаимодействует с мономером М, образуя вторичные радикалы ИМ» (активные продукты присоединения). Инициатор входит в состав полимера (для упрощения вторичные радикалы далее изображаются М*):
К’
И-+М ——- ► ИМ — (упрощенно — М-) (1.76)
Вторичный радикал М» начинает растущую полимерную цепь.
Поскольку к’ в уравнении (1.76), являющаяся константой скорости собственно реакции инициирования (присоединения первичного радикала к непредельной связи мономера), намного больше константы скорости разложения инициатора к в уравнении (1.75), реакция, описываемая этим уравнением, будет определять скорость реакции инициирования. Поэтому константой скорости реакции инициирования считают величину к, а не к’.
Тогда скорость реакции инициирования V» составит
|
(1.77) |
![]() Vя=2k^f[Ц,
Vя=2k^f[Ц,
Где I — концентрация инициатора; / — эффективность инициирования — доля радикалов, участвующих в реакции (1.76), от общего числа образующихся по уравнению (1.75) первичных радикалов.
На механизм инициирования в жидкой фазе (растворе) значительное влияние оказывает так называемый эффект клетки. Продукты распада инициатора (свободные радикалы И«) находятся в клетке, образуемой вокруг них молекулами растворителя (показана фигурными скобками):
|
(1.78) |
![]() Радикалы вне клетки, начинающие реакцию (1.76)
Радикалы вне клетки, начинающие реакцию (1.76)
|
|
•> Радикалы вне клетки, расходуемые на побочные реакции, неактивные продукты
Молекулы растворителя, окружающие радикалы И*, препятствуют удалению этих радикалов друг от друга (выходу их из клетки). Поэтому до выхода из клетки радикалы соударяются не только с молекулами, образующими клетку, но и между собой, вступая в обратную реакцию рекомбинации (константа &-1). Клеточным эффектом обусловлено влияние вязкости растворителя на распад инициатора: чем она выше, тем вероятнее обратная реакция рекомбинации (константа £-1). Если инициатор распадается с гемолитическим разрывом только одной связи, то при рекомбинации в клетке образуются преимущественно молекулы исходного инициатора. Вышедшие за пределы клетки свободные радикалы расходуются на инициирование полимеризации (константа к’) или побочные (константа к") реакции. Следовательно, можно записать: f=k’/(k,-^-k?/).
Стадия роста цепи. При росте цепи образовавшийся после инициирования активный центр — вторичный радикал М* (или ИМ.) —реагирует последовательно с молекулами мономера, причем после каждого элементарного акта присоединения мономера происходит регенерация реакционного центра на конце растущего макрорадикала.
Поскольку величина кр не зависит от длины полимерного радикала, уравнение для скорости реакции роста гр можно записать:
Г»р=Ар[М] [М-], (1.79)
Где [М] н [М-] — соответственно концентрация мономера и суммарная концентрация всех радикалов с размером М н более.
Стадия обрыва цепи. Обрыв (прекращение) полимерной цепи происходит путем бимолекулярного взаимодействия макрорадикалов. При этом исчезают активные радикальные центры, и макрорадикалы превращаются в полимеры, неспособные к дальнейшей реакции с мономером. Взаимодействие макрорадикалов может протекать по механизмам диспропорциони — рования с константой скорости к’о (1.80) или рекомбинации (соединения) с константой &"0 (1.81):
К" о
—► М*—СНа—СН*Х + М,-СН=СНХ (1.80)
|
К"о >■ М*—СН2— СН— СН—СН2—М* (1.81) |
2М х—СН2—СН—
X
X X
При диспропорционировании двух радикалов [уравнение (1.80)] образуются две макромолекулы, каждая с молекулярной массой, практически равной массе исходного макрорадикала. Рекомбинация [уравнение (1.81)] приводит к образованию одной макромолекулы с молекулярной массой, равной сумме молекулярных масс соединившихся радикалов.
Энергия активации при рекомбинации приблизительно равна 2 кДж/моль, а при диспропорционировании — 16—20 кДж/моль. Скорость реакции обрыва цепи ь0 равна:
1>о=ММ-]2, (1-82)
Где ко — константа обрыва цепи (к0=к’0+!{0").
Преобладание одного из механизмов обрыва может существенно влиять на молекулярно-массовое распределение полимера (рис. 1.10).
При диспропорционировании (кривая 1) функция имеет максимальное значение при наименьшей молекулярной массе и монотонно уменьшается по мере ее роста; при рекомбинации (кривая 2) функция имеет довольно широкий максимум. Изменяя температуру при проведении радикальной полимеризации, можно менять соотношение между реакциями обрыва — рекомбинацией и диспропорционированием, поскольку энергии активации этих реакций существенно различаются.
Поскольку скорость полимеризации постоянна вплоть до достаточно высоких степеней превращения (не считая нестационарного начального момента реакции), можно считать, что реак-
Рис. 1.10. Молекулярно-массовое распределение при радикальной полимеризации:
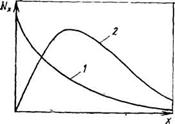 І — обрыв цепей диспропорцяонированием (распределение Флори); 2 — обрыв цепей рекомбинацией (распределение Шульца)
І — обрыв цепей диспропорцяонированием (распределение Флори); 2 — обрыв цепей рекомбинацией (распределение Шульца)
Ционная система находится в стационарном (квазистационар — ном) состоянии. Очевидно, это возможно, когда скорости возникновения (инициирования) и гибели (обрыва) свободных радикалов равны:
»« = £»0, (1-83)
Или, согласно уравнениям (1.77) и (1.82):
2^[/]=*0[М. р. (1.84)
В основном мономер расходуется за счет реакции роста (его расход на инициирование и передачу цепи очень мал). Поэтому величину г;р можно считать общей скоростью реакции полимеризации V, т. е. Vp—v. Тогда, решая совместно уравнения (1.79) для ир и (1,84), после необходимых преобразований, исключив. из уравнения (1.84) величину [М*], получим уравнение обшей скорости реакции радикальной полимеризации:
О=Ы*./М|/!!М1/2[М], (1.85)
Где кя — константа скорости реакции инициирования; к„=2Ы, поскольку к1 и / в данных условиях постоянны.
Особенностью уравнения общей скорости реакции полимеризации (1.85) является половинный порядок по инициатору — Это является характерным признаком радикальной полимеризации, обусловленным бимолекулярным обрывом цепей
[уравнение (1.82)]. При повышении температуры возрастает
Число образующихся радикалов инициатора, начинающих полимерную цепь, вследствие чего уменьшается средняя степень полимеризации, однако общая скорость полимеризации повышается, поскольку увеличивается число растущих полимерных цепей.
При передаче цепи происходит перенос реакционного центра с растущей полимерной цепи на другую молекулу мономера, растворителя, инициатора, полимера или других, иногда специально введенных, веществ:
МХ’+АВ———- ► М*В+ А — (отрыв атома),
|
Или |
![]() (1.86)
(1.86)
|
М-*+А |
Мд. А- (присоединение радикала)
где А’п — константа скорости реакции передачи цепи; М* — растущие полимерные цепи; МХВ — неактивные полимеры; А и АВ — молекулы передатчика цепи; А* и МХА’ —вновь образовавшиеся радикалы.
Если реакционная способность образовавшихся радикалов А* или МХА- равна или больше активности макрорадикалов М-*, то происходит передача цепи, поскольку возникшие радикалы могут вступать с мономером в реакцию реинициирования (регенерации цепи) с константой скорости
Ка
А — 4-М ——— э — АМ-. (1.87)
При передаче цепи рост материальной (полимерной) цепи прекращается, а кинетическая цепь может продолжаться с одновременным развитием уже другой материальной цепи.
В том случае, когда константа передачи намного превосходит константу роста (при близких значениях констант роста и реинициирования), образуется очень низкомолекулярный полимер, называемый теломером.
В том случае, когда активность АМ — меньше активности А* и реакция реинициирования не протекает, происходит ингибирование (замедление) реакции полимеризации. При ингибировании прекращается рост как материальной, так и кинетической цепи.
Реакции передачи цепи количественно характеризуют относительной константой передачи цепи &п/&р=С. Существенное значение могут иметь реакции передачи цепи на мономер, растворитель и полимер.
Степень полимеризации х зависит от величин констант скорости отдельных стадий реакции полимеризации. Степень полимеризации будет пропорциональна скорости роста цепи иР и обратно пропорциональна сумме скоростей реакций, прекращающих рост материальной цепи — обрыва у0, передачи на мономер Ип. м, на растворитель и„.р, инициатор ип.„ (передача на полимер в уравнение не включена). Следовательно:
Х=Х)р/ (Ко+^п. м + ^п. р + Уя. и). (1.88)
Реакции обрыва и передачи цепи, могут быть использованы на практике, например для стабилизации непредельных мономеров при их хранении и для регулирования процесса радикальной полимеризации.
Для стабилизации к мономерам добавляют вещества, называемые ингибиторами, способные обрывать растущие цепи. При этом сами ингибиторы превращаются в новые радикалы с очень малой активностью, не способные инициировать полимеризацию, т. е. начинать новую полимерную цепь. Кроме того, ингибиторы легко окисляются и поэтому разрушают пероксиды, образующиеся при взаимодействии мономера или радикала с кислородом воздуха. Ингибиторами являются хиноны (гидрохинон), ароматические амины, фенолы и другие соединения.
Реакции ингибиторов с радикалами можно записать в общем виде:
|
(1.89) |
![]() АГ«+А — Д» М* + А-,
АГ«+А — Д» М* + А-,
Где Мч — растущая радикальная цепь (или радикал инициатора); А — ингибитор; А-—продукт его превращения; кА — константа скорости реакции.
![]() Неактивные радикалы А* могут рекомбинировать (или дис — пропордионировать) с активными радикалами или между собой:
Неактивные радикалы А* могут рекомбинировать (или дис — пропордионировать) с активными радикалами или между собой:
|
1У
|
(1.90)
Константа ингибирования СА=кА1кр количественно характеризует этот процесс. Ее величина зависит от вида как ингибитора, так и мономера. Например, величины СА (ингибитор пара — бензохинон) при 55 °С равны: для метилметакрилата — 4,5; для стирола — 518. В первом случае реакция полимеризации замедляется, во втором наблюдается ее сильное торможение. В присутствии очень сильных ингибиторов реакция полимеризации не начинается, пока не израсходуется весь ингибитор (кинетические кривые имеют резко выраженный индукционный период).
В некоторых случаях при радикальной полимеризации применяют регуляторы, также обрывающие полимерные цепи. Однако они отличаются от ингибиторов тем, что при передаче цепи образуют новые радикалы с высокой активностью, вновь начинающие полимерные цепи. Вследствие этого общая скорость полимеризации практически не меняется, но преждевременный обрыв материальной цепи ведет к снижению молекулярной массы полимера. Снижение молекулярной массы пропорционально количеству добавленного регулятора, и это позволяет получать полимеры с нужной молекулярной массой. Для эффективных регуляторов константа переноса Сп = &п/&р близка к единице, поскольку константы скорости передачи кп и роста кр цепи практически равны. Активными регуляторами являются алифатические меркаптаны (особенно додецилмеркаптан).
Во многих случаях влияние растворителей на кинетику радикальной полимеризации не ограничивается только эффектом разбавления реакционной смеси. В этой смеси радикалы роста образуют, как правило, комплексы (например, я-комплексы) с мономером (К ••• М) или с растворителем (К ••• Б), причем к полимеризации способны только комплексы с мономером. Соотношение стационарных концентраций комплексов можно записать следующим образом:
|
[М]тм |
|
[S]ts |
|
||
|
||
Где Тм и тз — средняя продолжительность существования комплексов.
Влияние растворителей на общую скорость полимеризации можно учесть, введя поправочный коэффициент ф в уравне — «ие (1.85):
У,=*р(*и/й0),/г[П1/2[М]ф, (1.92)
Где
[Mio
<р=з———- , (1.93)
[S](ts/tm) + [MI
Здесь [М]0 — концентрация мономера в массе; v’ — скорректированная скорость реакции.
Как видно из уравнения (1.93), растворитель влияет на v как через мольный объем (при фиксированной объемной доле растворителя), так и через соотношение ts/tm. Влияние растворителя можно оценить качественно: добавление растворителя при ts/tm > 1 приводит к уменьшению, а при значении ts/tm <Г <1 — к увеличению скорости реакции; при ts/tm=1 проявляется только эффект разбавления.
Реакции полимеризации могут осложняться макрокинетиче — скими явлениями. Так, при радикальной полимеризации в массе (без растворителя) некоторых винильных мономеров при определенной степени превращения процесс резко ускоряется (гель-эффект), что обусловлено влиянием диффузионных факторов при нарастании вязкости системы.
 30 августа, 2013
30 августа, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 