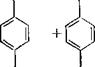
Взаимодействие фенола с формальдегидом с образованием олигомерных продуктов — сложная совокупность последовательно — параллельных реакций. Из них наиболее типичные и многократно повторяющиеся — присоединение формальдегида к фенолу (гидроксиметилирование фенола) и поликонденсация образовавшихся метилолфенолов между собой и с олигомерными продуктами. В этих реакциях функциональность формальдегида равна двум (одна функциональность реализуется в реакции гидроксиметилирования; другая — в реакциях, протекающих с участием образовавшейся из него метилольной группы). Незамещенный фенол проявляет функциональность, равную трем, которая реализуется по орто- и пара-положениям фенольного ядра, атомы углерода в которых имеют повышенную электронную плотность:
/ОН
|
|
В зависимости от количества и расположения заместителей в фенолах их функциональность может меняться от двух до четырех (см. табл. 3.1).
Заместители оказывают также большое влияние и на реак- ционную способность фенолов в реакции с формальдегидом, что видно из приведенных ниже данных (и0тн — относительная скорость взаимодействия с формальдегидом):
1, TOC o "1-5" h z
|
Фенол О-Крезол .«-Крезол 2,6-Ксиленол |
![]() 00 3,4-Ксиленол 0,83
00 3,4-Ксиленол 0,83
0,76 2,5-Ксиленол 0,71
2,28 3,5-Кснленол 7,75
0,16 2,3,5-Триметилфе- 1,49
НОЛ
Следует обратить внимание на высокую реакционную способность фенолов, имеющих электронодонорные заместители в лега-положении (например, ж-крезол, 3,5-ксиленол), сильно повышающие электронную плотность у реакционных центров.
Исключительно высокой реакционной способностью при поликонденсации с формальдегидом характеризуется резорцин. Наличие двух гидроксильных групп, расположенных в мета — положении относительно друг друга, способствует резкому повышению электронной плотности в активных центрах этого фенола, за счет чего его реакционная способность значительно повышается.
|
(3.18) |
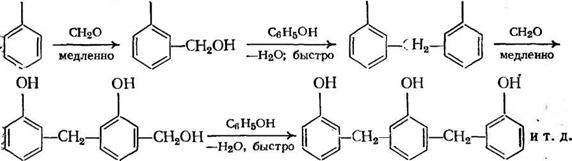
![]() Представим основные реакции синтеза фенолоформальдегидных олигомеров на примере реакций, протекающих в пара- положении. На первой стадии происходит образование мети — лольного производного фенола:
Представим основные реакции синтеза фенолоформальдегидных олигомеров на примере реакций, протекающих в пара- положении. На первой стадии происходит образование мети — лольного производного фенола:
|
|
|
ОН |
|
ОН |
СН2ОН
Монометилолфенолы далее могут вступать в реакцию конденсации с фенолом, образуя метиленовые мостики между фенольными ядрами:
Или друг с другом
ГНД
СН2ОН сн2он
(3.20)
Кроме того, возможно разрушение диметиленэфирной связи —СН2—О—СН2— с выделением формальдегида, что так же, как и в реакции (3.19), приводит к образованию метиленовых мостиков:
НО ОН НО ОН
|
|
|
|
|
![]()
![]()
Данные о величинах констант равновесия этих реакций при различных температурах приведены ниже:
25 °С 100 °С
Реакция гидроксиметилирования 8-103 яЛ-Ю*
Конденсация метилолфенолов с фено — я; I — 10е 3-106
Лом
Конденсация метилольных групп 9- Ю-2 9-10-3
Деструкция диметиленэфирной связи с 2-Ю6 5-106
Отщеплением формальдегида
Как видно из приведенных данных, константы равновесия реакций гидроксиметилирования (3.18), конденсации метилольных производных с фенолом (3.19) и переход диметиленэфир — ных связей в метиленовые (3.21) очень велики и их можно считать практически необратимыми. Единственной обратимой реакцией является образование диметиленэфирной связи (реакция 3.20).
Превращения, аналогичные реакциям (3.18)—(3.21), протекают и по орто-положениям фенола, однако соответствующие орто-замещенные продукты дополнительно стабилизированы за счет образования внутримолекулярной водородной связи, что приводит к некоторому изменению величины Др. Так, например, стабильность диметиленэфирного мостика несколько возраста-
Н н
/ ООО
|
|
Относительная доля метиленовых и диметиленэфирных мостиков в составе олигомера определяется величиной константы равновесия реакции образования диметиленэфирной связи [реакция типа (3.20)], которая меняется в зависимости от условий проведения процесса (среда, температура, катализатор и др.).
Следует подчеркнуть, что высокие значения константы равновесия К2 и Кз (>1-103) позволяют отнести процессы синтеза фенолоформальдегидных олигомеров к неравновесной поликонденсации. Это дает возможность вести реакцию в водной среде, что особенно важно, поскольку формальдегид — газообразное вещество и чаще всего его используют в виде водных растворов.
Рассмотренную выше совокупность реакций гидроксимети — лирования фенола и поликонденсации образующихся метилоль — ных производных принято называть конденсацией фенола с формальдегидом.
Конденсацию осуществляют при различном соотношении фенола и формальдегида, а также при разной величине pH (катализ кислотами, основаниями). В зависимости от условий проведения получают олигомеры разного строения.
Конденсация фенола с формальдегидом при кислотном
Катализе
Кислотному катализу подвержены как реакции гидроксимети — лирования, так и поликонденсации метилольных производных.
![]()
|
‘СН2ОН |
![]() Сущность кислотного катализа гидроксиметилирования — повышение злектрофильности формальдегида за счет его протонирования:
Сущность кислотного катализа гидроксиметилирования — повышение злектрофильности формальдегида за счет его протонирования:
|
|
|
|
|
ОН |
|
-сн2он |
+ н+ (3.23)
Аналогично гидроксиметилирование протекает и по «-положению.
Протонирование о — и л-метилольных производных приводит к образованию долгоживущих карбкатионов, которые в свою очередь реагируют как электрофильные агенты с фенолом иля с его гидроксиметильными производными:
![]()
|
:н2он |
![]()
![]()
|
+ н+ |
![]()
|
.сн2он _н2о |
![]() ОН ОН
ОН ОН
|
Он |
|
Нонгс |
![]()
|
Он |
![]()
|
,СН2ОН |
![]() (3.24)
(3.24)
|
|
|
•СН. |
+ Н+ (3.25)
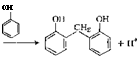
Образовавшиеся по реакциям (3.24) и (3.25) двухатомные фенолы претерпевают аналогичные превращения, в результате которых получаются олигомерные продукты.
Кислотный катализ эффективен в области pH 1—4. В более кислых средах проводить процесс нецелесообразно, поскольку в этих условиях снижается активность фенольного компонента в результате его протонирования по гидроксильной группе. Все рассмотренные реакции протекают легко при довольно низких температурах и сопровождаются выделением те:’ла (88 кДж на 1 моль фенола, вступившего в реакцию).
Учитывая различный характер активных центров, участвующих в конденсации фенола с формальдегидом, а также высокую функциональность реагирующих веществ (3 — у фенола и его метилольных производных; 2 — у формальдегида), можно с очевидностью утверждать, что в этом процессе одновременно протекает множество реакций, конкурентная способность которых определяет структуру образующегося олигомера.
Установлено, что в условиях кислотного катализа в реакциях гидроксиметилирования активность я-положений фенольных ядер примерно в 2,4 раза выше, чем активность о-положений. Еще большее различие отмечено в реакционной способности п — и о-положений фенольных ядер по отношению к метилольным группам (« в 12 раз). В то же время скорость реакций поликон — денсации с участием метилольных групп в указанных условиях
Намного (»в 8 раз) выше, чем скорость реакций гидроксимети- лирования. Такое большое различие в скоростях двух основных стадий синтеза (гидроксиметилирование и поликонденсация) является решающим фактором при определении оптимального мольного соотношения исходных реагентов при синтезе олигомеров. Очевидно, что в избытке формальдегида (соотношение формальдегид: фенол >1) процесс в кислой среде вести нельзя, так как это неизбежно приведет к гелеобразованию за счет образования трехмерного продукта. Поэтому при кислотном катализе синтез обычно проводят при недостатке формальдегида (соотношение формальдегид: фенол<; 1); при этом образующийся олигомер практически не содержит свободных метилоль — ных групп. Такие фенолоформальдегидные олигомеры, полученные в кислой среде (pH 1—3) при избытке фенола, получили название новолачных (новолаков).
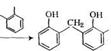
Брутто-схему процесса образования новолачных фенолофор — мальдегидных олигомеров можно представить следующим образом:
|
|
|
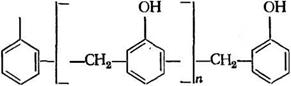
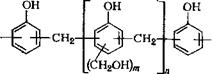
Структура новолачного олигомера приведена ниже: |
![]()
 (3.26)
(3.26)
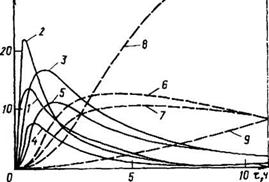
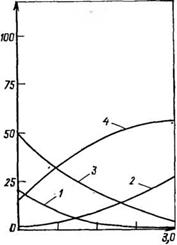
Структура и изомерный состав новолачных олигомеров в зависимости от соотношения исходных веществ (при 100%-ноЙ конверсии по формальдегиду) представлены в табл. 3.2, а изменение количества звеньев различной структуры — на рис. 3.1.
Из данных табл. 3.2 очевидно, что новолачные олигомеры имеют преимущественно линейное строение. В их цепи в основном содержатся бизамещенные фенольные ядра, связанные между собой орго-яара-метиленовыми мостиками. Доля орто — орго-метиленовых мостиков незначительна. Концевые звенья олигомера связаны с основной цепью практически исключительно по пара-положениям. Из-за высокой активности пара-поло — жений фенольных ядер в новолачных олигомерах остаются
|
№ |
Характеристика структурного |
Э. моль |
||
|
Элемента |
Ю.600 |
0,815 |
0,850 |
|
|
1 |
Звенья с о*л-замещенными ядрами фенола |
29,2 |
51,4 |
55,2 |
|
2 |
Звенья с о-о-замещенными ядрами фенола |
2,0 |
2,3 |
2,1 |
|
3 |
Тризамещенные фенольные звенья |
1,5 |
5,6 |
7,0 |
|
4 |
Концевые звенья, связанные с цепью в о-положений |
9,2 |
3,3 |
2,3 |
|
5 |
Концевые звенья, связанные с цепью в л-положении |
43,3 |
34,6 |
31,5 |
|
6 |
Свободный фенол |
14,5 |
2,5 |
1,5 |
|
С»*, мол. % |
С, пол. % 7 Л…………………. |
, |
— |
|
Таблица 3.2. Изомерный состав [% (мол.) новолачных олигомеров в зависимости от соотношений исходных веществ ((}) при 100%-ной конверсии формальдегида |
|
|
 ^сн2о >%
^сн2о >%
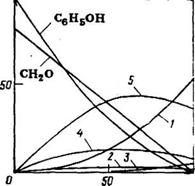
Рис. 3.1. Изменение звеньев различной структуры при получении олигомеров в условиях кислотного катализа в зависимости от степени превращения формальдегида (0=0,85). Обозначения кривых — см. табл. 3.2. На оси абсцисс — конверсия СНгО (%), на оси ординат — содержание звеньев Сзв [%(мол)]
Рис. 3.2. Изменение концентрации метилольных производных фенола (———— )
И продуктов их взаимодействия (—————- ) при получении резольных олиго
Меров в условиях основного катализа (№ОН) н §=2.
Метилольные производные: 1 — пара-, 2 — орто-• 3 — орто-, пара4 — орто-, орто-; 5 —
ОН
|
|
|
|
![]()
|
Г— СН2ОН; 8 — структурный элемент цепи вида НОНгС |
|
СН2ОН Узел разветвления |
|
О |
|
X) |
|
|— СН2~; 9 |
|
I Сна Г |
|
|
|
|
 |
Непрореагировавшими лишь орго-положения. При высокой степени завершения реакции по формальдегиду (р>0,7, рис. 3.2) в структуре олигомера появляются тризамещенные фенольные звенья. Их количество заметно возрастает с увеличением соотношения формальдегид: фенол (Р) и в конце процесса для £=0,85 составляет 7 мол. % (табл. 3.2).
Статистические расчеты показывают, что уже при Р=0,9 за счет увеличения доли трехзамещенных фенольных звеньев возможно образование геля. Поэтому на практике процесс получения новолачных олигомеров проводят обычно при р=0,85, тем более, что при этом соотношении количество свободного фенола в реакционной системе после завершения процесса невелика [не выше 1,5% (мол.)].
Обычно среднечисловая молекулярная масса новолачных олигомеров составляет 600—700.
Конденсация фенола с формальдегидом при основном катализе.
Основной катализ сводится к повышению активности фенола в реакции с формальдегидом. Эффективность основного катализа обусловлена в первую очередь способностью фенола реагировать с формальдегидом в форме псевдокислоты (С-Н-кисло — ты). Образование анионов псевдокислоты с высокой нуклео — фильностью можно представить следующей схемой:
ОН — О’- о о
|
|
|
1 + он- |
![]()
|
(3.27) |
![]() —
—
В н-
Локализация отрицательного заряда в орто- и пара-положениях соответствующих анионов псевдокислоты (б ив) обеспечивает их высокую реакционную способность с формальдегидом:
О о _ О-
|
+ н2с=о |
![]()
|
V-СН, ОН |
![]()
|
ГН2ОН |
![]()
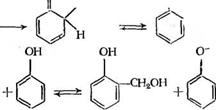 СНаСГ
СНаСГ
|
(3.28) |
![]()
|
(3.29) |
В результате реакции гидроксиметилирования образуются орто — и парс-метилольные производные фенола.
По схеме, аналогичной представленной выше, могут также
|
Образовываться ди — и триметилольные производные фенола: Он он он I—СН. ОН сн2о НОН2С^СН2ОН ^ — и |с„,0 | ОН ОН |
|
Сн2он (3.30) |
|
XX XX Сн2 с |
|
Сн2он |
|
+ н2о |
|
I СН2ОН СН2ОН СН2ОН Следует отметить, что при гндроксиметилировании активность реакционных центров в свободных орто — и пара-положениях метилолфенолов значительно выше, чем у исходного фенола, поэтому образование ди — и триметилольных производных происходит даже при избытке фенола в реакционной системе. Главной отличительной чертой проведения процесса при основном катализе является значительное превышение скорости реакции гидроксиметилирования по сравнению со скоростью реакции поликонденсации метилольиых производных (»на 1,5 порядка), что приводит к накоплению последних в реакционной массе. При поликонденсации протекает в основном реакция мети — лольных групп с активными центрами фенольных ядер мети- лольных производных и свободного фенола: он I сн2он (‘У но он |
|
И |
|
,—СНаОН СН20Н НОН2С^СН2ОН |
 |
|
 |
|
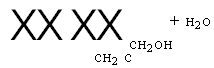 |
|
|
|
|
|
|
|
|
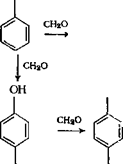
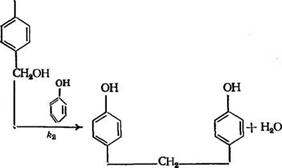
Поскольку при введении метилольных групп в ядро фенола возрастает активность его оставшихся свободных реакционных центров, реакция (3.31) протекает значительно быстрее, чем (3.32) (константа скорости &1 обычно в 2—3 раза больше, чем Л2). Это приводит к тому, что образующийся продукт конденсации обязательно содержит в своем составе метилольные группы.
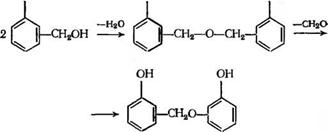
Принципиально возможна и реакция конденсации метилольных групп между собой (особенно при избытке формальдегида), однако из-за склонности образующейся при этом димети — ленэфирной связи к выделению формальдегида она в конечном счете также приводит к образованию соответствующих дифенил — метанов:
|
|
Конденсация фенола с формальдегидом при основном катализе— процесс экзотермический («58 кДж на 1 моль фенола).
Основной катализ эффективен при pH ^9. Из-за сильного различия в скоростях реакций гидроксиметилирования и по — ликонденсации при невысоких температурах метилольные производные мало активны. Их поликонденсация с заметной скоростью протекает лишь при температуре порядка 60 °С и выше.
Относительно низкая активность метилольных производных в реакции поликонденсации в этих условиях делает возможным проведение конденсации фенола с формальдегидом при основном катализе в широком диапазоне соотношений исходных компонентов, т. е. как при р<1, так и при р^1.
На практике конденсацию фенола с формальдегидом при основном катализе проводят при избытке формальдегида, т. е при р от 1,1 до 2,1.
Фенолоформальдегидные олигомеры, полученные при основном катализе обычно при избытке формальдегида, получили название резольных (резолов).
Брутто-схему процесса образования резолов можно представить следующим образом:
ОН ОН
Сн2о
Быстро
|
|
|
-> (НОН2С)г |
|
(СН2ОН)р (3.34) |
Где А=1-3; /,р=0-2;/л=0-1
Структура и изомерный состав резольных олигомеров определяется спецификой протекания реакции конденсации при основном катализе. Как уже упоминалось, большая активность метилольных производных в реакциях гидроксиметилирования и поликонденсации по сравнению с активностью свободного фенола обусловливает наличие в них метилольных групп, причем число последних в олигомере возрастает с увеличением соотношения формальдегид: фенол ((5). Фенольные ядра в резольных олигомерах связаны между собой в основном орто — яара-метиленовыми мостиками.
Степень разветвленности олигомера в значительной мере определяется избытком формальдегида. При {$=2 доля триза — мещенных фенольных фрагментов (т. е. узлов разветвления);
|
|
Составляет 7—8 [% (мол.)]. Основным структурным элементом резольного олигомера, полученного при этом соотношении компонентов, является трехзамещенное фенольное звено:
И ’
*
|
|
 Го 1,5 . ■ 2,0 2,5
Го 1,5 . ■ 2,0 2,5
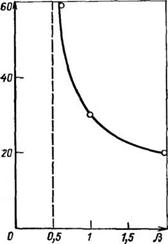
Рис. 3.3. Зависимость времени гелеобразования тгел от соотношения формальдегида и фенола р при синтезе резольных фенолоформальдегидных олигомеров в условиях основного катализа (НаОН)
Рис. 3.4. Зависимость содержания феиола (1), формальдегида (2), реакционных центров в о — и р-положениях (3) и метилольных групп (4) от исходного соотношения формальдегида и фенола.
Т. е. практически почти каждое элементарное звено резольного олигомера, синтезированного при р=2, содержит свободную метилольную группу.
Более полные данные об изомерном составе резольного фе- нолоформальдегидного олигомера, полученного при р=2, а также изменение состава реакционной массы в ходе его синтеза приведены на рис. 3.2.
Наличие свободных метилольных групп и узлов разветвления в резольных олигомерах, синтез которых проводят при температуре выше 60°С, не исключает возможности гелеобразования.
Статистическая модель процесса образования резольных олигомеров показывает, что гелеобразование теоретически невозможно лишь при большом недостатке формальдегида в системе, т. е. при р^0,5.
Экспериментальные результаты подтверждают этот вывод, показывая резкое уменьшение продолжительности гелеобразования от величины р (см. рис. 3.3).
Выбор оптимальных условий синтеза резольных олигомеров
И, в частности, соотношения р, проводят с позиций необходимо
Сти его осуществления до высокой степени завершения (по исходному сырью), а также практического исключения возможности гелеобразования в ходе процесса. Принимается во внимание также заданное содержание метилольных групп и свободных активных центров фенольных ядер. Наиболее благоприятным с указанных точек зрения оказывается ведение процесса при р = 1,5—1,7 (см. рис. 3.4).
Резольные фенолоформальдегидные олигомеры имеют сравнительно невысокую молекулярную массу (Мп от 250 до 700).
Образование фенолоформальдегидных олигомеров с высоким содержанием орто-связей
Замещению в орго-положение при конденсации фенола с формальдегидом способствует присутствие специфических катализаторов— ионов двухвалентных металлов, образующих комплексы с формальдегидом и хелатные соединения с фенолом, например 2.п, С<1, Мд, Са, Ва, Мп, Бг, Со, РЬ и др. Орто-направляющее влияние указанных катализаторов наиболее заметно при pH 4—7, когда каталитическое действие ионов Н+ и ОН — является минимальным. Поэтому в качестве катализаторов часто используют соли слабых карбоновых кислот, например ацетаты, а также оксиды или гидроксиды РЬ, Мп, Со, Сс1.
Соотношение продуктов орто — и пара-замещения при гид-
Роксиметилировании в зависимости от вида использованного
Катализатора приведены ниже:
TOC o "1-5" h z Ме(ОН)2 4,39
Са(ОН)2 3,08
КОН 1,33
|
Ме(он)2 _ + СН2=0 -<■ |
![]()
|
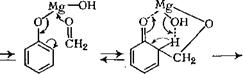
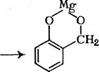
Н20 А^СШгОН + н20 ► [[Т +———— М£(ОН)2 (3.35) По указанному механизму могут быть получены как ново — лачные, так и резольные олигомеры. Синтез фенолоформаль- |
 Хелатный механизм орто-гидроксиметилирования фенола можно представить следующим образом:
Хелатный механизм орто-гидроксиметилирования фенола можно представить следующим образом:
Дегидных олигомеров с высоким содержанием ораго-замещения имеет большое практическое значение для получения быстро — отверждающихся материалов.
 5 сентября, 2013
5 сентября, 2013  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 