В основе процесса синтеза сложных олигоэфиров лежит реакция поликонденсации карбоновых кислот (или их производных) со спиртами.
Увеличение функциональности исходных мономеров (в отличие от модельной реакции монокарбоновых кислот с одноатомными спиртами) приводит к усложнению общей кинетической схемы процесса, которая даже в простейшем случае для пары бифункциональных мономеров (АА и ББ) уже представляется системой уравнений, включающих четыре различные константы скорости:
К!
АА + ББ —— >• АА—ББ;
АА—ББ + АА АА—ББ—АА;
(2.12)
Н
АА—ББ + ББ —— > ББ—АА—ББ;
Ьа
ББ—АА + ББ—АА —— >• (ББ—АА)г.
Простая кинетическая обработка таких процессов возможна при следующих трех допущениях:
Реакционная способность обеих функциональных групп мономеров одинакова;
При вступлении в реакцию одной функциональной группы бифункционального мономера реакционная способность другой не меняется;
Реакционная способность функциональной группы не зависит от размера молекулы, к которой она присоединена.
Можно ожидать, что после таких упрощений кинетика поли — этерификации будет идентична кинетике реакции монокарбоно — вых кислот и спиртов. Тогда в случае полного удаления низкомолекулярного побочного продукта процесс должен описываться кинетическим уравнением третьего порядка:
Х)=къ [СООН]2 [ОН], (2.13)
Где [СООН] и [ОН] — соответственно концентрация карбоксильных и гидроксильных групп в системе.
При этом каталитические процессы должны описываться уравнением второго порядка:
И=ЫСООН] [ОН], (2.14)
Где &2 — к [катализатор].
Полагают, что в этом случае молекулярно-массовое распределение олигомеров должно соответствовать распределению по Флори.
Однако при полиэтерификации приведенные выше кинетические закономерности соблюдаются лишь на поздних стадиях реакции (при степени завершенности более 80%), что можно объяснить следующим образом. Реакцию, как правило, проводят без растворителя. В этом случае среда вначале представляет собой смесь спирта и кислоты, а в конце процесса — олигоэфир.
Такое сильное изменение характера среды не может не сказаться на кинетике процесса. Кроме того, первоначальная смесь очень концентрированна и неидеальна с точки зрения термодинамики, в силу чего активность реагентов не может быть строго пропорциональна концентрации мономеров. Только на поздних стадиях реакции мономеры образуют относительно разбавленный и идеальный раствор в олигоэфире.
Для примера на рис. 2.1 приведены кинетические кривые полиэтерификации адипиновой кислоты с этиленгликолем, рассчитанные по уравнениям третьего (кривая а) и второго порядка (кривая б). Из рисунка видно, что третий порядок характерен для участка кривой от степени превращения 80 до 92,7%, который занимает, однако, 45% от общей продолжительности полиэтерификации. Изложенное выше дает полное основание считать, что отклонения от приведенных кинетических законо-
|
300‘ |
^ п А |
‘ & |
|
|
10 |
|||
|
У |
М |
||
|
180 |
Г/ |
Сґ |
|
|
Я |
Э2,7 ю |
— / |
|
|
30 6 |
-/—————————————————- |
||
|
20 |
80 2 |
Г |
|
|
^11 1 |
______ і______ 1_ 1______ 1-_к! |
|
65.7 <7Г |
|
33* |
|
Р.% |
![]()
|
Чоо 800 то то |
![]() Ш 800 1200 ИОО
Ш 800 1200 ИОО
Продолжительность, мин
Рис. 2.1. Анаморфозы кинетических кривых реакции диэтилен гликоля с ади — пиновой кислотой при 166 °С, рассчитанные по уравнениям третьего (а) и второго (б) порядка. Объяснение см. в тексте
Следует обратить внимание на то, что кинетическая картина процесса полиэтерификации в действительности оказывается еще более сложной, поскольку допущения, сделанные при выводе кинетических уравнений, не всегда правомочны. Так, например, далеко не всегда можно принять реакционную способность функциональных групп в мономерах одинаковой. Одинаковая реакционная способность характерна лишь для алифатических дикарбоновых кислот, в которых карбоксильные группы разделены метиленовыми мостиками —(СН2)Я— (для адипиновой кислоты /Сдис,1=^Сдис,2=4* 10-5), а также для многих диолов (этилен-, диэтилен-; 1,4-бутиленгликоль и т. п.). В полифунк — циональных ароматических кислотах наблюдается значительное различие в реакционной способности карбоксильных групп из-за эффекта сопряжения:
Константа диссоциации на 1-й ступени
Константа диссоциации на 2-й ступени
Изофталевая кислота 2,9-10 4 2,5-10-5
Терефталевая кислота 3,Ы0-4 1,5- 10_ь
Реакционная способность карбоксильных групп сильно различается и в малеиновой кислоте (КдИс, і=1,4-10-2; Кдис,2=8,6-10~7).
При использовании в качестве кислотных компонентов ангидридов (например, фталевого или малеинового) они реагируют со спиртами по схеме:
|
СО / СО |
|
0+ ИОН |
|
СООН |
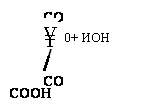 |
|
|
|
||
|
||
![]()
![]()
|
|||
|
|
||
|
|||
|
|||
|
|||
|
|||
![]()
![]()
При этом 118
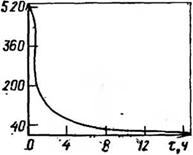
Быстрый и неравновесный характер реакции (2.15) позволяет разделить во времени две стадии взаимодействия ангидридов со спиртами: образование кислых моноэфиров и полиэтерификацию. Это приводит к резкому падению кислотного числа в начальный период процесса на стадии образования кислых эфиров (рис. 2.2). Можно предположить, что реакционная способность первичных и вторичных гидроксильных групп глицерина существенно различается, однако это различие не всегда наблюдается из-за ацильного обмена, особенно интенсивно проявляющегося в условиях высоких температур (выше 180 °С):
А р у а р V
СН2———— СН—СНа СН2——— СН————— СН2.—————- (2.17)
III III
По-видимому, именно этим объясняется кажущаяся равная реакционная способность гидроксильных групп в глицерине при температурах выше 180 °С.
 При выборе условий проведения технологического процесса следует иметь в виду равновесный характер реакции полиэтери — фикации и полипереэтерификации. Так, константа равновесия Кр полиэтерификации стремится к единице и не зависит от температуры, что объясняется близостью величин энергии активации прямой и обратной реакций (энергия активации адипино — вой кислоты с этиленгликолем равна 59,7 кДж/моль, а обратной реакции гидролиза — 58,5 кДж/моль). Поэтому изменением температуры нельзя добиться увеличения относительной доли прямой реакции. Введение катализаторов может оказать некоторое влияние на величину /Ср. Основные катализаторы не влияют на скорость прямой реакции, но приводят к увеличению скорости гидролиза. При применении кислых катализаторов возрастает скорость обеих реакций, и, хотя скорость прямой реакции возрастает сильнее, доля обратной реакции остается
При выборе условий проведения технологического процесса следует иметь в виду равновесный характер реакции полиэтери — фикации и полипереэтерификации. Так, константа равновесия Кр полиэтерификации стремится к единице и не зависит от температуры, что объясняется близостью величин энергии активации прямой и обратной реакций (энергия активации адипино — вой кислоты с этиленгликолем равна 59,7 кДж/моль, а обратной реакции гидролиза — 58,5 кДж/моль). Поэтому изменением температуры нельзя добиться увеличения относительной доли прямой реакции. Введение катализаторов может оказать некоторое влияние на величину /Ср. Основные катализаторы не влияют на скорость прямой реакции, но приводят к увеличению скорости гидролиза. При применении кислых катализаторов возрастает скорость обеих реакций, и, хотя скорость прямой реакции возрастает сильнее, доля обратной реакции остается
|
|
|
|
Рис. 2.2. Изменение кислотного числа К — Ч. во времени т при поликонденсации фталевого ангидрида с этиленгликолем (в эквимольном соотношении) при 200 °С
Рис. 2.3. Зависимость молекулярной массы (удельной вязкости Г1УД) полиэти — лентерефталата от толщины слоя б при поликонденсации в расплаве в тонком слое:
/ — в вакууме; 2 — при атмосферном давлении
Достаточно высокой. Поэтому смещение равновесия реакции в сторону образования олигомера может быть достигнуто только при удалении побочного продукта (воды) из реакционной массы. При изменении температуры или применении специфического катализатора этого достичь нельзя.
Рассмотрим технологические параметры ведения процесса полиэтерификации. Относительно низкая активность исходных реагентов и их плохая растворимость в обычно применяемых органических растворителях обусловливает необходимость ведения процесса в расплаве. Из-за высоких температур плавления образующихся олигомеров, а в ряде случаев и мономеров, температуры ведения процессов достигают 200—300 °С, причем верхний температурный предел лимитируется протеканием побочных процессов (деструкция полимерной цепи, декарбоксили — рование). Такие высокие температуры делают принципиально возможным удаление воды из зоны реакции отгонкой по мере ее образования. Процесс удаления воды интенсифицируют применением вакуума или продувкой реакционной массы инертным газом. Особое значение при удалении воды имеет перемешивание. Удалению воды из сферы реакции также способствует проведение процесса в тонком слое. Влияние толщины реакционного слоя при поликонденсации в расплаве сильнее всего сказывается на глубоких стадиях проведения процесса, когда отвод воды затруднен вследствие большой вязкости системы.
Часто при синтезе олигоэфиров воду удаляют в виде азео- тропной смеси с растворителем (ксилол), который добавляют в расплав реакционной массы в небольшом количестве (3—5% от общей массы). Этот способ ведения процесса называют азеотропным.
При получении олигоэфиров реакцией полипереэтерификации соблюдаются те же закономерности, что и при полиэтерификации. Величина /СР несколько выше (для реакции диметилтерефта — лата с этиленгликолем при 250 °С она составляет 4,9), а выделяющийся побочный продукт (метанол) удаляется легче, чем вода. Однако и в этом случае проведение процесса в тонком слое или под вакуумом способствует более глубокому протеканию процесса (рис. 2.3). Из рисунка видно, что молекулярная масса олигомера возрастает при уменьшении толщины реакционного слоя и при применении вакуума за счет изменения условий удаления метанола из зоны реакции.
Процесс синтеза олигоэфиров в силу своего равновесного характера обычно осложняется вторичными реакциями, протекающими с участием образующихся макромолекул. К реакциям этого типа относятся реакции алкоголиза (2.18), ацидолиза (2.19), гидролиза (2.20) и эфиролиза (2.21):
~ООС—И—ахж"~+но—Г—ОН ^
^ ~ ООС—И—СООИ’ОН+НОИ"~ (2.18)
~ ООС—R—COOR" ~ +НООС—R’—СООН^
=ё* ~ ООС—R—СООН+НООС—R’—COOR" ~ (2.19)
~ ООС—R—COOR" ~ + Н20 ^ ~ ООС—R—СООМ + HOR"~ (2.20)
~ R’OOC—R—COOR’ ~ + ~ R"COO—R’"—COOR" =г±
-R’OOC—R—COOR"~ + ~R’COO—R’"—COOR"~ (2.21)
Реакцию (2.21) обычно называют реакцией межцепного обмена. При синтезе олигоэфиров роль реакций ацидолиза и ал — коголиза с ростом степени превращения будет уменьшаться вследствие расходования функциональных групп, тогда как роль реакции эфиролиза будет возрастать вследствие накопления олигоэфирных продуктов. Протекание этих реакций обусловливает кинетические особенности процесса синтеза и оказывает влияние на молекулярно-массовую характеристику образующегося олигоэфира.
Количественно учесть влияние этих реакций на процесс поликонденсации в настоящее время не представляется возможным из-за отсутствия данных по величинам Кр отдельных реакций.
Кроме того, синтез олигоэфиров осложняется такими побочными реакциями, как декарбоксилирование, которое протекает при высоких температурах:
О
~R—С^ ————— v ~RH+C02 (2.22)
ОН
И внутримолекулярная циклизация:
СО
НО—(СН2)„СООН ч==±: (Н2С)„^| + С02, (2.23)
Где п=3—4.
Последнюю реакцию следует принимать во внимание, если в реакционной системе возможно образование малонапряженных пяти — и шестичленных циклов.
Подавляющее большинство выпускаемых промышленностью пленкообразующих сложных полиэфиров получают из смеси мономеров сложного состава, в которую одновременно входят несколько различных кислот и спиртов, поэтому синтез этих полимеров в реальных условиях следует рассматривать как со — поликонденсацию, что еще более осложняет кинетическую картину этого процесса. Из-за большого различия в реакционной способности исходных сомономеров для регулирования состава и структуры соконденсата часто приходится прибегать к многоступенчатой загрузке компонентов и вести процесс в несколько стадий (как правило, в две).
 3 сентября, 2013
3 сентября, 2013  admin
admin 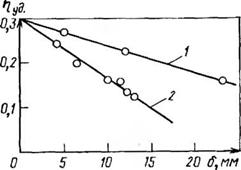
 Опубликовано в рубрике
Опубликовано в рубрике 