В основе процесса получения феноло-, карбамидо- и мелами — ноформальдегидных олигомеров лежат реакции фенолов, карбамида и меламина с формальдегидом с образованием соответствующих гидроксиметильных (метилольных производных):
~ВН+СН20 ~В—СН2ОН, (3.1)
Где В — атом азота или углерода ароматического ядра.
Метилольные производные могут в определенных условиях взаимодействовать между собой или с исходными мономерами:
~В—СН2ОН+~ВН ~В—СНг—В~ + Н20 (3.2)
2~В—СН2ОН ~В—СН2—О—СН2—В~ + Н20 (3.3)
С образованием димеров, линейных, разветвленных и сетчатых полимеров.
Структура образующихся продуктов определяется соотношением исходных веществ и условиями проведения процесса (pH, температура).
Гидроксиметидированием можно рассматривать как реакцию нуклеофильного присоединения к карбонильной группе. Подвижные я-электроны С=0 связи формальдегида сильно оттянуты К кислороду (ДИПОЛЬНЫЙ момент (Хс=0 = 2,5), поэтому
Углерод карбонильной группы характеризуется дефицитом
электронов и является электрофильным центром:
е+ 0- ус=о
Нуклеофильными партнерами в реакции являются фенол, карбамид и меламин. Фенол, относящийся к классу аромап: ческих соединений, имеет циклическую систему делокализован — ных я-электронов выше и ниже плоскости кольца. Несмотря на делокализацию, л-электроны удерживаются не так жестко, как
О-электроны, поэтому они особенно доступны для атаки реагентами с дефицитом электронов. Вследствие этого ароматическое ядро фенола служит источником электронов, т. е. основанием. С этих позиций реакцию фенола с формальдегидом можно трактовать также как реакцию электрофильного замещения в ароматическом ряду.
Карбамид Н2И—С—ЫН2 — слабое основание (рКо=
О
= 0,18), образующее соли с сильными кислотами. Большую основность карбамида в сравнении с амидами карбоновых кислот объясняют резонансной стабилизацией катиона, образующегося при протонировании:
|
ЬШ—С—№12 + Н+ II О |
ОН+ он
* Н21М—С=йн2"| (3.4)
=кн21 I ]
Меламин — амид циануровой кислоты (1,3,5-триамино — 2,4,6-триазин):
I
N N
II I
Н. Т>{—С С—№1-,
N
Представляет собой довольно сильное монофункциональное основание, что видно из данных величин рКа соответствующих сопряженных кислот:
РК’о= 5,0; рК’п =0,2; рК0"’= -2,95.
Из изложенного очевидно, что нуклеофильные партнеры (фенол, карбамид и меламин) существенно отличаются друг от друга как по своей природе, так и по величине относитель
ной основности, что накладывает свои специфические особенности на протекание реакции с формальдегидом. Поэтому специфика каждого вида взаимодействия: фенол — формальдегид, карбамид — формальдегид и меламин — формальдегид будет рассмотрена в соответствующих разделах. Здесь лишь укажем на ряд общих закономерностей, наблюдающихся в реакциях нуклеофильного присоединения к альдегидам.
Нуклеофильное присоединение к карбонильной группе соединений, способных отщеплять один протон, происходит с образованием тетраэдрического продукта присоединения согласно уравнению:
|
(3.5) |
|
|||
|
|
||
|
|||
|
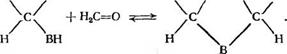
ОН
|
/ |
|
С=В + НгО. |
|
|
|
|
![]()
В ряде случаев (например, при синтезе карбамидоформальдегидных олигомеров) эта реакция может осложнить процесс, поэтому необходимо знать условия ее протекания.
Скорость реакции присоединения по карбонильной группе определяется такими факторами, как нуклеофильность атакующего агента и величина положительного заряда на карбонильном атоме углерода. В случае слабых нуклеофильных агентов возможен как кислотный катализ, за счет которого происходит увеличение поляризации карбонильной группы:
|
|
|
(3.9) |
Так и основной катализ, который приводит к повышению нукле-
Офильности атакующего агента:
|
(3.10) |
Сильные нуклеофильные агенты легко взаимодействуют с формальдегидом без катализатора. Границы эффективности кислотного катализа определяются константой диссоциации сопряженной кислоты ВН2+.
Продукты присоединения нуклеофильного агента к формальдегиду— спирты структуры ~ВСН2ОН обладают высокой активностью в условиях кислотного катализа по отношению к нуклеофильным реагентам, имеющим подвижный атом водорода. Так, например, образование простых эфиров дегидратацией алифатических спиртов происходит только при нагревании смеси спирта и концентрированной серной кислоты при 140 °С, в то время как конденсация метилольных производных фенола или карбамида с образованием простых эфирных связей проходит в очень мягких условиях — в водной среде при 20 °С (pH «2—4):
~В—СН2ОН + НОСН2—В~
=Р± ~В—СН2—О—СН2—В~+Н20. (3.11)
Высокую реакционную способность спиртов ВСНгОН, имеющих в а-положении к реакционному центру такие заместители,
О
Как ароматическое ядро или группы —С—N— или С—ЫН2,
I
Можно объяснить сильным электроноакцепторным мезомерным эффектом (—М) этих заместителей, которые стабилизируют промежуточный катион:
|
? I П I + ? (3’12) ~С—К— СН2ОН + Н+ :*г± ~С—Ы—СН2—ОН2:<=± ^С-№^СН2 +н2о
|
Образовавшиеся сравнительно долгоживущие и устойчивые катионы карбония (I) и (II) представляют собой сравнительно сильные кислоты Льюиса и являются по отношению к нуклеофилам ВН и ВСН2ОН электрофильными реагентами высокой активности. Поэтому конденсация метилольных производных с образованием соответствующих олигомеров в кислой среде протекает с очень большой скоростью при довольно низких температурах.
 5 сентября, 2013
5 сентября, 2013  admin
admin 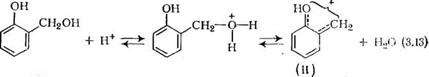
 Опубликовано в рубрике
Опубликовано в рубрике 