Особую группу эпоксидных пленкообразующих представляют продукты модификации эпоксидиановых олигомеров монокар — боновыми кислотами. Такие олигомеры практически не содержат в своей структуре эпоксидных групп, поэтому их отнесение к эпоксидным пленкообразующим весьма условно. К этому типу пленкообразующих относят обычно эпоксиэфиры и эпоксиакрилаты.
Эпоксиэфиры
Эпоксиэфирами называют продукты модификации эпоксидных олигомеров жирными кислотами. Наиболее часто эпоксиэфиры получают на основе эпоксидных диановых олигомеров с молекулярной массой 800—1600. Для этерификации используют преимущественно кислоты высыхающих и полувысыхающих масел (льняного, дегидратированного касторового, соевого), а также кислоты канифоли и таллового масла. Такая модификация позволяет получать внутренне пластифицированные термореактивные олигомеры, в которых роль пластификатора играют жирнокислотные остатки.
В основе процесса получения эпоксиэфиров лежат реакции карбоновых кислот с эпоксидными и гидроксильными группами диановых олигомеров:
— СН—СН2+ЯСООН > — СН—СН4ОССЖ, (5.38)
О он
—СН2—СН—СН4 ЬИСООН ^=3= —СН2—СН—СН2— + Н20. (5.39)
I I
Механизм этих реакций был рассмотрен ранее.
Эпоксидные группы этерифицируются кислотами в более мягких условиях по сравнению с гидроксильными, причем для этой реакции чрезвычайно эффективен основный катализ (третичные амины, соли щелочных металлов). В силу этого полная этери — фикация диановых эпоксидных олигомеров является двухстадийным процессом. Первая стадия — этерификация эпоксидных групп — протекает уже при 130—160 °С (даже в отсутствие основных катализаторов). Вторую стадию — этерификацию гидроксильных групп — следует проводить при температуре не ниже 220 °С, причем из-за равновесности этой реакции в ходе процесса необходимо удалять образующуюся воду.
В зависимости от количества жирной кислоты-модификатора, принимающей участие в образовании эпоксиэфиров, различают так называемые «полные» и «неполные» зпоксиэфиры. Под полными понимают такие продукты, в которых этерифика — ции подверглись почти все функциональные группы эпоксидного олигомера (эпоксидные и гидроксильные). Практически, однако, получить степень этерификации выше 0,9 невозможно. Неполными эпоксиэфирами называют продукты, содержащие значительное число свободных гидроксильных и, возможно, эпоксигрупп.
По аналогии с алкидными олигомерами эпоксиэфиры принято разделять в зависимости от степени этерификации на жирные (70—90%), средние (50%) и тощие (30—45%).
Эпоксиэфиры получают в расплаве или азеотропным методом, причем последний предпочтителен. Процесс можно вести двухстадийно. На первой стадии проводят этерификацию эпоксидных групп в более мягких условиях (особенно в присутствии солей щелочных металлов или третичных аминов), а на второй стадии — этерификацию вторичных гидроксильных групп вдоль цепи молекулы эпоксидного олигомера с азеотропной отгонкой образующейся воды. Иногда обе стадии проводят одновременно при 220—230 °С, причем в этом случае основный катализатор не применяют.
Схема технологического процесса получения эпоксиэфира на основе эпоксидного дианового олигомера с молекулярной массой 1600 и жирных кислот льняного или дегидратированного касторового масла приведена на рис. 5.6. Схемой предусмотрено растворение готового продукта в ксилоле и выпуск товарного продукта в виде 50%-ного раствора.
Для получения эпоксиэфира исходные реагенты брали в следующих соотношениях:
Эпоксидный олигомер с молекулярной массой 1600 1/56,5[9]
Жирные кислоты льняного или дегидратированного 3,85/37,7 касторового масла
Ксилол —/5,7
|
Рис. 5.6. Технологическая схема производства эпоксиэфиров: 9 — конденсаторы; 2 — автоматические порционные весы; 3 — жидкостной счетчик; 4 — разделительный сосуд; 5 — теплообменник; 6 — реактор с электроиндукционным обогревом; 7 — весовой мерник; 8 — смеситель; 10, 12 — шестеренчатые насосы; И — тарельчатый фильтр |
Свойства эпоксиэфиров определяются степенью их этерифи — кации, типом использованных для этого жирных кислот, а также молекулярной массой эпоксидного олигомера. С увеличением содержания жирных кислот повышается растворимость эпоксиэфиров в ароматических, а иногда и алифатических углеводородах, а также улучшается их смачивающая способность по отношению к пигментам. Вязкость растворов эпоксиэфиров возрастает с увеличением молекулярной массы эпоксидного олигомера и с уменьшением степени этерификадии.
Отверждение жирных и средних эпоксиэфиров, так же как и алкидов, модифицированных высыхающими и полувысыхающи — ми маслами, протекает по механизму окислительной полимеризации под действием кислорода воздуха в присутствии сиккативов (см. гл. 8). Продолжительность процесса отверждения при этом составляет 24 ч при 18—22 °С и 2 ч — при 70 °С. Полученные покрытия отличаются высокими физико-мехаиическими показателями. Атмосферостойкость таких покрытий сопоставима с атмосферостойкостью алкидных покрытий. Покрытия отличаются повышенной щелочестойкостью по сравнению с алкидными, так как в основной цепи полимера не содержится не стойких к гидролизу сложноэфирных связей.
Тощие эпоксиэфиры совмещаются с феноло-, карбамидо — и меламиноформальдегидными олигомерами, образуя материалы горячего отверждения. При повышенной температуре (^150°С) или в присутствии катализаторов происходит взаимодействие свободных гидроксильных групп эпоксиэфира с метилольными (или алкоксиметилольными) группами второго компонента. Полученные покрытия отличаются повышенными твердостью, во — до — и хемостойкостью. Они используются для защиты труб и различных видов тары.
К эпоксиэфирам также относят эпоксидноалкидные олигомеры, которые получают различными способами. Наиболее распространенным способом является этерификация эпоксидного олигомера (преимущественно по эпоксидной группе) алкидом с концевыми карбоксильными группами. Для этой цели обычно используют низкомолекулярные эпоксидные олигомеры и алкид с кислотным числом 45—60 мг КОН/г.
Эпоксидный олигомер может быть использован также при синтезе алкидов в качестве одного из гидроксилсодержащих компонентов. Так, по одному из методов на первой стадии проводят алкоголиз масла эпоксидным олигомером при 250 °С в присутствии катализатора СаО. Процесс идет как по эпоксидным, так и по гидроксильным группам эпоксидного олигомера: СН2—OCOR СН2—О—СН2—СН—СН2~ (5.40)
1:н—OCOR + Н2С—— СН—СНа————- СН—OCOR OCOR
CHg—OCOR »о’ CH2—OCOR
Масло эпоксидный
Олигомер
СН2—OCOR СН2—ОН
С Н—OCOR + ~СН2—СН—СН2~ ч==*= CH—OCOR+~CH2—СН—СН2~
СН2—OCOR ОН СН2—OCOR OCOR
Масло фрагмент (5.41)
Эпоксидного олигомера
На второй стадии продукты алкоголиза обрабатывают фта — левым ангидридом и проводят процесс поликонденсации. В результате таких превращений получают алкид, спиртовый компонент которого состоит из смеси глицерина и эпоксидного олигомера.
При использовании свободных жирных кислот растительных масел процесс ведут следующим образом. На первой стадии эпоксидный олигомер этерифицируют жирными кислотами [см. реакции (5.38) и (5.39)]. На второй стадии в реакционную смесь вводят фталевый ангидрид и полиол (глицерин, пентаэритрит) и проводят совместную поликонденсацию.
Свойства таких эпоксиалкидных олигомеров аналогичны свойствам обычных эпоксиэфиров, рассмотренных ранее.
Одна из важных областей применения эпоксиэфиров — использование их для получения водоразбавляемых материалов. Для придания эпоксиэфирам способности растворяться в воде в них вводят свободные карбоксильные группы по реакции с ма — леиновым (малеинизация) или фталевым ангидридами.
Для малеинизации используют полные эпоксиэфиры с минимальным содержанием гидроксильных групп во избежание гелеобразования. Реакция присоединения малеинового ангидрида протекает по двойным связям жирнокислотных остатков (по а-метиленовым группам или по реакции Дильса — Аль — дера).
Схему процесса получения водоразбавляемого эпоксиэфира такого типа можно представить следующим образом:
|
| (п+4)1?’СООН ОСОЙ’ ОСОЙ’ СН2СНСН20—Г—К0СН2СНСН20—1—ИОСНгСНСНг, ОСОЙ’ [ ОСОЙ’ ОСОЙ’ |
|
Осой |
|
Осой |
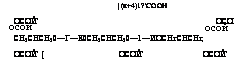 |
|
|
|
|
|
|
![]()
О-С—(СН^)т—СН=СН-СН2-СН=СН-(СН2)„-СН3
II
О
|
|
(5.43)
|
~о—СН2—СН—сн2—о— О—С—(СН2)т—СН=СН—СН— СН=СН— (СН2)„—СНз |
|
“На |
|
II |
|
НС |
|
О |
|
|
|
|
![]()
Стадию малеинизации [реакция (5.43)] проводят в течение 4 ч при 175°С или в течение 1 ч при 200 °С. Малеиновый ангидрид вводят в количестве 10% от массы жирных кислот. Полученный продукт растворяют в монобутиловом эфире этилен — гликоля, нейтрализуют 25%-ным раствором аммиака и разбавляют водой.
Для получения водоразбавляемых эпоксиэфиров по реакции с фталевым ангидридом используют неполные (тощие) эпоксиэфиры. Взаимодействие гидроксильных групп неполного эпоксиэфира с фталевым ангидридом протекает при 165 °С с образованием кислых эфиров фталевой кислоты:
СН3 СО
Сн3 ОН СО
СНз
— ~/^4 — О—сна—СН-СН2~ (5.44)
|
СН. |
![]() О—с=о
О—с=о
СООН
|
|
Полученный продукт растворяют в монобутиловом эфире этиленгликоля, нейтрализуют триэтиламином и разбавляют водой.
Эпоксиакрилаты
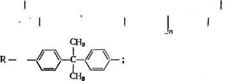
Эпоксиакрилатами принято называть (мет)акрилированные производные эпоксидных олигомеров, чаще всего диановых. Их получают этерификацией эпоксидного олигомера ненасыщенными монокарбоновыми кислотами (акриловой или метакрило — вой) по схеме
И ОН И ОН
| / катализатор | |
Н2С=С—С’ +Н2С—————— СН————— н2с=с—С—О—СН2СН~
(5.45)
Реакцию проводят при 90—100 °С в присутствии катализаторов (третичные амины, соли карбоновых кислот) и ингибиторов для предотвращения радикальной полимеризации (гидрохинон) .
Эпоксиакрилаты являются перспективными пленкообразующими для лакокрасочных материалов УФ — и радиационного от
верждения. Для получения лакокрасочных материалов, не содержащих органических растворителей, эпоксиакрилаты используют в сочетании с ненасыщенными мономерами-разбавителями, принимающими участие в процессе трехмерной радикальной сополимеризации с олигомером при отверждении. В качестве таких реакционноспособных разбавителей используют стирол, эфиры акриловой и метакриловой кислот и др. УФ-от — верждение проводят в присутствии обычных фотоинициаторов и сенсибилизаторов — ароматических кетонов (бензофенон, аце- тофенон), смеси кетонов с аминами и т. п.
Покрытия на основе эпоксиакрилатов отличаются высокой химической стойкостью, твердостью, блеском. Физико-механические показатели покрытий в значительной степени определяются природой активного разбавителя. Лакокрасочные материалы на основе эпоксиакрилатов радиационного и УФ-отверждения находят применение для окраски рулонного металла, консервной тары, в полиграфической промышленности для офсетной печати. В последнее время отверждаемые радиацией лакокрасочные материалы все шире используются для изготовления и защиты плат печатного монтажа с радиодеталями, получения маркировочных и других красок. ПРОЦЕССЫ ОТВЕРЖДЕНИЯ эпоксидных ПЛЕНКООБРАЗУЮЩИХ
Эпоксидные пленкообразующие представляют собой реакционноспособные олигомеры, которые переходят в неплавкое и нерастворимое состояние только под действием отвердителей.
Несмотря на структурное разнообразие эпоксидных пленкообразующих, наличие в их молекулах эпоксидных групп обусловливает сходный характер процессов превращения их в полимеры трехмерного строения — отверждения. В ряде случаев в процессе отверждения принимают участие и другие функциональные группы, например гидроксильные.
Высокая активность эпоксидных групп по отношению к нуклеофильным и электрофильным реагентам позволила разработать различные отверждающие системы для эпоксидных олигомеров, эффективные в широком диапазоне температур — от О до 200 °С. По механизму действия все отвердители эпоксидных олигомеров принято классифицировать на две группы:
1) сшивающие отвердители — соединения с функциональными группами, способными к взаимодействию с эпоксидными и (или) гидроксильными группами эпоксидного олигомера;
2) каталитически действующие отвердители, под действием которых образование трехмерной структуры происходит за счет реакции полимеризации с раскрытием эпоксидного цикла.
Следует отметить, что такие высокомолекулярные продукты конденсации дигидроксидифенилпропана с эпихлоргидрином. как фенокси-смолы, из-за высокой молекулярной массы (»60 000) могут использоваться и в качестве термопластичных материалов.
 10 сентября, 2013
10 сентября, 2013  admin
admin 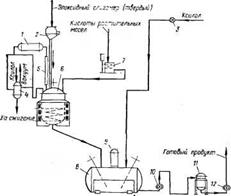
 Опубликовано в рубрике
Опубликовано в рубрике 