Диоксид титана TiO2 полиморфен, он кристаллизуется в 2-ух сингониях: брукит — в ромбической, рутил и анатаз — в тетрагональной, но последние различаются строением кристаллической решетки. В обоих случаях каждый атом титана находится в центре октаэдра и окружен 6 атомами кислорода. Пространственное же расположение октаэдров различное: в анатазе на каждый октаэдр приходится 4 общих ребра, в рутиле только 2. Простая ячейка анатаза состоит из 4 молекул, а рутила только из 2-ух:
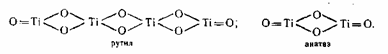
Благодаря более плотной упаковке ионов в кристаллах рутил превосходит анатаз по стабильности, плотности, твердости, показателю преломления, диэлектрической неизменной и обладает пониженной фотохимической активностью. При температуре 915 0C ? 950 0C анатаз перебегает в рутил, но приобретенный при всем этом рутил отличается высочайшей абразивностью и низкой дисперсностью. В 1949 г. была найдена возможность управления кристаллизацией введением рутилизирующих добавок и эмбрионов. Ионы Zn2+, Mg2+, Al3+, Sn2 + являются стабилизаторами рутильной формы, ионы SO42-, PO43 — — анатазной. В присутствии даже малых количеств соединений фосфора переход анатаза в рутил становится неосуществимым. Рутилизирующие зародыши получают, обрабатывая гидратированный диоксид титана после пятой стадии промывки веществом едкого натра. При всем этом появляется тетратитанат натрия Na2Ti4O3, который обрабатывают соляной кислотой, и пептизируют продукт гидролиза, за ранее освобожденный от ионов SO42-. Такие эмбрионы вводятся перед прокаливанием.
Рутил, прокаленный при температуре около 10000C и содержащий примеси Fe, Cr, Ni, Mn, проявляет свойство фототропии. При освещении он становится карим, в мгле вновь светлеет. Это разъясняется окислением примесных металлов в высшие оксиды вследствие выделения кислорода при освещении ТiO2 с деформированной решеткой.
В чистом виде диоксид титана, в особенности в анатазной форме, обладает высочайшей фотохимической активностью, что вызывает разрушение лакокрасочной пленки («меление») и выцветание органических пигментов. Модифицирование поверхности частиц диоксида титана гидроксидами Al, Si, Zn резко уменьшает фотохимическую активность.
Диоксид титана химически инертен, нерастворим в слабеньких кислотах и щелочах и органических растворителях. Не ядовит, ПДК в воздухе рабочих зон 10 мг/м3. Может применяться со всеми видами пленкообразователей и растворителей. Подходящ для водоэмульсионных, воднодисперсионных и порошковых красок. Пигментный диоксид титана также обширно употребляется для окрашивания изделий из резины, пластмасс, линолеума, бумаги и хим волокон. Не считая пигментного диоксида титана, содержащего 82—95 % (масс.) TiO2, вырабатывается диоксид титана для жестких сплавов, стекол, керамики с более высочайшим содержанием TiO2.
Сырье, для получения диоксида титана. Для переработки в пигментный диоксид титана употребляются минералы: природный рутил, содержащий 92—95 % (масс.) TiO2 и примесь Fe2O3, придающую ему красноватый цвет (рутил красноватый); ильменит FеО*ТiO2 либо — арканзитFe2O3*3ТiO2; титаномагнетиты,
состоящие из зернышек ильменита и магнетита и содержащие 8—12 % (масс.) TiO2.
В чистом виде титансодержащие минералы встречаются изредка. Для освобождения от примесей других минералов и пустой породы измельченные руды подвергают магнитному и другим видам обогащения и получают концентраты примерного состава, % (масс.):

Разработка производства пигментного диоксида титана. Переработка титановых концентратов и шлаков в пигментный диоксид титана имеет целью не только лишь освобождение от примесей, да и придание TiO2 требуемой кристаллической формы, дисперсности, адсорбционных параметров и подавление фотохимической активности. Для получения диоксида титана применяют два метода: сернокислотный — для концентратов, содержащих более 40 % TiO2, и хлоридный,— экономически прибыльный только для переработки концентратов, содержащих более 80 % TiO2 (потому что получаемые отходы FeCl3 не находят внедрения).
Сернокислотный метод. Это узкий и непростой процесс, состоящий из 3-х главных стадий и ряда вспомогательных операций (см. схему 2.1).
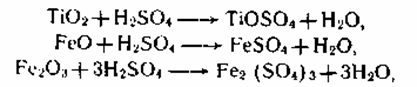
1. Первой стадией является разложение тонкоизмельченного
титан-содержащего
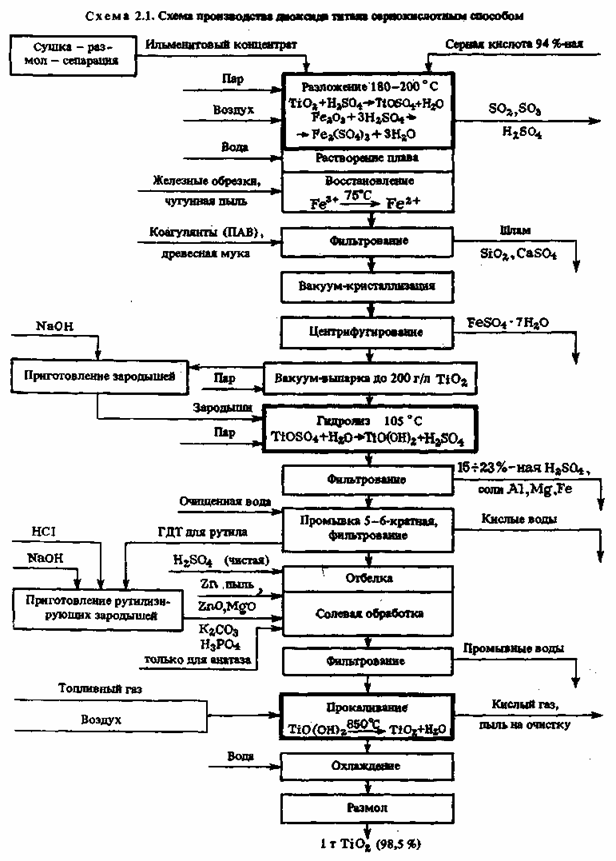
концентрата 85—92 %-ной серной кислотой при 180—220 0C и непрерывном смешивании обскурантистской массы сжатым воздухом с получением прозрачного раствора титанилсульфата TiOSO4. При всем этом протекают последующие экзотермические реакции разложения:
также подобные реакции с оксидами Mn, Ca, Al и другими примесями. Все реакции протекают бурно после подготовительного нагрева с выделением огромного количества паров воды, H2SO4, SO3 и SO2, которые улавливаются в скруббере, орошаемом водой. Реакцию разложения проводят периодическим способом.
Бессчетные пробы внедрения реакторов непрерывного деяния с механическим смешиванием не оправдали себя как на техническом уровне, так и экономически, потому что наблюдался большой коррозионный и эрозионный износ аппаратуры.
Кислые смеси сульфатов титана, железа и других частей, присутствующих в сырье, имеют непростой коллоидно-химический состав, изменяющийся зависимо от содержания кислоты, температуры, времени выдержки.
При проведении реакции разложения реактор безпрерывно продувают сжатым воздухом, который перемешивает суспензию, а потом при кристаллизации солей и застывании плава делает его пористым. После окончания реакции разложения и остывания плава выход по титану составляет 96—98 %. В реактор подают воду (из расчета получения раствора с содержанием TiО2 приблизительно 120 г/л) и все водорастворимые соли перебегают в раствор.
Для следующего удаления сульфата железа(II) из раствора титанилсульфата проводят восстановление ионов Fe3+ до Fe+, зачем в реактор добавляют чугунную стружку. В кислой среде проходит реакция восстановления Fe3+ ——>- Fe2+ выделяющимся водородом. Сразу восстанавливается и маленькое количество (3—5 г/л) Ti4+ до Ti3+. Соединения Ti3+ являются сильными восстановителями, они исключают возможность повторного окисления воздухом Fe2+ и этим предупреждают адсорбцию ионов Fe3+ на диоксиде титана, придающих ему желтоватую расцветку.
Кислые смеси титанилсульфата, сульфатов железа, алюминия, марганца отстаивают либо отфильтровывают от шлама, состоящего из остатков неразложившейся руды, диоксида кремния, нерастворимого сульфата кальция, а потом осветляют, отделяя коллоидные частички коагуляцией при помощи флокулянтов — высокомолекулярных ПАВ. После вакуум-кристаллизации металлический купорос FeSO4*7H2O отделяют от раствора центрифугированием либо фильтрованием. Металлический купорос является побочным продуктом производства.
2. Важной стадией, определяющей пигментные характеристики диоксида титана, является тепловой гидролиз титанилсульфата, протекающий по реакции:
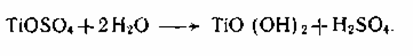
Это уравнение не открывает сложного хода реакции гидролиза и полного состава получаемых веществ. Титанил-ионы в аква растворе образуют гидроксокомплексы I, II, в каких атомы титана связаны через оловые мостики. При тепловом гидролизе происходит переход оловых мостиков в оксо-связи:
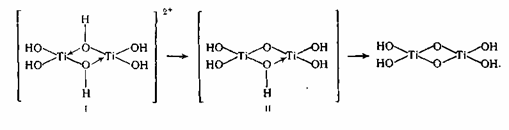
Таковой продукт гидролиза по брутто-составу приблизительно соответствует TiO(OH)2 и его именуют метатитановой кислотой
(MTK). Практически часть главных групп в полиионе замещены на сульфогруппы, которые отчасти сохраняются в виде концевых групп и в продукте гидролиза, имеющем полимерное строение и именуемом гидратированным диоксидом титана (ГДТ): TiO2*0,71H2O*0,07SO3.
Для ускорения гидролиза и увеличения выхода, а главное, для получения частиц ГДТ определенного размера в предгидролизный раствор вводят специально приготовленные эмбрионы. Для получения эмбрионов отбирают 0,3—0,5 % (масс.), в расчете на TiO2, предгидролизного кислого раствора в отдельный реактор, где при непрерывном смешивании его нейтрализуют веществом NaOH до рН = 3. При всем этом выпадает коллоидный осадок гидрозоля гидроксида титана, после 1—2-часовой выдержки при 60—80 0C переходящий в микрокристаллические эмбрионы переменного состава. Условия изготовления эмбрионов определяющее оказывают влияние на процесс гидролиза и качество пигмента.
Потому что в смесях с концентрацией TiO2 < 200 г/л рано наступает коагуляция товаров гидролиза, что препятствует кристаллохимическому росту частиц, предгидролизные смеси за ранее концентрируют до содержания в их TiO2 200—240 г/л. Это производят в вакуум-выпарных аппаратах при 60 0C. Гидролиз проводят в реакторах, снабженных мешалкой и змеевиками для подогрева и остывания. Приготовленный предгидролизный раствор нагревают, вводят эмбрионы, доводят до кипения (105—1100C), смешивают с водой и продолжают кипятить до 96—97 %-ного перевоплощения титанилсульфата в ГДТ, который отделяют от раствора фильтрованием и промывают водой. Сульфаты [FeSO4, MnSO4, А12(SО4)3] в кислой среде не гидролизуются и остаются в растворе серной кислоты.
Осажденный ГДТ подвергают 3—6-кратной промывке, на последних стадиях деминерализованной водой. Но стопроцентно отмыть крепко адсорбированные ионы Fe3+ не удается. Для удаления оставшихся ионов Fe3+ проводят «отбелку»: ионы Fe3+ восстанавливают водородом до Fe2+, зачем вводят порошок железного цинка и химически чистую серную кислоту. После отбелки проводят солевую обработку, добавляя для получения рутильной формы TiO2 до 3 % (масс.) ZnO и специально приготовленные рутилизирующие эмбрионы. Для получения анатазной формы TiO2 вводят минерализатор К2СО3, облегчающий удаление воды при прокаливании, и 0,5 % фосфорной кислоты, стабилизирующей анатазную форму.
3. Следующей стадией является
прокаливание ГДТ с получением диоксида титана:
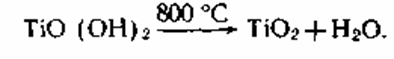
При прокаливании совместно с водой удаляется и SO3 [состав ГДТ TiO2*0,71H2O*0,07SO3].
Прокаливание проводят в трубчатых крутящихся печах при температуре 850—900 0C, время пребывания продукта в печах — около 8 ч. Выходящие из печей дымовые газы подвергаются влажной чистке от SO3, Н2SO4 и уносимой газами пыли ТiO2 в скрубберах, орошаемых аммиачной водой. Приобретенный диоксид титана охлаждают и размалывают.
4. Заключительными операциями получения пигментного диоксида титана являются влажный размол, систематизация частиц по размерам и поверхностная обработка (см. схему). За ранее размельченный в сухом виде диоксид титана репульпируют в чистой воде (300— 350 г/л TiO2), добавляют силикат натрия и щелочь и подвергают
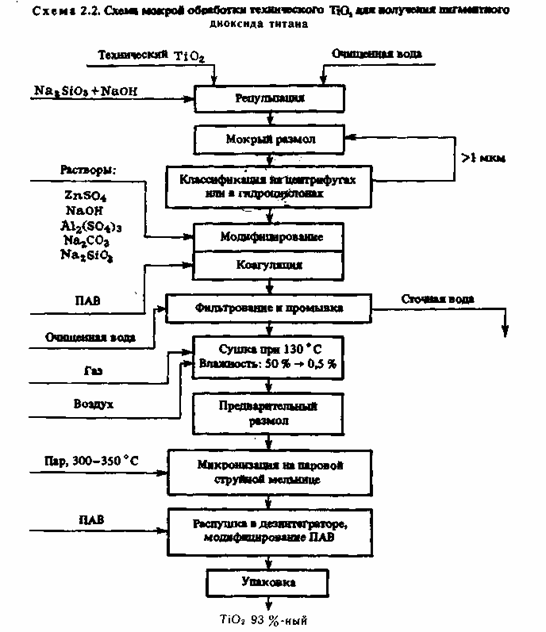
непрерывному влажному размолу в шаровой либо в бисерной мельнице. Вытекающая из мельницы пульпа направляется для систематизации частиц в гидроциклоны либо центрифуги. Отделенные частички размерами более 1 мкм возвращают на повторный размол.
Пульпу с частичками наименее 1 мкм подвергают солевой обработке смесями Al(SO4)3, NaOH, Na2SiO3, ZnSO4и коагулируют. Осадок TiO2 отфильтровывают и отмывают от ионов Na + и SO42-. Зависимо от предстоящего предназначения диоксид титана обрабатывают модификаторами — ПАВ либо кремнийорганическими соединениями. Приобретенный пигментный диоксид титана сушат, подвергают микронизации и упаковывают. На предприятия, производящие воднодисперсионные лакокрасочные материалы, диоксид титана перевозят в цистернах в виде 65—70 %-ной аква пасты. Операция сушки в технологическом процессе получения TiO2 таким макаром исключается.
Недочетом сернокислотного метода является большой расход серной кислоты — 2,1 т на 1 т диоксида титана. Вся серная кислота преобразуется в отходы: кислые шламы, металлический купорос, разбавленную и грязную «гидролизную» кислоту и очень разбавленные кислые воды от промывки стального купороса, ГДТ и газовых выбросов.
Металлический купорос, получаемый в количестве 3,2—3,6 т на 1 т TiO2, употребляется в производстве желтоватых и бардовых железо-оксидных пигментов и как коагулянт при чистке водопроводной воды. Излишек купороса прокаливают с известью и получают «окатыши» — сырье для доменной выплавки чугуна. Выделяющиеся газы SO2 и SO3 опять превращают в серную кислоту.
Разбавленную 15—20 %-ную гидролизную кислоту концентрировать очень тяжело, потому что имеющиеся в ней соли Al, Mg, Fe и другие образуют гелеобразные шламы. Гидролизную кислоту употребляют для производства удобрения — суперфосфата.
Таким макаром, создание диоксида титана сернокислотным методом представляет собой непростой комплекс производств серной кислоты, суперфосфата, железооксидных пигментов и металлургического сырья, а время от времени и выплавки чугуна, и все таки огромное количество шлама и очень разбавленных кислых промывных вод остается неиспользованным.
Хлоридный метод. Получение пигмента по этому методу основано на хлорировании брикетов из высококонцентрированного титансодержащего сырья с восстановителем коксом в реакторе непрерывного деяния при 800 0C:
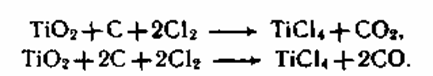
Сразу хлорируются и примеси Fe(II и III), Al, Si. Тетрахлорид титана TiCI4 представляет собой жидкость с температурой кипения 1350C и температурой замерзания — 230C. Трихлорид железа — жесткое вещество с температурой плавления 282 0C и температурой кипения 3150C. Дихлорид железа FeCl2 — также жесткое вещество, возгоняется при 672 0C. Большая разница в температурах кипения хлоридов титана и железа позволяет двухкратной ректификацией делить продукты хлорирования с получением TiCl4 высочайшей степени чистоты и отходов SiCl4, FeCl3. Потому для хлоридного метода приемлемо сырье только с очень высочайшим содержанием TiO2(более 85 %). На воздухе TiCl4 очень дымит, гидролизуясь в Ti(OH)4, потому вся аппаратура должна быть герметичной и стойкой к действию хлора.
Незапятнанный TiCl4 перерабатывается в TiO2 по одному из 2-ух последующих способов.
1. Окисление
TiCl4воздухом, (разбавленным азотом для понижения температуры):

Реакция проводится в специальной горелке. Хлор, разбавленный азотом, подвергается регенерации и ворачивается в процесс хлорирования. Прогрессивным методом является сжигание TiCl4 в плазмотроне, где кислород воздуха за ранее ионизируют нагреванием до 2000 0C при помощи пусковой вольтовой дуги и неизменного частотного электрообогрева. Приобретенные частички TiO2 подвергают резкому остыванию — «закалке» во избежание их роста, агрегации и спекания.
2. Гидролизперегретым до 4000C водяным паром по реакции:

Образующийся в этом процессе анатаз стремительно перебегает в рутил. Парофазный гидролиз не достаточно применяется, потому что нужно регенерировать хлор из HCl, что просит огромных издержек.
Приобретенный обоими методами высокодисперсный диоксид титана отделяется от обскурантистских газов в электрофильтрах. Для освобождения от адсорбированных Сl2 либо HCl проводится дехлорирование продувкой перегретым паром. Вся аппаратура хлоридного метода производства TiO2 изготовляется из незапятнанного. железного титана, потому продукт не загрязняется и отличается высочайшей белизной и неплохой разбеливающей способностью. В процессе окисления в зону реакции могут быть введены модификаторы — алюминий и кремний.
Хлоридный процесс производства TiCl4 характеризуется применением особо высокогерметичного оборудования и высочайшей культурой производства. Это нужно, чтоб не допускать загрязнения среды хлором и другими отходами (FeCl2 и FeCl3).
В мировой практике хлоридным методом вырабатывается наименее 30% TiO2 но этот метод перспективен, так как связан также с получением из TiCl4 незапятнанного железного титана.
 22 июня, 2014
22 июня, 2014  Malyar
Malyar  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: 