Скорость резвой коагуляции может быть определена по уравнению:
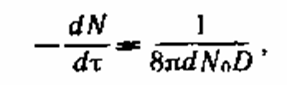
где N0 н N — число частиц в единице объема суспензии, первоначальное и через просвет времени t соответственно; d — поперечник частиц; D — коэффициент диффузии,
D = — kТ/(6pdh) (h —вязкость среды; k — неизменная Больцмана; Т — абсолютная температура).
Подставляя значение коэффициента диффузии в уравнение для времени, за которое число частиц уменьшится в два раза, получим:
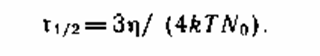
Для реального пигментированного лакокрасочного материала при комнатной температуре уменьшение числа частиц в два раза произойдет за время от 15 мин до 2,5 ч. Фактически коагуляция протекает еще медлительнее, потому что не каждое соударение приводит к слипанию частиц. Чтоб вышло слипание, частички должны преодолеть некий энергетический барьер DЕ. Скорость неспешной коагуляции w можно найти по выражению:
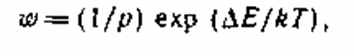
где р — стерический коэффициент, учитывающий форму, размер и размещение частиц.
В полидисперсных системах коагуляция протекает резвее, при всем этом маленькие частички исчезают существенно быстрее. Частички, имеющие форму листков, коагулируют с таковой же скоростью, как и сферические; а игловидные существенно резвее.
Пока нет универсальной количественной теории агрегативной стойкости, но определены причины стабилизации дисперсных систем в согласовании с теориями:
1) Дерягина — Ландау — Фервея — Овербека (теория ДЛФО) — равновесия сил притяжения и отталкивания частиц при наличии на их поверхности двойного электронного слоя;
2) П. А. Ребиндера — наличия структурно-механического барьера, создаваемого на частичках толстыми, крепкими и упругими адсорбционно-сольватными слоями;
3) теория энтропийного и энтальпийного отталкивания частиц при перекрытии рыхловатых адсорбционно-сольватных слоев с подвижными цепями и петлями полимеров.
Теория ДЛФО. Меж частичками сразу действуют ван-дер-ваальсовы силы притяжения и силы отталкивания, создаваемые при наложении двойных электронных слоев поверхности частиц. Потенциальную энергию дальнодействующих сил притяжения UАприближенно обрисовывает уравнение:


Неорганические пигменты, обычно, собственных электронных зарядов не имеют. Они их получают при адсорбции веществ, способных к диссоциации на ионы. Потенциальную энергию электронных сил отталкивания, действующих на расстоянии до 100 нм, обозначим UT. Полная возможная энергия взаимодействия меж частичками равна:
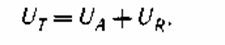
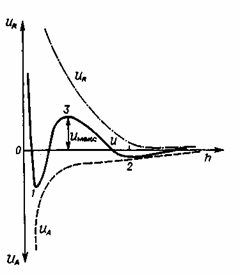
Энергия отталкивания URуменьшается с увеличением расстояния меж частичками более медлительно, чем энергия притяжения UА. Как видно из рис. 3.17, при самом малом расстоянии меж частичками силы отталкивания, именуемые силами Борна, резко растут. Частички могут объединиться при сближении, если их возможная энергия UАпревосходит значение Uмаксна суммарной кривой, т. е. для взаимодействия нужна энергия активации. Единственным источником для преодоления этого энергетического барьера является термическая энергия. Чем выше температура, тем больше частиц будут соединяться. Если Uмакс существенно больше термический энергии, дисперсия будет устойчивой.
Рзультирующая деяния сил притяжения и отталкивания (кривая Uна рис. 3.17) имеет два минимума — две потенциальные ямы. Umin1 при очень малом расстоянии меж частичками определяет коагуляционное соединение частиц. Umin2проявляется при несколько большем расстоянии меж центрами частиц. Если UМин2> kT, то частички также соединяются, но это соединение может быть не конкретным, а через прослойку среды, к примеру адсорбированной воды, т. е. происходит флокуляция. Для редиспергирования коагуляционных контактов требуется издержка огромного количества энергии: UМИН1 + UA- В данном случае образующиеся осадки могут быть фактически необратимыми вследствие появления молекулярного взаимодействия меж контактирующими поверхностями частиц. При флокуляции частички хлопьевидного объемистого осадка связаны слабенькими силами, и он просто редиспергируется при смешивании.
приближенно величина URравна:
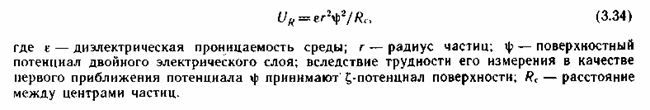
Согласно теории ДЛФО, для придания дисперсиям достаточной стойкости нужно, чтоб энергия отталкивания была более 15 kT.
Экспериментально подтверждено, что при r<0,5 мкм и e=40 этот фактор становится приметным и для аква систем (e = 81) может заносить приметный вклад либо даже быть определяющим фактором стабилизации при условии содержания в системе электролитов в количестве, не превосходящем порога коагуляции. Потому пигменты, предназначаемые для водоразбавляемых красок, не должны содержать растворимых веществ, в особенности ионов поливалентных металлов, выше определенного агрессивно регламентированного количества.
Для неорганических пигментов, не имеющих собственного электронного заряда в неполярных средах стабилизация за счет наложения двойных электронных слоев фактически не имеет места.
Теория структурно-механического барьера. Представление о структурно-механическом барьере как о более массивном и универсальном факторе, ослабляющем взаимодействие меж частичками, в особенности в высоконаполненных суспензиях в неполярных средах, смесях, не содержащих ионизируемых групп, и расплавах олигомеров и полимеров, ввел Ребиндер.
Адсорбционные слои на поверхности жестких частиц оказывают не только лишь стерическое препятствие к сближению частиц до расстояния действенного деяния сил притяжения меж частичками, но сразу понижают припас поверхностной энергии, образуя новейшую поверхность раздела фаз с малозначительной энергией взаимодействия 20—30 мДж, соответствующей для групп СН2 и СН3. При большой толщине адсорбционно-сольватный слой, взаимодействуя с активными центрами жесткой поверхности, стопроцентно компенсирует ее силовое поле. Структурно-механический барьер эффективен, когда адсорбционный слой обладает высочайшей структурной вязкостью, упругостью и крепко связан с жесткой поверхностью. Стабилизирующее действие растет по мере адсорбционного насыщения жесткой поверхности и добивается максимума поблизости ее полного насыщения. В данном случае энергия столкновения 2-ух частиц со сплошными адсорбционно-сольватными слоями условно может быть приравнена к эластичному удару сферических тел и определяется модулем упругости слоя.
Расчеты энергии притяжения меж частичками демонстрируют, что с уменьшением размера частиц и расстояния меж ними понижается и нужная толщина адсорбционного слоя, препятствующего сближению частиц. Для частиц с г = 0,5 мкм она должна быть более 10 нм, для частиц с г = 0,1 мкм довольно слоя шириной 5 нм.
Энтропийное отталкивание. Механизм энтропийной стабилизации основан на том, что огромные молекулы пленкообразователей, закрепленные одним концом либо частью частей на поверхности пигмента, сохраняют подвижность собственных углеводородных цепей, которые имеют возможность принимать всякую пространственную конформацию, отвечающую наименьшему энергетическому уровню. Сближение адсорбционных слоев 2-ух частиц, а тем паче их перекрывание понижает возможность реализации многих пространственных конформаций молекул, отвечающих минимуму энергии, т. е. приводит систему к понижению конформационной энтропии. В согласовании со вторым законом термодинамики без подвода энергии снаружи таковой процесс сближения не может осуществиться, что равносильно наличию определенного энергетического барьера, препятствующего сближению частиц с рыхловатыми адсорбционно-сольватными оболочками.
Энергия энтропийного отталкивания URS может быть рассчитана по уравнению Хесселинка:

Энтальпийное отталкивание. При сближении частиц пигментов и перекрывании сольватных слоев увеличивается концентрация молекул пленкообразователя в зоне перекрывания, что приводит к осмотическому переносу растворителя из объема дисперсионной среды в межчастичное место, увеличению давления в этой области и расклинивающему действию, т. е. расталкиванию частиц. Энергия отталкивания в данном случае определяется соотношением:

В «хорошем» растворителе В — величина положительная, в «плохом» отрицательная. Как следует, в не плохих растворителях URHположительна и адсорбционные слои отталкивают друг дружку, а в нехороших притягивают. Но излишек очень неплохого растворителя может вызвать десорбцию пленкообразователя и понижение величин С и d.
Энтропийное и энтальпийное отталкивание возможно только при соблюдении условия h<2d. В ином случае значения URS и URHбудут нулевыми, т. е. в разбавленных суспензиях и для низкомолекулярных пленкообразователей и ПАВ этот фактор не имеет места. Для большинства органорастворимых и водорастворимых ярких систем, содержащих неионогенные ПАВ, при высочайшем ОСП этот механизм стабилизации очень возможен.
Энергия взаимодействия адсорбционных слоев DGR связана с конфигурацией энтропии и энтальпии системы:
DGR=DHR-TDSR
При всем этом символ и значение DGR зависят от соотношения энтальпии и энтропии. Если значение DGR негативно, флокуляция частиц усиливается; если данная величина равна нулю, флокуляция происходит так же, как и в отсутствие адсорбционного слоя (т. е. наступает коагуляция). При положительном значении DGRчастицы защищены от флокуляции. Величина DGR положительна в последующих случаях:
1) когда энтропия и энтальпия отрицательны с огромным значением энтропийного члена; энтропийная стабилизация проявляется при понижении числа конформационных конфигураций цепей полимера в адсорбционном слое;
2) когда обе величины положительны, но доминирует энтальпийный фактор, — будет иметь место энтальпийная стабилизация;
3) когда DHR — положительна, а DSR — отрицательна и, как следует, оба члена содействуют стабильности.
Энергия энтропийных сил отталкивания меж адсорбционными слоями на частичках составляет примерно 40kT, что существенно больше малой энергии 15 kT, которая согласно теории ДЛФО может придать дисперсным частичкам агрегативную устойчивость.
Таким макаром, имеющиеся теории стабилизации дисперсий основаны на содействии адсорбционных слоев, но требования к строению этих слоев различны. Электронные силы отталкивания появляются при адсорбции ионов низкомолекулярных веществ, ПАВ, олигомеров и полиэлектролитов, способных к диссоциации. Электронные силы отталкивания оказывают стабилизирующее действие в большей степени в полярных дисперсионных средах, к примеру, в водоразбавляемых красках.
Для формирования структурно-механического барьера нужны адсорбционно-активные молекулы с молекулярной массой, приближающейся к критичной, при которой меняется конформационное состояние олигомеров и полимеров, и в количестве, достаточном для покрытия поверхности диспергированных пигментов. При отсутствии крепкой связи с активными центрами жесткой поверхности такие слои могут быть нарушены, что вызывает детабилизацию дисперсий.
Для энтропийного отталкивания необходимы также огромные молекулы, способные крепко закрепляться хотя бы одним сектором на жесткой поверхности, а свободными цепями — хвостами либо петлями быть направленными в окружающую дисперсионную среду.
Масляные, эпоксидные и другие олигомеры с молекулярной массой наименее 1000 только на несколько часов задерживают флокуляцию. Надежную стабилизацию обеспечивают полярные олигомеры с молекулярной массой 2000—5000. Огромные полимерные молекулы могут быть неэффективны, потому что они обычно свернуты в клубки и глобулы, крепко связанные внутримолекулярными связями, и только налипают на твердые частички, не образуя с ними хемосорбционных связей.
 21 июля, 2014
21 июля, 2014  Pokraskin
Pokraskin  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: 