Группа желтых, оранжевых и красных пигментов представлена самыми разнообразными по химическому составу соединениями. Общим для всех них является способность поглощать свет в коротковолновой части видимого спектра, в результате чего они и приобретают указанные цвета, которые принято называть теплыми. Из оксидов наибольшее распространение имеют оксиды железа, которые входят в состав пигментов от желтого до темно-красного цвета. Эти пигмегнты находят широкое применение в живописи и различных отраслях техники.
Из других оксидов можно назвать оксиды свинца, которые применяются ограниченно из-за токсичности.
Самую большую группу желтых, оранжевых и красных пигментов представляют соли хромовой кислоты, которые называют Кронами. Несмотря на повышенную токсичность, они широко применяются из-за хороших цветовых характеристик.
Пигменты желтых и красных цветов дают также сульфиды кадмия, обладающие красивым цветом. Однако из-за повышенной стоимости они применяются лишь в особых случаях, например для изготовления художественных красок.
Железооксидные пигменты
Железооксидные пигменты по химическому составу представляют собой гидратированные и негидратированные оксиды трехвалентного железа, а также смешанный оксид железа (II) и же — леза (III). По цвету эти пигменты могут быть желтыми, красными, коричневыми и черными. Между цветом и химическим составом имеется следующая зависимость: желтые пигменты — гидратированные оксиды железа; красные — негидратированные оксиды железа; коричневые — гидратированные оксиды железа или смесь желтых и красных пигментов; черные — смесь оксида железа (II) и оксида железа (III). Железооксидные пигменты могут быть природного происхождения или синтетические. Все оии сравнительно дешевы и широко используются в лакокрасочной промышленности.
Синтетические железооксидные пигменты
Желтые железооксидные пигменты. Среди желтых железооксид — ных пигментов наибольшее применение находит пигмент, представляющий собой моногидрат оксида железа FeO(OH) а-фор — мы — желтый железооксидный пигмент. Цвет его — от желтого до коричневого. Цвет зависит от степени дисперсности: чем она выше, тем светлее оттенок пигмента. Насыщенность и яркость этого пигмента невелики.
Желтый железооксидный пигмент имеет очень хорошие пигментные свойства. Так, укрывистость его достигает 10—12 г/м2, т. е. больше, чем у всех других желтых пигментов. Интенсивность почти равна интенсивности желтого свинцового крона. Атмосферо — и светостойкость очень велики. Пигмент щелочестоек, растворим в минеральных кислотах, нерастворим в уксусной кислоте. Термостойкость пигмента невелика, так как при 180— 200 °С он начинает терять воду и при 270—300 °С переходит в красный оксид железа. Плотность пигмента 3850—3900 кг/м3; маслоемкость 35—70; средний размер частиц 0,2—0,6 мкм; удельная поверхность 11,2 м2/г.
Кроме желтого железооксидного пигмента применение находит Марс желтый, представляющий собой гидроксид железа Fe(OH)3. В отличие от желтого железооксидного пигмента Марс желтый не обладает укрывистостью — он является лессирующим пигментом.
Получают желтые пигменты способами осаждения: окислением кислородом воздуха соли двухвалентного железа в растворе; окислением металлического железа ароматическими нитросоеди — нениями; окислением дисперсии гидроксида или карбоната двухвалентного железа в воде.
Для получения желтого железооксидного пигмента используют первые два способа. Третий способ применяют для получения Марса желтого.
По первому способу в качестве сырья используют чаще всего сульфат железа (железный купорос) FeS04-7H20 (в том числе отходы производства диоксида титана сульфатным способом); металлическое железо (отходы различных производств); аммиак, гидроксид натрия, соду, известь.
Осаждение пигмента ведут в присутствии зародышей, без которых ие удается получить продукт чистого желтого цвета с хорошими пигментными показателями. В отсутствие зародышей процесс кристаллообразования протекает длительное время, и выпавшие в осадок частицы пигмента успевают увеличиться в размерах, что приводит к потемнению цвета и ухудшению пигментных свойств.
Зародыши представляют собой свежеприготовленную взвесь тоикодис — персиого гидроксида железа. Получают зародыши окислением кислородом воздуха или бертолетовой солью гидроксида железа (II) или иногда карбоната Железа, полученных из раствора железного купороса осаждением аммиаком, гидроксидом натрия или известковым молоком. Чаще всего для осаждения используется аммиак. Зародыши получают либо отдельно, либо иепосредствеино в процессе синтеза.
Свойства готового пигмента в значительной степени зависят от условий получения зародышей. Чем ниже температура получения зародышей, тем светлее цвет пигмента. На практике зародыши получают либо при 20 "С, либо при нагревании их до 30—50 °С. Зародыши вводят в количестве около 10% (масс.) по отношению к ожидаемой массе пигмента.
Синтез пигмента проводят в реакторе больших размеров (25—150 м3), изготовленном из стали и футерованном кислотоупорным материалом. Днище реактора коническое и имеет ложное дио в виде деревянной решетки. В реактор заливают раствор железного купороса и загружают металлическое железо. В качестве последнего часто используются отходы жести тарных цехов. Эти отходы не должны содержать примесей легированной стали, масла, грязи и окалииы, поэтому их подвергают предварительной обработке. Оиа заключается в промывке отходов сначала 1—2%-ным раствором серной кислоты, а затем водой. В заполненный реактор вводят зародыши (или получают их непосредственно в реакторе), смесь подогревают до 60—70 °С острым паром и подают через барботер воздух.
Процесс протекает в кислой среде. Кислотность раствора является следствием частичного гидролиза солей трехвалентного железа и зависит от скорости подачи воздуха. Поскольку свойства получаемого пигмента зависят от рН среды, в процессе синтеза строго следят за величиной рН (регулируют скоростью подачи воздуха), которая меняется от 5,2 до 2,9—3,0. Продолжительность синтеза и свойства продукта зависят также от площади поверхности металлического железа. Если она недостаточна, то окисление двухвалентного железа в трехвалентное протекает менее иитеисивио, при этом образуется повышенное количество основных солей железа, которые выпадают в осадок и ухудшают свойства пигмента. В зависимости от величины поверхности железа продолжительность процесса может составлять от 2 до 15 сут. При использовании обрезков жести продолжительность процесса обычно составляет 2—3 сут. Металлическое железо в процессе синтеза растворяется, нейтрализуя избыточное количество кислоты и обеспечивая постоянство концентрации железного купороса в растворе. Кроме того, пигмент может образоваться за счет растворения самого железа.
После окончания процесса суспензию пигмента сливают для отделения металлического железа, грубых частиц и посторонних примесей и отфильтровывают от маточного раствора, представляющего собой раствор железного купороса. Осадок подвергают отмывке водой от водорастворимых примесей, сушат и измельчают,
На рис. 5.16 представлена технологическая схема получения желтого железооксидного пигмента описанным методом.
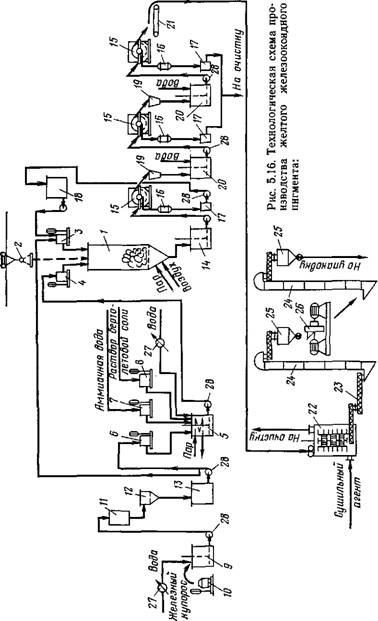
Синтез пигмента проводится в реакторе 1, в который подают предварительно промытые металлические отходы с помощью подъемника 2, раствор железного купороса через мерник 3 и зародыши — через мерник 4. Зародыши готовят в отдельном аппарате 5, куда заливают раствор железного купороса через мерник 6, аммиачную воду через мерник 7 и раствор бертолетовой соли через мерник 8. Для приготовления раствора железного купороса используется аппарат 9. Очищенный на фильтре 12 раствор собирают в сборнике 13. Суспензию железооксидного пигмента выгружают из реактора в сборник 14, Откуда ее непрерывно перекачивают на барабанный вакуум-фильтр 15. С фильтра раствор железного купороса поступает в сборник 18 для повторного использования в производстве. Пасту пигмента репульпируют в репуль — паторе 20 и подают на следующий вакуум-фильтр и т. д. Промывные воды с вакуум-фильтров направляют на очистку. С последнего вакуум-фильтра паста пигмента подается транспортером 21 в сушилку 22, откуда пигмент системой шнеков и элеваторов подается на измельчение в дезинтегратор 26 И на упаковку.
При получении желтого железооксидного пигмента окислением металлического железа ароматическими нитросоедине — ниями в качестве последних чаще всего используют нитробензол. Основной целью процесса является получение ароматического амина (анилина), а оксид железа образуется как побочный продукт. Синтез ведут в присутствии небольшого количества хлороводородной кислоты при кипении смеси. Металлическое железо в таких условиях образует хлорид FeCb, который не принимает непосредственного участия в процессе, а лишь ускоряет окисление железа. Последнее обычно окисляется в смешанный оксид железа (II) и оксид железа (III) черного цвета:
4C6H5N02 + 9Fe + 4Н20 — 4C6H5NH2 + 3Fe304.
Изменив условия реакции, можно получить высокодисперсный светло-желтый пигмент с хорошими пигментными свойствами. Для этой цели в качестве электролитов необходимо применять соли трех — и четырехвалентных металлов. Состав и свойства образующегося оксида зависят от количества такого электролита. Причина специфического влияния электролитов на процесс заключается в том, что растворы их способны гид- ролизоваться почти полностью в присутствии металлического железа. Образующийся гидроксид металла реагирует с гидрок — сидом железа(II), препятствуя этим взаимодействию последнего с гидроксидом железа(ІІІ) с образованием смеси оксида желе — за(ІІ) и оксида железа(ІІІ). Гидроксид железа(П) окисляется в свелто-желтый моногидрат оксида железа FeO(ОН). На практике в качестве электролитов чаще всего применяют растворы соединений алюминия, в частности хлорид алюминия.
Восстановление нитробензола в анилин проводят в реакторах большой емкости (около 20 м3), футерованных кислотоупорным материалом и снабженных мешалками и обратными конденсаторами. В реактор заливают воду и раствор хлорида алюминия. Смесь нагревают острым паром до кипения и загружают порциями нитробензол и чугунную или стальную стружку.
После окончания реакции массу охлаждают и дают ей отстояться. Образующийся верхний слой, содержащий 60% анилина, сифонируют в отстойник. Оставшийся в маточнике и осадке анилин отгоняют с водяным паром. Осадок пигмента промывают, фильтруют, сушат и измельчают.
Марс желтый получают окислением карбоната или гидроксида железа(ІІ). Карбонат и гидроксид железа получают при взаимодействии соли двухвалентного железа, чаще всего железного купороса, с кальцинированной содой или щелочами. Окисление полученных осадков проводят кислородом воздуха при 50—60°С:
FeS04 + Na2C03 — FeC03 + Na2S04 , 2FeC03 + лН20 + 0,502 — Fe203-nH20 + 2C02.
Условия проведения реакций осаждения и окисления оказывают значительное влияние на цвет и состав осадка. В том случае, когда для окисления используют бертолетову соль, пигмент получается более чистого цвета, чем в случае окисления кислородом воздуха. В некоторых случаях к раствору железного купороса добавляют раствор сульфата алюминия или алюмокалиевых квасцов. При добавлении соды образуется гидроксид алюминия, в присутствии которого и проходит окисление карбоната железа.
Желтый железооксидный пигмент применяют для получения красок самых различных типов. Смесь пигмента с наполнителем в соотношении (1:7) — (1:8) носит название Синтетической охры. Часть пигмента перерабатывается в красный железооксидный пигмент.
Марс желтый применяют главным образом в художественных красках, а также в красках для отделки древесины.
Красные железооксидные пигменты представляют собой почти чистый оксид железа РегОз, содержание которого достигает 95—98%. Кристаллизуются пигменты в гексагональной сингонии. Цвет пигментов от оранжево-красного до малинового и пурпурного (в полном тоне) и от розового до сиреневого (в разбеле). Оттенок зависит от формы и размера частиц. В пигментах светлых тонов размер частиц 0,35—0,45, темных — 2,5 мкм. Форма частиц пигментов светлых оттенков игольчатая или пластинчатая, темных — зернистая. Как и для желтых пигментов этого типа, имеется также красный лессирующий пигмент (Марс красный).
Получают красные железооксидные пигменты термическим способом из железного купороса или желтого железооксидного пигмента.
В первом случае процесс проводят в две стадии: вначале железный купорос обезвоживают при 350—400 °С до образования моногидрата сульфата железа, а затем прокаливают его при 700—825 °С для образования оксида железа:
FeS04-7H20 ^ FeS04-H20 + 6Н20, 2FeS04-H20 — Fe203 + S03 + S02 + H20.
Обезвоживание железного купороса сопровождается значительным спеканием его частиц, что приводит к получению пигмента низкого качества. Поэтому после обезвоживания продукт подвергают измельчению. Процесс прокаливания обычно длителен. Его проводят до остаточного содержания сульфата железа 5—10%. В результате длительной выдержки оксида железа при высокой температуре происходит укрупнение его частиц, что приводит к получению грубодисперсного пигмента с плохими свойствами. Цвет пигмента зависит от температуры прокаливания. Так, при 700—725 °С получают пигмент с желтоватым оттенком, а при 725—825 °С — с синеватым. Введение в железный купорос специальных добавок дает возможность изменять цветовой оттенок пигмента. Например, добавление хлорида натрия приводит к образованию пигмента с фиолетовым оттенком.
Обезвоживание и прокаливание железного купороса обычно проводят во вращающихся печах. Технологическая схема проведения этих операций приведена на рис. 5.17.
Железный купорос ленточным транспортером 1 через тарельчатый питатель 2 подают в загрузочное устройство элеватора 3. Из него Железный купорос попадает в смеситель шнекового типа 4, где к нему добавляют моногидрат сульфата железа для уменьшения спекания продукта при обезвоживании. Из смесителя 4 смесь через бункер 5 поступает в барабанную сушилку 6.
Сушилка обогревается газами нз топки 7. Отходящие газы частично освобождаются от пылн в пылеуловнтельной камере 8 и поступают в батарейный циклон 9, откуда пыль через элеватор 3 попадает в смеситель 4, А газ поступает на окончательную очистку в скруббер 10.
Полученный после обезвоживания продукт охлаждается в транспортерной трубе 11 и подается элеватором 12 в бункер 13. Из этого бункера часть моногидрата сульфата железа тарельчатым питателем 14 загружается в смеситель 4, а основная масса его питателем 15 подается во вращающуюся печь 16. Обогрев осуществляется газами, которые поступают в печь из топки 17. Очистка отходящих газов от пыли производится в батарейном циклоне 18 и электрофильтре 19. Из них пыль вновь поступает через элеватор 12 В бункер 13. Освобожденный от пыли газ направляют в отделение утилизации сернистых газов. Продукт прокаливания охлаждают в барабане 21, а затем подвергают четырехкратной промывке репульпацией, сушке и измельчению.
|
|
Второй способ получения красного железооксидного пигмента заключается в прокаливании моногидрата оксида железа— желтого железооксидного пигмента — при 600—650 °С:
2FeO(OH) — Fe203+ Н20.
К достоинствам этого способа можно отнести его простоту и высокие качества получаемого продукта, к недостатку — высокую стоимость сырья. Обычно желтый железооксидный пигмент и красный получают в одном цехе.
Лессирующий красный железооксидный пигмент (Марс красный) получают из желтого марса прокаливанием при 400 °С. При более высокой температуре (600—700 °С) образуется красный оксид железа.
Красные железооксидные пигменты, как правило, характеризуются чрезвычайно высокой укрывистостью (4—6 г/м2). Плотность красных железооксидных пигментов от 4500 до 5000 кг/м3; маслоемкость 20—50; интенсивность высокая. Они термо-, свето — и атмосферостойки.
Применяются красные железооксидные пигменты для приготовления самых разнообразных красок и эмалей, для окраски пластмасс, линолеума, бумаги и др. Леосирующий красный марс применяют в художественных красках.
Коричневые железооксидные пигменты представляют собой смесь красных и черных железооксидных пигментов. По химическому составу черный пигмент — смесь оксидов двух — и трехвалентного железа Fe304. Цвет коричневых пигментов зависит от соотношения между этими оксидами. Светло-коричневый пигмент, например, содержит 93% Fe203 и 6% FeO, а ярко-ко — ричневый —85% Fe203 и 14% FeO.
Получают их осаждением или термическим способом. При осаждении коричневых пигментов процесс ведут так же, как при получении желтых пигментов при окислении ароматическими нитросоединениями или как при получении желтого марса. Цвет пигмента при этом регулируется количеством электролита, гидролизующегося в присутствии металлического железа, температурными условиями осаждения, а также количеством окислителя или скоростью подачи воздуха.
Термический способ получения коричневых пигментов состоит в прокаливании Fe304 или Fe(OH)2, а также FeC03 при 400 °С.
Лессирующий пигмент (Марс коричневый) можно получать Яз железного купороса осаждением его аммиаком в присутствии сульфата марганца. Полученный при этом осадок окисляют воздухом в щелочной среде, отмывают, сушат и прокаливают при 180—200 °С.
По свойствам коричневые пигменты подобны другим желе- зооксидным пигментам.
Природные железооксидные пигменты
Природные пигменты, так же как и синтетические, могут иметь желтый, коричневый и красный цвета, которые обусловлены присутствием в них гидратированных и негидратированных оксидов железа. Кроме этих оксидов природные пигменты содержат многочисленные примеси, в том числе примеси органических веществ, которые также оказывают влияние на цвет. Основными примесями являются кремнезем, глинозем, карбонаты, кальция, магния и железа, соединения марганца и др.
Получают природные железооксидные пигменты механическим способом из твердых горных пород и минералов или мягких глинистых пород. Различают сухой и мокрый способы переработки природного сырья в пигмент.
Сухой способ состоит из следующих операций: отбор пустой породы, дробление, сушка, размол и воздушная сепарация. В производстве красных пигментов вместо сушки при» 130—150 °С проводят прокаливание при 400—600 °С. Сухой способ применяют главным образом для производства железного сурика и мумии, но он может применяться для получения; и других пигментов.
Мокрый способ включает следующие операции: отму — чивание, обезвоживание, сушку, размол с сепарацией. Этот способ сложнее сухого, но зато дает возможность использовать более загрязненное сырье, а также получать пигменты с высокой степенью дисперсности. Мокрый способ используется ДЛЯ; получения охр, сиен, умбр и др.
Природные пигменты по свойствам уступают синтетичен КИМ, но они значительно дешевле последних. Их широко используют в водных и масляных красках, предназначенных для> окраски строительных конструкций, изделий из древесины и металла, а также для окраски линолеума, бумаги, цемента и бетона, в производстве керамических плиток и др. Наибольшее применение имеют охра, сиена, мумия, железный сурик, умбра, и др.
Охры представляют собой пигменты желтого цвета с раз^ личным содержанием гидратированных оксидов трехвалентного железа. В светлых охрах их содержится 12—17, в средних — 22—44 и в золотистых (железооксидных) —40—85%. Основными примесями являются алюмосиликаты. Цвет охры зависит не только от химического состава, но и от кристаллического стро — •ения, дисперсности и форм частиц пигмента. Сырьем для получения охр служат бурые железняки.
Как и все природные пигменты, охры полидисперсны. Средний размер их частиц 1—3 мкм. Укрывистость охр зависит от содержания в них гидрата оксида железа и с повышением его возрастает с 90 до 25 г/м2. В тонких слоях охры просвечивают и используются как лессирующий пигмент. Охры обладают свето — и атмосферостойкостью, но не обладают коррозионной СТОЙКОСТЬЮ. Кроме того, они стойки к воздействию щелочей и слабых кислот. Термостойкость их невелика.
Одной из разновидностей охр являются пигменты, содержащие примеси карбонатов кальция и магния. Такие охры носят название «тощих» или «карбонатных».
Охры применяют для получения красок различных типов (масляных, эмалевых, водных и др.), а также для художественных красок.
Сиена представляет собой разновидность охр. Цвет ее желто-коричневый. В состав сиены входят алюмосиликаты, окрашенные гидратированными оксидами железа, оксиды марганца, диоксид кремния и некоторое количество органических примесей. Содержание оксидов железа в сиене 45—55%, средний размер частиц 2—4 мкм, маслоемкость 50—55. Сиена является лессирующим пигментом.
Применяют сиену для производства художественных красок, а также для отделки древесины под ценные породы, при производстве карандашей и т. д.
Железный сурик представляет собой красный пигмент с Содержанием оксида железа 75—95%. Основные примеси — глинистые вещества и кремнезем.
Сырьем для получения пигмента служат главным образом красные железняки. Особенностью пигмента является его высокая укрывистость и интенсивность. Средний размер частиц 2—4 мкм. Он свето-, атмосферо — и коррозионностоек, устойчив к воздействию щелочей и слабых кислот.
Железный сурик очень широко применяется для приготовления красок различного назначения на основе пленкообразующих веществ практически всех видов.
Мумии отличаются от железного сурика меньшим содержанием оксидов железа (20—70%). В зависимости от содержания различают железооксидные, глинистые и бокситные мумии. Последние содержат значительное количество оксида алюминия.
Сырьем для получения мумий служат болотные руды, высокожелезистые бокситы и др.
Цвет мумий зависит от содержания Рег03 и может изменяться от светлого до темного коричнево-красного. Мумии характеризуются высокими укрывистостью и интенсивностью, свето-, атмосферо — и химической стойкостью.
Применяют мумии для изготовления красок и эмалей всех типов.
Прокаленная охра и сиена жженая. В качестве красных пигментов используются продукты прокаливания охры и сиены при 500—700°С. При прокаливании происходит дегидратация оксидов железа, входящих в эти желтые пигменты, в результате чего они приобретают красивый красный цвет. Используют прокаленную охру и сиену жженую для изготовления художественных красок.
Умбра — природный железооксидный коричневый пигмент, цвет которого обусловлен наличием оксидов марганца (до 16% в пересчете на Мп02). Содержание оксидов железа в умбре в среднем составляет 25%. При прокаливании при 400—600°С умбра приобретает цвет от ярко — до темно-коричневого.
Применяется умбра в художественных красках, а также в строительной технике.
Оксиды свинца
Состав, свойства и применение. К оксидам свинца обычно относят глет РЬО и свинцовый сурик РЬз04, что неточно, так как в действительности сурик является солью ортосвинцовой кислоты. Иногда считают, что сурик является смешанным оксидом состава 2РЮ-РЬ02.
Оксид свиица может кристаллизоваться в двух кристаллических модификациях: тетрагональной (а-РЬО — глет) и ромбической (f$-PbO — массикот). При определенных условиях оксид одной модификации может переходить в оксид другой модификации. Такой переход, например, происходит при 489 °С. Ниже этой температуры устойчив а-РЬО, а выше — [$-РЬО. Переход а-РЬО в f$-PbO ускоряется при повышении температуры. Обратный переход прн охлаждении происходит очень медленно, поэтому f$-PbO неопределенно долго может существовать и при комнатной температуре. Такое состояние кристаллического вещества иосит название метастабильного. При незначительном механическом воздействии, например измельчении, переход в устойчивую форму может произойти очень легко и быстро.
Модификации а-РЬО и (3-РЬО различаются по своим свойствам. Так, А-РЬО имеет красно-коричневый цвет, а (5-РЬО — желтый. В водной среде [5-оксид более реакциоииоспособеи, чем а-оксид.
В технике оксид свинца называют глетом. Он представляет собой дисперсный порошок, цвет и свойства которого зависят от кристаллической структуры и наличия примесей. Цвет может быть желтым, серо-зеленым и красноватым (до буро — красного). В воде глет практически нерастворим. Растворяется в азотной, хлороводородной и уксусной кислотах, а также в концентрированных растворах щелочей. С жирными кислотами глет образует свинцовые мыла.
Как пигмент глет в настоящее время не применяется. В лакокрасочной промышленности он используется главным образом в качестве сырья для производства ряда свинецсодержа — щих пигментов и сиккативов. Применяется глет также в аккумуляторной промышленности, для производства стабилизаторов поливинилхлорида, в производстве керамических красок и для получения различных солей свинца. Таким образом, глет используется во всех перечисленных областях как сырье, поэтому для него главными являются не пигментные свойства,, а степень чистоты и наличие посторонних примесей.
Свинцовый сурик РЬз04 содержит в своем составе до 94,5% основного вещества. В отличие от глета он кристаллизуется только в тетрагональной сингонии. Цвет его от светло — оранжевого до красного; размер частиц 2—10 мкм.
Свинцовый сурик практически нерастворим в воде. В азотной кислоте он частично растворяется с выпадением в осадок РЬ02.
Сурик имеет хорошую укрывистость, но низкую интенсивность. Он не атмосферостоек, но обладает ярко выраженными антикоррозионными свойствами, которые проявляются в его окислительном действии, способности к образованию свинцовых мыл, а также в легкости взаимодействия с ионами железа, образующимися в результате коррозии, с возникновением прочных комплексов.
Существенным недостатком свинцового сурика является его токсичность. Предельно допустимая концентрация в воздухе рабочих помещений в пересчете на свинец составляет 0,0111 мг/м3.
В лакокрасочной промышленности сурик используют в качестве антикоррозионного пигмента в составе грунтовок для черных металлов. При этом необходимо учесть, что грунтовки на основе масляных и алкидных связующих способны загустевать и даже затвердевать вследствие взаимодействия свободного оксида свинца, содержащегося в сурике, с карбоксильными группами. Поэтому такие грунтовки готовят непосредственно перед употреблением. Свинцовый сурик применяется также в аккумуляторной, стекольной и керамической промышленности.
Получение. Свинцовый глет можно получать разными методами: разложением соединений свинца; электролизом растворов солей свинца; окислением твердого, расплавленного свинца или его паров. Основными из этих методов являются: окисление расплавленного свинца и окисление твердого свинца. Оба этн метода двухстадийные; сырьем в них служит металлический свинец.
По первому методу вначале получают так называемый глет-полуфабрикат окислением расплавленного свинца кислородом воздуха при 330—
500 °С. Для создания большей поверхности окисления расплавленный свинец разбрызгивают. Эту операцию производят в окислительной печи («окислительном котле»). Непрерывно подаваемый в нее расплавленный свинец разбрызгивается специальной лопастной мешалкой, дробится и растекается по стенкам печи. В печь подается воздух со скоростью 800—1100 м3/ч. Образующийся оксид свинца вместе с частицами неокислившегося свинца этим же потоком воздуха выносится из печи и направляется в уловительную систему. Глет-полуфабрикат может содержать до 80—95% окснда свинца, причем как в а-, так и в [З-форме (смесь). Его подвергают дополнительному окислению кислородом воздуха при 500—600 °С в печах второго обжига. Эти печи представляют собой муфели, снабженные специальными тихоходными мешалками с гребками. Они могут работать непрерывно или периодически. В результате повторного окисления получают глет с содержанием РЬО до 99,5%, который поступает на размольно-сепарационную установку и далее — на упаковку.
По второму методу на первой стадии получают свинцовый порошок с размером частиц менее 50 мкм и содержанием 65—80% РЬО, причем преимущественно в а-форме. Процесс проводят при интенсивном измельчении металлического свинца в присутствии воздуха при 100—200 °С.
В качестве аппаратов для измельчения применяют мельницы различных конструкций. Воздух, подаваемый в мельницы, выполняет несколько функций. Он одновременно является окислителем свинца, хладоагентом и транспортирующим агентом (газом-носителем).
На второй стадии свинцовый порошок доокисляют и получают глет с содержанием 99,9% РЬО. Одним из технических способов осуществления этого процесса является окисление свинцового порошка паровоздушным распылением. Процесс протекает очень быстро, и получаемый глет характеризуется высокой дисперсностью. Недостатком этого процесса является большой расход воздуха, который перед выбросом в атмосферу необходимо подвергать очистке.
Энергоемкость и производительность обоих методов получения глета практически не различаются. Однако в первом случае готовый продукт содержит примеси железа и по качеству уступает глету, полученному вторым методом.
Промышленность выпускает глет пяти сортов. Содержание оксида свинца в них составляет от 96,0 до 99,5%. Основными примесями являются: РЬ02 — до 0,3%, металлический свинец— от 0,1 до 2,5%, а также примеси цветных металлов и железа.
Сырьем для получения свинцового сурика являются глет — полуфабрикат и свинцовый порошок. Они подвергаются окислению кислородом воздуха при температурах до 480 °С. Вначале процесс протекает на активных центрах поверхности частиц оксида свинца (углы, трещины, дефекты кристалла и т. п.), а затем продолжается на межфазной поверхности раздела сурик — оксид свинца.
Следует отметить, что а-РЬО значительно легче переходит в сурик, чем {S-PbO. Вероятно, это объясняется тем, что сурик и а-РЬО кристаллизуются в одной и той же сингонии—тетрагональной. В связи с этим свинцовый порошок является лучшим видом сырья для производства сурика, чем глет — полуфабрикат. Кроме того, содержание металлического свинца в последнем выше. Присутствие же металлического свинца в сырье в процессе получения сурика приводит к его бурному окислению с выделением большого коли
чества тепла, что нежелательно, так как может привести к переходу а-РЬО в Р-РЬО.
В настоящее время наиболее совершенным является следующий процесс получения свинцового сурика. Вначале глет — полуфабрикат подвергают гранулированию (интенсивному механическому воздействию) в присутствии воды. При этом р-РЬО переходит в а-РЬО. Затем гранулированный а-РЬО при 430°С окисляют в свинцовый сурик (аналогичный процесс при 600 °С приводит к образованию высококачественного гранулированного глета). Использование гранулированного сырья имеет ряд существенных преимуществ. Так, значительно уменьшается пыление, улучшаются условия транспортирования, предотвращается налипание сырья в печи. Кроме того, применение гранулированного сырья дает возможность проводить процесс окисления во взвешенном слое.
Свинцовые крона
Свинцовые крона представляют собой хроматы свинца РЬСг04 лимонного, желтого, оранжевого или красного цвета. Цвет зависит от того, в какой сингонии кристаллизуется крон. В ромбической сингонии цвет пигмента лимонный (светло-желтый), в моноклинной — желтый (темный), а в тетрагональной — оранжевый или красный.
Желтые свинцовые крона по химическому составу представляют собой чистый хромат свинца РЬСг04 или изоморфную смесь хромата и сульфата свинца PbCr04-rtPbS04. Цвет зависит от содержания сульфата в этой смеси — чем оно выше, тем светлее пигмент.
Промышленность выпускает, как правило, три-четыре типа пигмента, различающиеся по цвету. Смешением их можно получить дополнительно целый ряд оттенков. Так, например, светло-лимонный крон содержит 45—50% сульфата свинца, лимонный — 30—40%, средний — до 15%, а темный вообще не содержит сульфата свинца. Введение в состав свинцового крона сульфата свинца приводит к значительному повышению стабильности ромбической сингонии, для которой характерен светло-желтый или лимонный цвет. Одновременно сульфат свинца оказывает разбеливающее действие на пигмент, что также способствует получению светлого цвета. Однако при введении его в количестве более 50% сильно снижается яркость пигмента, поэтому такие крона обычно не применяются.
Желтые свинцовые крона получают осаждением их из растворов (или суспензий) ацетатов, нитратов или хлоридов свинца. Процесс производства кронов состоит из следующих операций: приготовление исходных растворов (суспензий) солей свинца; приготовление раствора хромовой смеси; осаждение
Крона; промывка пигмента; фильтрование, сушка, размол и упаковка.
Ацетаты свинца, используемые в качестве исходных растворов, готовят обработкой глета уксусной кислотой. Средние ацетаты свинца обычно не применяют, так как при их приготовлении требуется большой расход уксусной кислоты. Кроме того, в процессе осаждения пигмента образуются в качестве отходов большие количества сильноразбавленной уксусной кислоты. Более экономичным оказывается приготовление основных ацетатов свинца, так как в этом случае используются разбавленные растворы уксусной кислоты. При осаждении же пигмента в качестве побочного продукта образуются ацетаты натрия или калия, которые могут быть выделены и использованы для различных целей. Уксусная кислота как побочный продукт образуется в незначительных количествах. Из основных ацетатов используют чаще всего одно — и двухосновные соли, которые растворяются в воде достаточно хорошо, и пятиосновную соль, образующую в воде суспензию. Последняя является самой дешевой исходной солью.
Хлориды свинца готовят обработкой глета хлороводородной кислотой или раствором хлорида натрия. Чаще всего в качестве исходной соли для получения кронов используют основной хлорид свинца, называемый хлороксидом свинца РЬС12-яРЬО. Так, например, РЬС12-6РЬО можно получить обработкой глета раствором NaCl:
7РЬ0 + 2NaCI + Н20 — PbCl2-6PbO + 2NaOH.
В настоящее время желтые и лимонные свинцовые крона получают главным образом из растворов нитратов свинца, среди которых находят применение средняя соль Pb(N03)2, основная Pb(N03)2-Pb(0H)2 и основный нитрат-нитрит Pb(N03)2-Pb(N02)2-Pb(0H)2.
При обработке глета азотной кислотой получают средний или основный нитрат свинца; при обработке же металлического свинца азотной кислотой получают средний или основный нитрат-нитрит свинца.
Использование металлического свинца для приготовления нитратов имеет ■большее практическое значение. Для увеличения скорости растворения свинца в азотной кислоте используют гранулированный свинец с гранулами размером 2—5 мм. При получении средней соли гранулированный свинец обрабатывают 10—15%-ной HN03 при 80—90 °С, а при получении нитрат-нитрита используют 4—5%-ную азотную кислоту с температурой 90—100°С. Процесс обычно осуществляют непрерывным методом в колонном аппарате, в котором поддерживают постоянный уровень гранулированного свинца подачей его через короткие промежутки времени, а азотная кислота подается в аппарат с постоянной скоростью.
Вторым исходным раствором для получения кронов служит так называемая «хромовая смесь», которая представляет собой водный раствор бихро — мата калия или натрия с добавлением серной (или хлороводородной) кислоты. В отдельных случаях в смесь вводят и другие соединения. Например, часть серной кислоты можно заменить на сульфат алюминия, который в процессе осаждения пигмента перейдет в гидроксид алюминия при добавлении к хромовой смеси небольшого количества соды. Гидроксид алюминия является модифицирующей добавкой, повышающей дисперсность, интенсивность и светостойкость свинцового крона.
Синтез крона проводят при смешении описанных выше исходных растворов. Условия синтеза определяют состав получаемого пигмента. Порядок сливания растворов, интенсивность и длительность перемешивания, кислотность среды и температура — все эти факторы определяют свойства получаемого пигмента. Например, снижение кислотности среды приводит к усилению красного оттенка, светлый пигмент осаждается при 20—25, а темный — при 50 °С.
Ниже приведены химические реакции, которые протекают при осаждении кронов из растворов разных соединений свинца:
2[Pb(CH3COO)2-2Pb(OH)2] + 3Na2Cr207 + 2HCI —
— 6PbCr04 + 4CH3COONa + 2NaCI + 5H20;
Pb(CH3COO)2-2Pb(OH)2 + Na2Cr207 + H2S04-
— 2[PbCr04-0,5PbS04] + 2CH3COONa + 3H20;
2[Pb(CH3COO)2-5Pb(OH)2] + 3Na2Cr207 + 6H2S04 + 2ИСІ —
— 6[PbCr04-PbS04] + 4CH3COONa + 2NaCI + 17H20;
4Pb(N03)2 + Na2Cr207 +2H2S04 + 3Na2C03 —
— 2[PbCr04-PbS04] + 8NaN03 + 3C02 + 2H20;
2[Pb(0H)2-Pb(N03)(N02)] + Na2Cr207 + 2H2S04 + Na2C03 —
— 2[PbCr04-PbS04j + 2NaN03 + 2NaN02 + C02 + 4H20.
По окончании сливания растворов образовавшуюся суспензию некоторое время выдерживают при перемешивании при определенной температуре и рН среды. Эту операцию называют «вызреванием». Проводят ее с целью получения пигмента определенной кристаллической структуры и необходимой дисперсности.
По окончании процесса получения свинцового крона его отмывают от водорастворимых примесей, затем сушат при 70—80 °С и измельчают.
На рис. 5.18 показана технологическая схема получения желтого свинцового крона из раствора нитрата свинца.
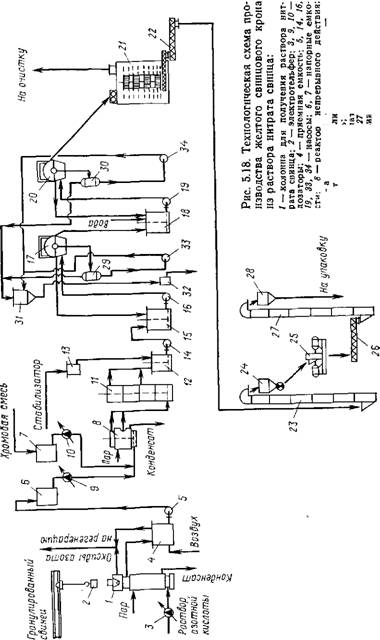
Получают этот раствор в колонне 1, куда предварительно гранулирован — ;ный свинец подают с помощью электротельфера 2. Разбавленную до необходимой концентрации азотную кислоту непрерывно вводят через дозатор 3 в нижнюю часть колонны. Раствор нитрата свинца непрерывно сливают в приемную емкость 4, откуда перекачивают насосом 5 в напорную емкость 6. Предварительно приготовленную хромовую смесь собирают в напорной емкости 7. Осаждение пигментов проводят в реакторе непрерывного действия 8. Исходные растворы непрерывно вводят в него в заданных соотношениях с помощью дозаторов 9 к 10, а образовавшуюся суспензию непрерывно сливают самотеком для «вызревания» в аппарат 11. Для стабилизации кристаллической структуры образовавшегося крона предназначен аппарат 12. В него вводят из мерника 13 предварительно приготовленные растворы стабилизаторов. Суспензию готового пигмента насосом 14 перекачивают в емкость 15, Откуда она поступает для фильтрования на вакуум-фильтр 17. Отмывку пигмента от водорастворимых солен проводят в репульпаторе 18. Отфильтрованная на вакуум-фильтре 20 паста пигмента поступает в сушилку 21. Высушенный пигмент системой шнеков и элеваторов подается на измельчение в дезинтегратор 25 н на упаковку.
Фильтраты нз вакуум-фильтров 17 н 20 используются в технологическом процессе, что фактически исключает проблему сброса сточных вод, которые требуется тщательно очищать от нонов тяжелых металлов. Образующиеся в процессе производства нитрата свинца оксиды азота улавливаются н направляются на регенерацию.
Свинцовые желтые крона имеют плотность от 5100 до 6200 кг/м3. Укрывистость их 45—65 г/м2, причем этот показатель зависит от цвета крона: для темных оттенков он несколько выше, чем для светлых. Маслоемкость также зависит от цвета: для светлых она составляет 13—28, а для темных — 10—18. Интенсивность свинцовых кронов высокая. Размер частиц свинцового крона от 0,2 до 3 мкм, а форма их зернистая или игольчатая. Свинцовые крона несветостойки: они довольно быстро темнеют и приобретают зеленоватый оттенок. Причиной потемнения пигмента может быть переход из ромбической сингонии в моноклинную. Кроме того, шестивалентный хром может восстанавливаться в трехвалентный, имеющий зеленый цвет. Потемнение связано с темным цветом хромита свинца РЬО-Сг2Оз и окислением свинца с образованием пероксида свинца черного цвета.
В настоящее время разработаны методы получения свинцовых кронов с повышенной светостойкостью. При этом широко используется модификация их поверхности такими соединениями, как гидроксид или фосфат алюминия и др.
Атмосферостойкость свинцовых кронов достаточно хорошая. Термостойкость их невысока. Химическая стойкость зависит в значительной мере от химического состава крона, поскольку кислоты и щелочи по-разному действуют на хромат и сульфат свинца. Так, хромат свинца лишь частично растворим в разбавленных кислотах; в концентрированных хлороводородной и азотной он растворяется полностью, а в уксусной кислоте не растворяется. При воздействии разбавленных растворов щелочей. и соды хромат свинца переходит в основной хромат
PbCrCVPbC), имеющий оранжевый или красный цвет. Сульфат свинца в концентрированных растворах хлороводородной кислоты и щелочей растворяется. При действии раствора соды хромат свинца переходит в РЬС03.
Свинцовые крона чувствительны к воздействию сероводорода, который вызывает их потемнение за счет образования черного сульфида свинца PbS. Диоксид серы вызывает обесцвечивание пигмента. Модификацией поверхности кронов можно значительно повысить стойкость их к действию этих газов.
Свинцовые крона относят к токсичным соединениям, поскольку в их состав входит свинец и хром. Последний придает кронам канцерогенные свойства. Однако при соблюдении правил личной гигиены, охраны труда и техники безопасности при работе со свинцовыми кронами опасность отравления ими невелика. Гораздо более опасными являются соединения свинца,, используемые при синтезе в качестве сырья.
Желтые свинцовые крона очень широко применяют для изготовления различных типов красок и эмалей, клеевых и полиграфических красок, для окраски линолеума, искусственных волокон, пластмасс и др.
Оранжевые и красные свинцовые крона представляют собой основный хромат или оксихромат свинца РЬСг04-РЬ0. Оранжевый крон отличается от красного только размером частиц: у красного крона частицы значительно крупнее и имеют вид чешуек. При диспергировании такого пигмента происходит измельчение частиц с изменением цвета на оранжевый.
Кроме обычных свинцовых кронов известен также свинцово — молибдатный крон, который представляет собой смесь хромата, молибдата и сульфата свинца, полученную их совместным осаждением. Цвет этого крона — от оранжево-красного до тем — но-красного. Выпускаемый промышленностью крон приближенно имеет состав 7PbCr04-PbMo04-PbS04. Его кристаллическая структура еще не изучена в достаточной степени, но обычно ей приписывают искаженную тетрагональную сингонию.
Оранжевый крон получают способом осаждения. В качестве исходной соли свинца используют основные ацетаты,, которые готовят обработкой глета разбавленной уксусной кислотой. Осаждение пигмента ведут при 80—90 °С в щелочной среде при рН>9, для чего в хромовую смесь вводят щелочь и соду:
4[Pb(CH3COO)2-2Pb(OH)2] + 3Na2Cr207 + 2NaOH —
— 6[PbCr04-Pb0] + 8CH3COONa + H20;
2[Pb(CH3COO)2-5Pb(OH)2] + 3Na2Cr207 —
— 6[PbCr04-Pb0] + 4CH3COONa + 2NaOH + 9H20.
После осаждения крона его отмывают от водорастворимых примесей, сушат при 150 °С и измельчают.
Оранжевый крон может иметь цвет от светлого до темного в зависимости от степени дисперсности. Очень светлый крон содержит в качестве примесей желтый крон. Укрывистость и интенсивность оранжевого крона высокие, но по светостойкости он значительно превосходит желтый свинцовый крон. Он также термостоек и обладает коррозионной стойкостью и ат — мосферостойкостью. В воде пигмент практически нерастворим, в неорганических кислотах и концентрированных растворах щелочей растворяется полностью. Уксусная кислота выщелачивает из крона оксид свинца. Оранжевый крон не вступает в реакцию мылообразования с маслами и карбоксилсодержащи — ми пленкообразующими веществами. Из-за растворимости в слабых кислотах токсичность оранжевого крона значительно выше, чем желтого свинцового крона.
Оранжевый крон применяют для получения грунтовок по стали, атмосферостойких покрытий и др.
Красный крон получают обычно из свинцовых белил, обрабатывая их кипящим раствором нейтрального хромата калия или натрия. Последний получают добавлением к бихро- мату щелочи или соды.
Процесс осаждения ведут в сильнощелочной среде при кипячении и слабом перемешивании массы. Красный крон можно получать также и из хлороксида свинца. Свойства красного свинцового крона из-за низкой дисперсности хуже, чем оранжевого крона, однако светостойкость его выше. Применяется красный крон очень ограниченно — обычно для грунтовок и шпатлевок.
С в и н ц о в о-м олибдатный крон получают способом осаждения. В качестве исходной соли свинца обычно используются нитраты, которые получают описанными выше способами. В состав хромовой смеси входят бихромат и сульфат натрия и молибдат аммония. Проведение синтеза свинцово-молиб — датного крона требует большого внимания. Даже незначительные отклонения от установленных режимов приводят к получению оранжевого или желтого пигмента вместо красного. Так, например, в процессе осаждения пигмента обязателен избыток соли свинца, в то время как избыток солей хрома недопустим. Поэтому хромовую смесь вливают в раствор нитрата свинца, который берется в небольшом избытке против расчетного. Синтез крона следует проводить при температуре не выше 18—20 °С. Исходные растворы должны быть низкой концентрации. Необходимо соблюдать требуемую продолжительность стадий осаждения, выдержки и др.
Очень важное значение имеет кислотность среды при синтезе крона. При сливе растворов значение рН должно быть около 4,5; при последующей выдержке — 3,5 для получения оранжевого крона, 2,5 — для красного и 2,0 — для темно-красного. Значение рН регулируется добавлением на различных стадиях синтеза растворов кислоты или щелочи. Кроме того, хромовая смесь предварительно нейтрализуется щелочью до — рН 7,1—7,2 для образования хромата Na2Cr04.
В процессе синтеза свинцово-молибдатного крона протекают весьма сложные процессы. Установлено, что вначале при сливании исходных растворов выпадают отдельно осадки хромата, сульфата и молибдата свинца. Хромат свинца имеет желтый цвет, сульфат свинца — белый, а молибдат свинца — белый с желтоватым оттенком. При последующем перемешивании смеси цвет ее переходит через оранжевый в красный. Объясняется это тем, что образуется изоморфная смесь состава 7PbCr04-PbMo04-PbS04. Чувствительность происходящих процессов к внешним условиям объясняется полиморфизмом составных частей пигмента и их способностью к образованию изоморфной смеси. Вначале образуется ромбическая сиигоиия хромата свинца светло-жел — того цвета. Затем происходит перекристаллизация хромата свинца в тетрагональную сингоиию красного цвета. Сульфат свинца не кристаллизуется в тетрагональной сингонии. Вероятно, роль его заключается в стабилизации ромбической сиигоиии хромата с образованием смеси PbCr04-PbS04. В этом случае затруднен переход хромата в моноклинную сингонию темно-желтого цвета, которая не способна к перекристаллизации в тетрагональную. Роль молибдата свинца, очевидно, заключается в том, что частицы его служат зародышами при перекристаллизации хромата свинца из ромбической в тетрагональную сингонию. Образование изоморфной смеси хромата и молибдата свинца приводит к стабилизации тетрагональной сиигонии, однако красный цвет пигмента может вновь перейти в оранжевый или даже желтый при последующих операциях технологического процесса (промывке, сушке и др.). Поэтому обычно проводят стабилизацию пигмента добавлением таких соединений, как гидроксид алюминия, кремневая кислота, фталат свинца, соединения сурьмы и олова и др. Добавки эти обычно вводят после «вызревания». Маточный раствор при этом нейтрализуют до рН 6,5—7,5. Введение стабилизаторов приводит к повышению также свето-и атмосферостойкости пигмента.
Плотность свинцово-молибдатного крона 5600—6000 кг/м3.. Он обладает высокой укрывистостью и интенсивностью, причем эти свойства снижаются при переходе от светлых к темным оттенкам. Оптимальный размер частиц 0,3—0,4 мкм.. Светостойкость этого крона примерно такая же, как для желтых свинцовых кронов. Улучшенные сорта обладают очень высокой свето — и атмосферостойкостью. Свинцово-молибдатный крон имеет удовлетворительную стойкость к воздействию уксусной и разбавленной серной кислот, а также щелочей. К воздействию хлороводородной кислоты и извести крон не стоек.
Применяют свинцово-молибдатный крон для изготовления эмалей разных типов, полиграфических красок, для окраски пластмасс и др.
Цинковые крона
Цинковые крона представляют собой целую группу хроматов; цинка различного типа. Наибольшее значение имеют высокоосновные крона состава 4Zn0-Cr03-3H20 или ZnCr04-3Zn(0H)i и двойные хроматы цинка и калия состава 4ZnO-3CrOs-K2OX ХЗН20 или 3ZnCr04-Zn(0H)2-K2Cr04-2H20.
Получение. Цинковые крона получают способом осаждения. В качестве сырья используют цинковые белила, бихромат калия или хромовый ангидрид, а также серную или хлороводородную кислоту.
Высокоосновный хромат цинка получают обработкой водной суспензии цинковых белил раствором хромового ангидрида:
4ZnO + Сг03 + ЗН20 — ZnCr04-3Zn(0H)2.
При таком способе синтеза не образуются водорастворимые соли, и поэтому осадок не требует отмывки водой. Выпавший в осадок пигмент отделяют фильтрованием, сушат и измельчают.
Двойной хромат цинка и калия обычно получают обработкой водной суспензии цинковых белил хромовой смесью:
4ZnO + 2К2Сг207 + 2ИСІ + 2Н20 —
— 3ZnCr04-Zn(0H)2-K2Cr04-2H20 + 2КС1.
Вместо хлороводородной кислоты можно использовать серную. Установлено, что основные соли цинка гораздо легче вступают в реакцию с бихроматом калия, чем оксид цинка со смесью растворов бихромата калия и кислоты (хромовой смесью). Поэтому синтез проводят в два этапа: вначале к суспензии цинковых белил прибавляют раствор серной или хлороводородной кислоты для получения основных солей цинка, к которым затем добавляют раствор бихромата калия:
5ZnO + H2S04 + 3H20 — 4Zn(0H)2-ZnS04; 4[4Zn(0H)2-ZnS04] + 10K2Cr207 + H2S04 — — 5[3ZnCr04-Zn(0H)2-K2Cr04-2H20] + 5K2S04 + 2H20.
Основные сульфаты цинка в отличие от основных хлоридов цинка при обработке бихроматом калия не полностью вступают в реакцию, и в кроне остается 2—7% групп S042-. Поэтому предпочтение отдают основным хлоридам цинка, т. е. используют при синтезе хлороводородную кислоту.
В отличие от высокоосновного хромата цинка, полученного из цинковых белил и хромового ангидрида, двойной хромат цинка и калия требует отмывки от водорастворимых солей. При проведении этой операции следует учитывать частичную растворимость крона в воде и поэтому использовать ее в минимальных количествах. Маточный раствор и промывные воды всегда содержат ионы Сг042-, что вызывает необходимость их очистки.
Свойства. Высокоосновный хромат цинка имеет блеклый желтый цвет, большую маслоемкость, малую интенсивность, низкую укрывистость и небольшую светостойкость. Однако он Обладает очень высокими антикоррозионными свойствами. Объясняется это тем, что вода медленно выщелачивает из крона ионы Сг042-, которые оказывают пассивирующее действие на металл.
Двойные хроматы цинка и калия имеют насыщенный ли- монно-желтый цвет. В отличие от высокоосновного хромата этот пигмент обладает очень хорошими пигментными свойствами, причем чем больше в нем групп СгОз, тем лучше характеристики: светлее и насыщеннее цвет, выше укрывистость,. интенсивность и светостойкость, меньше маслоемкость. По пигментным свойствам двойной хромат уступает желтому свинцовому крону, но значительно превосходит его по светостойкости.
Как высокоосновный хромат цинка, так и двойной хромат цинка и калия полностью растворяются в кислотах и щелочах.
Применение. Высокоосновный хромат цинка применяют для изготовления материалов для грунтования легких металлов,, а двойной хромат цинка и калия — для изготовления красок и эмалей разных типов, а также материалов для грунтования черных металлов.
Кадмиевые пигменты
В качестве пигментов желтых, оранжевых и красных цветов; используются сульфиды кадмия и ртути.
Желтые кадмиевые пигменты по химическому составу представляют собой сульфид кадмия CdS или его изоморфную смесь с сульфидом цинка CdS-rcZnS. Меняя соотношения между сульфидами кадмия и цинка, можно получить целую гамму цветов от лимонного до оранжево-желтого.
Желтые кадмиевые пигменты получают термическим (про — калочным) или комбинированным (осадочно-прокалочным) способом. Сырье для получения пигмента должно быть химически чистым, поскольку даже незначительные примеси Ni, Pb, Си, Fe и др. ухудшают цвет пигмента.
Процесс изготовления пигмента прокалочным способом состоит из приготовления и прокаливания шихты, последующей промывки, сушки и измельчения пигмента. Шихту готовят смешением карбоната кадмия с серой и цинковыми белилами в шаровой мельнице. Сера берется в избытке по сравнению с расчетным количеством, так как при последующей термической обработке шихты возможно ее частичное выгорание. Температура термической обработки шихты 500—600 °С. Для предотвращения окисления сульфида кадмия прокалку ведут беа доступа воздуха. Для этой цели применяют муфельные печи. Реакции, происходящие в процессе прокаливания, могут быть представлены следующим образом:
CdC03 CdO + С02;
2CdO+ 3S — 2CdS + S02;
2ZnO + 3S — 2ZnS + S02;
CdS +П ZnS — CdS-nZnS.
Продукт прокаливания отмывают для удаления сульфатов кадмия и цинка, которые образуются в результате окисления сульфидов при прокаливании. Полученный пигмент сушат и измельчают.
При получении желтых кадмиевых пигментов осадочно-про- калочным способом термической обработке (прокаливанию) подвергают осадок, который получают осаждением из растворов сульфата кадмия соединениями серы. В качестве последних чаще всего используют сульфиды натрия и бария и тио— сульфат натрия.
При использовании сульфида натрия и бария осаждение проводится при 70—80 °С при постепенном приливании их растворов к раствору соли кадмия или смеси солей кадмия и цинка:
CdS04 + Na2S — CdS + Na2S04;
CdS04 + BaS — CdS + BaS04.
Полученный осадок отфильтровывают и, не промывая, сушат, а затем прокаливают при 500—600 °С. После прокаливания продукт подвергается «гашению» водой, измельчается в. мельнице мокрого помола, отмывается от водорастворимых солей и сушится. Готовый пигмент измельчают.
Осадочно-прокалочный способ получения желтых кадмиевых пигментов с использованием тиосульфата натрия значительно отличается от описанного выше. При этом методе вначале нагревают кристаллический тиосульфат натрия Na^C^X Х5Н20 при 60—70 °С до полного его растворения в собственной кристаллизационной воде. К полученному раствору добавляют кристаллический сульфат кадмия и цинковые белила. Массу перемешивают некоторое время при 60—80 °С. При этом вода частично испаряется. Полученную таким образом шихту подвергают термической обработке при 500—600°С. Продукт прокаливания отмывают от водорастворимых солей, сушат и измельчают. Реакции, протекающие при описанном выше методе получения пигмента, могут быть представлены следующим образом:
CdS04 + Na2S203 CdS203+ Na2S04;
CdS203 + H20 — CdS + H2S04.
Выделяющаяся серная кислота разлагает тиосульфат натрия с выделением серы и сернистого ангидрида, поэтому необходимо вводить избыток тиосульфата натрия. Кроме того, для нейтрализации серной кислоты вводят соду. Цинковые белила растворяют в серной кислоте с образованием сульфата цинка, который реагирует с тиосульфатом натрия так же, как и сульфат кадмия.
Производство кадмиевых желтых пигментов относится к вредным. Водорастворимые соединения кадмия токсичны. Готовый пигмент менее токсичен из-за своей химической инертности. Однако пыль его очень вредна. Предельно допустимая концентрация кадмия и его соединений в воздухе рабочей зоны составляет 0,2 мг/м3.
Желтые кадмиевые пигменты обладают высокой свето — и. атмосферостойкостью. В отсутствие кислорода воздуха кадмиевые пигменты характеризуются очень высокой термостойкостью, однако в присутствии кислорода воздуха при нагревании выше 300 °С происходит окисление сульфида кадмия с изменением цвета пигмента.
Сульфид кадмия щелочестоек. В разбавленных хлороводородной и серной кислотах он не растворяется; не растворяется также в концентрированных кислотах, в разбавленной азотной кислоте, а также в кипящей разбавленной серной кислоте.
Плотность желтых пигментов 4200—4700 кг/м3, маслоемкость 25—45, укрывистость 30—60 г/м2. Дисперсность зависит от способа получения пигмента. В среднем 50—80% частиц имеют размер менее 1, а 95% — менее 5 мкм. Кроме чистых кадмиевых пигментов промышленностью выпускаются также соосажденные смеси CdS + BaS04, называемые кадмопонами.
Желтые кадмиевые пигменты имеют высокую стоимость и поэтому применяются главным образом в производстве художественных красок. Кроме того, они используются для окрашивания синтетических волокон, пластмасс, а также для изготовления цветного стекла.
Оранжевые и красные кадмиевые пигменты. В отличие от желтых эти пигменты представляют собой твердый раствор сульфида и селенида кадмия CdS-rtCdSe. Цвет и оттенок пигмента зависят от содержания селенида кадмия и меняются от оранжевого до пурпурного с его увеличением.
Получают красные пигменты термическим (прокалочным) и комбинированным (осадочно-прокалочным) способами.
В первом случае из карбоната кадмия, серы и селена готовят шихту тщательным смешением. Прокаливание шихты проводят при 550—580°С:
CdC03 — CdO + С02; Cd + S — CdS;
2CdO + S — 2Cd + S02; Cd + Se — CdSe;
2CdO + Se — 2Cd + Se02; CdS + nCdSe — CdS-nCdSe.
При прокаливании выделяются токсичные газы S02 и Se02. Кроме того, сульфид кадмия частично окисляется кислородом воздуха до сульфата.
Продукт прокаливания подвергают «гашению», отмывают от водорастворимых примесей, сушат и измельчают.
При осадочно-прокалочном методе получения красных кадмиевых пигментов вначале растворяют селен в растворе сульфида натрия или бария при 80—90 °С. Затем этот раствор приливают к раствору водорастворимой соли кадмия, чаще всего сульфата кадмия. Выпавший осадок отмывают от водорастворимых примесей, сушат и подвергают термической обработке при 550—580 °С. После прокаливания продукт вновь отмывают, сушат и измельчают.
Ниже приведены реакции, протекающие при синтезе:
2Na2S + 2Se — Na2S + Na2Se + Se + S;
2CdS04 + Na2S + Na2Se — CdS + CdSe + 2Na2S04;
CdS + nCdSe — CdS-nCdSe.
Производство красных кадмиевых пигментов так же, как и производство желтых, относится к вредным.
Плотность оранжевого кадмия 4500 кг/м3, темно-красного — 5300 кг/м3; укрывистость всех марок высокая — 28—30 г/м2;, маслоемкость 30—60. Размер частиц зависит от способа получения. В среднем пигмент содержит до 40% частиц менее 1 и до 90% — менее 5 мкм.
В уксусной и разбавленных серной и хлороводородной кислотах пигмент не растворяется. В концентрированных кислотах растворяется с выделением токсичных газов H2S и H2Se. Красные кадмиевые пигменты обладают высокой термо-, свето — и атмосферостойкостью.
Так же, как и желтые, красные кадмиевые пигменты могут выпускаться в виде кадмопонов CdS-rtCdSe + BaSO,}.
Красные кадмиевые пигменты, как и желтые, используют в художественных красках, для окраски синтетических волокон и пластических масс, а также для изготовления красных рубиновых стекол.
Прочие желтые, оранжевые и красные пигменты
Кроме рассмотренных выше пигментов желтого, оранжевого и красного цветов промышленность выпускает также и другие. Однако по тем или иным причинам они находят ограниченное применение. Наибольший практический интерес представляют антикоррозионные пигменты: силикохромат и цианид свинца, плюмбат и хромат кальция и др.
 1 ноября, 2012
1 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 