Щелочи и щелочные соли объединяются в одну группу как щелочные вещества, т. е. электролиты, сообщающие водным растворам щелочную реакцию.
Щелочная реакция растворов щелочей (растворимых в воде оснований) объясняется их диссоциацией, например:
NaOH ч >• Na+ + ОН;
Щелочные соли — как правило,— соли сильного основания и слабой кислоты, которые в растворе подвержены гидролизу; в результате гидролиза в растворе накапливается свободная щелочь:
Na2C03 + НОН ч > NaHCQ3 + NaOH
Из щелочей применяют едкий натр и гидрат окиси аммония (нашатырный спирт).
Из числа щелочных солей наиболее важными являются следующие: углекислый натрий (сода), углекислый калий (поташ), силикат натрия, бура и соли фосфорных кислот (гексаметафос — фат, тринатрийфосфат и триполифосфат).
Назначение щелочных веществ заключается в умягчении воды, поддержании определенной концентрации ионов водорода (рН раствора), нейтрализации свободных кислот, содержащихся в загрязненном белье, переводе некоторых загрязнений в растворимое состояние.
Едкий натр (гидрат окиси натрия, каустическая сода)— NaOH, d = 2,13; мол. вес 40.
Технический продукт представляет собой белую твердую непрозрачную массу (температура плавления 320° С) с лучистым изломом, очень гигроскопичную, выделяющую при растворении в воде большое количество тепла. На воздухе NaOH поглощает углекислый газ, превращаясь в карбонат натрия. Сухой продукт и растворы необходимо хранить в закрытом сосуде. Едкий натр хорошо растворим в воде, этиловом и метиловом спиртах.
Гидрат окиси натрия — сильное основание (щелочь), в водном растворе диссоциирует с образованием ионов Na+ и ОН-. Ионами ОН обусловлены все наиболее характерные свойства раствора NaOH: мылкость на ощупь, разъедающее действие на органические вещества, характерные реакции с индикаторами, кислотами, ангидридами и солями металлов, гидраты окислов которых не растворимы в воде. Едкий натр разрушает кожу, ткани, бумагу. Особенно опасно попадание даже малейших количеств NaOH в глаза; все работы с ним должны проводиться в защитных очках и резиновых перчатках.
Основным способом получения едкого натра является электролиз раствора хлористого натрия. При пропускании электрического тока через раствор поваренной соли на аноде выделяется хлор, на катоде разряжаются ионы водорода; одновременно в растворе накапливаются гидроксильные ионы:
На аноде : 2 Cl’— 2? —2 С1 : 2 CI —У С12 ‘ на катоде : 2Н20 + 2ё —H2t + 2 ОН"
В электролитической ванне в результате электролиза остаются ионы натрия и гидроксильные ионы. Побочными продуктами являются хлор и водород. Промышленность выпускает едкий натр в твердом и жидком виде (ГОСТ 2263—59).
Содержание NaOH в твердом продукте достигает: для марки А 95—96%, для марки Б 92%.
Растворы едкого натра содержат от 42 до 50% NaOH.
Большое количество едкого натра расходуется при производстве мыла; растворы едкого натра используются для очистки загрязненного уайт-спирита.
Нашатырный спирт NH4OH. Нашатырным спиртом называют водный раствор аммиака, содержащий до 25% NH3. По составу такой раствор отвечает одноводному гидрату ЫНз-НгО. Молекулярный вес NH3 • Н20 — 35. Концентрированный водный раствор (25%-ный NH3) имеет плотность 0,91.
Бесцветная жидкость, с резким запахом аммиака, окрашивает лакмус в синий цвет, т. е. проявляет щелочные свойства. Щелочная реакция водных растворов аммиака возникает за счет непосредственного захвата ионов водорода молекулами аммиака от молекул воды:
NH3 + Н-ю^^г^ NH4++ ОН-
Как основание (хотя и слабое) водный раствор аммиака вступает во взаимодействие с кислотами, нейтрализуя их, с образованием солей аммония:
NH3 + HC1=NH4C1
Нашатырный спирт получают растворением в воде аммиака, который синтезируют из азота воздуха и водорода. Синтез аммиака возможен только при высокой температуре в присутствии катализатора.
В настоящее время в промышленности процесс ведут при 400° С и давлении чаще всего от 200 до 350 ат; в качестве катализатора применяют губчатое железо с добавками КгО и А1203.
В соответствии с ГОСТ 9—67 промышленность выпускает два сорта водного аммиака: I сорт содержит не менее 25% NH3; II — не менее 22% NH3.
Водный аммиак транспортируют в стеклянных бутылях емкостью до 30 л, помещенных в деревянные обрешетки или ящики.
При высокой концентрации нашатырный спирт снимает окраску, особенно если изделие окрашено кислотными красителями. Поэтому его применяют для частичного удаления первоначальной окраски с шерстяных и полушерстяных тканей. Как щелочь нашатырный спирт используют для нейтрализации текстильных изделий после их обработки растворами кислот, а также для выведения водорастворимых пятен и загрязнений.
Сода кальцинированная (натрий углекислый, карбонат натрия) Na2C03; d = 2,536: Мол. вес 106.
Белый порошок, сравнительно малорастворимый в холодной воде; при нагревании растворимость соды резко возрастает.
Кальцинированная сода —сильный электролит, имеющий щелочную реакцию водного раствора вследствие гидролиза:
Na2C03 + П20 ^=±1 NaHCO.., + NaOH
Сода нейтрализует кислоты:
Na2C03 + 2НС1 =2NaCl + Н20 + С02|
В окислительно-восстановительном отношении сода является индифферентным соединением, не реагирующим ни с окислителями, ни с восстановителями.
В настоящее время соду получают преимущественно по способу Сольвея. Он основан на реакции:
NaCI + NH4HC03 < >" NaHC03 + NH4CI
Равновесие которой смещено вправо, так как NaHC03 сравнительно малорастворим. Практически процесс протекает следующим образом: раствор поваренной соли насыщают аммиаком и углекислым газом. Полученный при этом осадок гидрокарбоната натрия отфильтровывают от другого продукта реакции — хлористого аммония. Схема производства соды показана на рис. 2. Углекислый газ, получаемый в печи 1 обжигом известняка, поступает в карбонизационную башню 2. СаО гасится водой 3, образующийся Са(ОН)2 перекачивается в смеситель 4, где выделяют аммиак из NH4C1.
Поступающий в абсорбер 5 NH3 насыщает там раствор хлористого аммония, который затем перекачивается в карбонизационную башню, где и взаимодействует с углекислым газом, образуя NaHC03 и NH4C1. Гидрокарбонат натрия задержива-
|
|
|
О ss а |
|
2 =t о |
Ется на вакуум-фильтре 6, а хлорид аммония вновь поступает в смеситель 4. Таким образом, потребляются известняк и поваренная соль, а получается NaHC03 и СаС12, являющийся отходом производства. Гидрокарбонат натрия прокаливают (кальцинируют), получая при этом карбонат:
2NaHC03=Na2C03 + Н20 + C02F
В заводской практике выход бикарбоната составляет 68% от теоретического.
В небольшом количестве соду получают насыщением двуокисью углерода (карбонизацией) электролитической щелочи:
NaOH + C02 = NaHC03 2NaHC03 = Na2C03 + H20 + COsf
Техническая кальцинированная сода [10] должна удовлетворять следующим нормам и требованиям (ГОСТ 5100—64).
1. Содержание Ыа2СОз в прокаленном продукте — не менее 99%.
2. Содержание NaHC03 — не более 2,2%.
3. Содержание хлоридов в пересчете на NaCl — не более 0,8%.
Кальцинированную соду упаковывают в многослойные бумажные мешки. Хранить ее необходимо в сухом месте.
Соду применяют для приготовления мыльно-содовых растворов, для умягчения воды, приготовления раствора гипохло — рита натрия, нейтрализации остатков кислот на текстильных изделиях при крашении прямыми красителями, а также в качестве щелочного растворителя для пятен от жиров и масел при обработке в водной среде.
Сама по себе сода не является эффективным моющим агентом, но создаваемая ею щелочная реакция раствора благоприятно влияет на моющий процесс хлопчатобумажных и льняных тканей. Сода способствует уменьшению гидролиза моющего средства, но в жесткой воде взаимодействует с солями кальция и магния с образованием нерастворимых карбонатов, которые отлагаются на ткани в виде осадка, что способствует посерению
Ткани и снижению ее физико-гигиенических свойств. Поэтому ее рекомендуется применять в сочетании с триполифосфатом.
Поташ (карбонат калия, углекислый калий) К2СО3; d = 2,418; мол. вес. 138.
Белый мелкокристаллический порошок, гигроскопичный на воздухе, легко растворяется в воде: при 20° С в 100 г воды растворяется 111,7 г поташа, а при 100° С — около 156 г.
По химическим свойствам К2СО3 напоминает соду. Водный раствор К2СО3 имеет щелочную реакцию вследствие гидролиза:
Под действием кислот поташ выделяет углекислый газ: К2со3 + H2S04 =K2S04 + н2о + Co2I
В течение длительного времени поташ получали из золы растений (например, подсолнечника, содержащего до 50% углекислого калия), выщелачивая ее водой и вымаривая затем полученный раствор.
В настоящее время поташ получают насыщением двуокисью углерода (карбонизацией) раствора едкого кали, образующегося при электролизе хлористого калия:
Кон + СОг = КНСО3 КНСОз + КОН =К2СОз + н2о
По способу получения соды по Сольвею поташ получить нельзя, так как гидрокарбонат калия КНС03 растворяется в воде значительно легче, чем гидрокарбонат натрия (36,1 г на 100 г воды при комнатной температуре).
При формиатном способе получения поташа смесь сульфата калия и известкового молока насыщают окисью углерода. Процесс ведут при температуре 220° С и давлении 30 ат:
JD
К2S04 + Са(ОН)2 + 2СО = CaS04 —F 2Н—С
^ОК
Формиат калия
Сернокислый кальций отделяют, а формиат упаривают и подвергают окислительному кальцинированию:
2КНСОг + 02 =К2С03 + С02| + Н20
В соответствии с ГОСТ 10690—63 промышленность выпускает кальцинированный и полутораводный поташ двух сортов.
Содержание К2СО3 в полутароводном поташе I сорта 97,5%, во II — 92,5%, а в кальцинированном I сорта 98%, а во II — 93%.
Поташ упаковывают в многослойные бумажные битумиро — ванные мешки или мешки из пластиковой пленки и хранят в сухом помещении.
Поташ применяют при изготовлении калиевого мыла, для удаления жирных пятен, пятен масляных красок, а также «за — красов», образующихся при мокрой обработке текстильных изделий.
Соли фосфорных кислот. Большое значение при водоумягче — нии и в производстве синтетических моющих порошков имеют соли различных кислот фосфора.
Обычная фосфорная (ортофосфорная) кислота Н3Р04 образует средние и кислые соли, называемые соответственно фосфатами и гидрофосфатами
Na3P04 — фосфат натрия, средняя соль ЫагНР04 — моногидрофосфат натрия ) NaH2P04 — дигидрофосфат натрия } кислые соли
От ортофосфорной кислоты путем частичного отщепления воды (конденсация) производятся различные конденсированные фосфорные кислоты. Важнейшими из конденсированных кислот являются пирофосфорная кислота ГЦРгО? и метафосфорные кислоты, имеющие аналитический состав НР03. Однако метафосфорные кислоты и их соли полимерны, например, состав гекса — метафосфата отвечает формуле (NaP03b
Н3РО4 и Н4Р207 — первые члены ряда полифосфорных кислот, имеющих общую формулу H„+2P„03„+i, например, Н5Р30ю (п = 3, трифосфорная кислота), H6p40i3 (я = 4, тетрафосфорная кислота).
Структурная формула полифосфорных кислот следующая:
TOC o "1-3" h z <.) о О О
II li II II НО—Р —О—р—О —Р—О-Р—ОН
II II
ОН ОН ОН ОН
Из солей фосфорных кислот наибольшее значение имеют тринатрийфосфат, гексаметафосфат и триполифосфат.
Тринатрийфосфат (фосфат натрия, трехзаме — щенный фосфорнокислый натрий, тринатр, фос — нор) Na3P04- 12Н20; d = 1,62, мол. вес. 380.
Белая или окрашенная в желтый или розовый цвет масса, легко слеживающаяся в монолит, хорошо растворяется в воде (растворимость в 100 г воды при 20° С составляет 25,8 г, а при 70° С — 157 г тринатрийфосфата).
Водный раствор тринатрийфосфата имеет щелочную реакцию из-за гидролиза, протекающего по уравнениям:
Na3P04 + Н20 <—Na2HP04 + NaOH
Na2HP04 + Н20‘ч > NaH2P04 + NaOH
NaH2P04 + Н2Оч H3P04 + NaOH
Получение тринатрийфосфата в промышленности основано на нейтрализации фосфорной кислоты последовательно содой и едким натром:
1.Н3Р04 + Na2C03 = Na2HP04 + С02 + Н20
2. Na2HP04 + NaOH =Na3P04 + Н20
Так как третий атом водорода в кислоте не может быть замещен взаимодействием с кальцинированной содой, то производство тринатрийфосфата осуществляется в две стадии. Выделение тринатрийфосфата из слабых растворов производят в кристаллизаторах с последующим центрифугированием или путем упаривания до такой концентрации, при которой раствор после охлаждения полностью затвердевает. В соответствии с ГОСТ 201—58 технический продукт должен содержать не менее 23,7% тринатрийфосфата в пересчете на Р04.
Тринатрийфосфат упаковывают в сухотарные бочки до 250 кг Или в многослойные бумажные мешки по 35—45 кг.
Его применяют в процессах стирки для водоумягчения и создания высокой щелочности. Тринатрийфосфат в отличие от гексаметафосфата и триполифосфата — некомплексообразую — щий препарат.
Как и сода, тринатрийфосфат образует труднорастворимые осадки с ионами Са++ и Mg++, обусловливающими жесткость воды. Присутствие этих осадков несколько ухудшает качество стирки.
Гексаметафосфат натрия (соль Грэма, кал — гон, гексаметафосфорнокислый натрий) (NaP03)e или Na2{Na4(P03)6]; d = 2,48, мол. вес. 612.
Стекловидная масса в виде кусков, бесцветных или слегка окрашенных в желтый или зеленоватый цвет, гигроскопичен, хорошо растворяется в воде.
Гексаметафосфат в водных растворах проявляет нейтральные или слабокислые свойства. Гидролиз его протекает по следующим уравнениям:
3(NaP03)e + 12 Но О Ч >"2(NaPQ3)3 + 12NuH2P0,,
Триметафоссрат
____ . натрий
(NaP03)3 + Н20^=±: Na3H2P3Ojo
Na3H2P3O10 + 2Н20 < >-3NaH2PQ4
Таким образом, продуктом гидролиза является дигидрофос — фат натрия.
Гексаметафосфат натрия связывает в комплекс ионы Са++ и Mg++, в результате чего происходит умягчение воды:
Na2[Na4(P03)6] + Са2+—— >■ Na2 [Na2Ca(P03)6] + 2Na+
Na2[Na4(P03)6]+ 2Саг+——- >-Na2 [Ca2(P03)6] + 4Na+
По той же схеме растворяются карбонаты:
Na2 [На4(Р03)6] + СаСОэ—- ► Na2[Na2Ca(P03)6] + Na2C03
А кальциевые мыла превращаются в натриевые мыла, обладающие моющим действием:
R—СОО
/Са + Na2[Na4(P03)6]—►2RCOONa+ Na2[Na2Ca(P03)6J
R—COO
Аналогично связываются гексаметафосфатом соли тяжелых металлов (например, железа и меди).
Гексаметафосфат получают при нагревании до 700° С диги — дрофосфата натрия в подовой или муфельной печи и быстром
5 Заказ № 2217 113 Охлаждении расплава; сначала образуется кислый пирофосфор- нокислый натрий:
2NaH2P04—— >-Na2H2P2Q7 + Н20
Который затем переходит в метафосфат:
Na2H2P207——- ► 2NaP03 + Н20
А метафосфат полимеризуется в гексаметафосфат:
6 N;iP03——- >- (NaP03)6
Полученный гексаметафосфат упаковывают в фанерные ящики по 45—50 кг, выстланные бумагой и пергаментом (МРТУ 6-08-5—64).
Гексаметафосфат необходимо хранить в сухом месте.
Гексаметафосфат натрия применяют для умягчения воды при стирке цветного белья, так как по сравнению с другими водоумягчителями он обладает самой низкой щелочностью. Преимуществом гексаметафосфата натрия является то, что он растворяет осадки карбонатов и кальциевых мыл. Однако ввиду сильной гидролитической расщепляемости (особенно при нагревании в щелочной среде) и гигроскопичности гексаметафосфат не может быть введен в состав синтетических моющих порошков.
Концентрированные растворы гексаметафосфата корродируют металлы; хранить такие растворы допускается лишь в деревянной, полиэтиленовой или эмалированной посуде.
Триполифосфат натрия Na5P3Oi0 или Na[Na4(P3Oi0)]; d = 2,5; мол. вес. 368.
Белый порошок с температурой плавления 820° С. Гигроскопичность и гидролитическая расщепляемость его значительно меньше, чем у гексаметафосфата. Структурную формулу три — полифосфата можно изобразить следующим образом:
0
N а—О— р—- О— Р—- О—Р—- О—Na
1 I I
ONa ONa ONa
Растворимость триполифосфата в воде при температуре
20°С составляет 14,5 г, при 100°С —32,5 г, рН 1%-ного раствора 9,7.
В результате гидролиза триполифосфата (протекающего по сложной схеме) образуются орто — и пирофосфаты.
В качестве водоумягчающего средства он несколько уступает гексаметафосфату.
Триполифосфат обладает меньшей способностью образовывать комплексные соединения с солями жесткости воды (в основном, с кальцием).
Реакция протекает по уравнению:
Na5P3O10 + Са2+ Na3 [са(Р3О10)] + 2 Na +
С солями тяжелых металлов триполифосфат образует осадки, растворяющиеся в избытке триполифосфата.
При повышенных концентрациях триполифосфат повышает антиресорбционную способность моющих веществ.
В промышленности триполифосфат получают нагреванием смеси моно — и дигидрофосфатов натрия:
NaH, PO„ + 2 Na5HPO, —V Na5P3O10 + 2 Н20
Технический триполифосфат (СТУ 27—502—64) содержит некоторое количество примесей ортофосфатов и сульфата натрия и выпускается двух сортов с содержанием Na5P3Oio 90 и 88%. Содержание Р205 в техническом продукте должно быть не менее 54—56%.
Триполифосфат входит в состав синтетических моющих порошков. Например, препарат «Новость» для стирки шерстяных и шелковых изделий содержит 2,5% триполифосфата. В стиральных порошках для стирки хлопчатобумажных и льняных тканей содержится 20—25% триполифосфата. Триполифосфат выполняет следующие функции:
1) устраняет жесткость воды, растворяет карбонаты кальция и магния, а также кальциевые мыла, ионы железа связывает в комплекс;
2) суспендирует и пептизирует пигменты, благодаря чему загрязнение удерживается в тонкодисперсной форме и не оседает на волокно;
3) придает щелочную реакцию моющему раствору.
Силикат натрия (кремнекислый натрий, растворимое стекло,
Метасиликат натрия) Na2Si03; d = 2,614; мол. вес 192, Тпл 1089° С.
Твердый силикат натрия имеет вид стекловидной массы слегка зеленоватого цвета (от примесей железа). Водный раствор силиката натрия называется жидким стеклом.
Формула Na2SiC>3 не отображает истинного состава растворимого стекла, поступающего в продажу, и приписывается ему чисто условно. В действительности силикат натрия имеет переменный состав, выражаемый формулой nNasO-mSiC^. Растворимым стеклом называются такие силикаты натрия, в которых численное отношение атомов Si: Na не превышает 4.
Силикат натрия как соль слабой кислоты и сильного основания показывает в водных растворах щелочную реакцию. При этом гидролиз сопровождается выделением поликремневых кислот[11], в частности диметакремневой кислоты:
2Na2Si03 + Н20 Na2Si205 + 2 NaOH
При действии соляной или серной кислот на раствор силиката натрия получается свободная метакремневая кислота, образующая студнеобразный осадок:
N А2 Si 03 + 2HCI= j H2Si03 + 2 NaCI
С солями кальция и тяжелых металлов силикат натрия вступает в реакцию двойного обмена, например:
Na2Si03 + CaCl5=CaSi03 j + 2 NaCl
Растворы силиката натрия неустойчивы и с течением времени выделяют хлопья кремневой кислоты или застудневают целиком.
Все сорта растворимого стекла можно разделить на три группы. К первой группе относятся твердые растворимые стекла, получаемые путем сплавления кремнезема с содой или сульфатом натрия и выпускаемые обычно в виде кусков, напоминающих обыкновенное стекло, или в виде порошка. Такое стекло совершенно не содержит воды, трудно растворяется и носит название силикат-глыбы. Вторую группу составляют твердые сорта растворимого стекла, содержащие некоторое количество воды.
Такой продукт называется гидратированным стеклом и хорошо растворяется в воде.
К третьей группе относятся растворы жидкого стекла различной концентрации. Это обычно густые вязкие жидкости.
В зависимости от исходных материалов, применяемых для приготовления силикат-глыбы, ее выпускают трех видов (ГОСТ 917—41).
1. Содовая, получаемая сплавлением кремнезема с содой при температуре 1300—1500° С:
Na2C03 + Si02 = Na2SiQj + С.02
2. Содово-сульфатная (сплавляют кремнезем с содой и сульфатом натрия).
2 Na2C03 + 2 Na2S04 + 4 Si02 + С=4 Na2Si03 + 3 С02 + 2 SO,,
3. Сульфатная, получаемая сплавлением кремнезема с сульфатом натрия и углем в качестве восстановителя:
2 Na2S04 + 2 Si02 + С = 2 Na, Si03 + С02 + 2 SOz
Другой способ получения силиката натрия заключается в растворении кремнезема в едкой щелочи:
2 NaOH + Si02=Na2Si03 + Н20
Процесс проводят в автоклаве под давлением.
Промышленностью выпускается силикат-глыба (твердый аморфный сплав растворимого стекла) и водный раствор силикат-глыбы, называемый жидким стеклом.
Содержание воды в жидком стекле (ГОСТ 962—41) находится в пределах 57—60%.
Состав силиката натрия характеризуется модулем, под которым подразумевается отношение числа грамм-молекул окиси кремния к числу грамм-молекул окиси натрия в процентах, рассчитываемое по следующей формуле:
М= А.1 032,
Б
Где А — процентное содержание S1O2;
Б — процентное содержание Na20;
1,032 — отношение молекулярного веса Na20 к молекулярному весу Si02
Модуль силиката натрия должен находиться в пределах 2,63—3,00.
В соответствии с ГОСТ 917—41 силикат-глыбы перевозят в железнодорожных вагонах навалом или в плотной деревянной таре с указанием завода-изготовителя, вида силикат-глыбы, химического состава и модуля.
Жидкое стекло упаковывают в деревянные или железные бочки, которые должны храниться в крытых помещениях.
Силикат натрия применяют для умягчения воды при мокрой чистке хлопчатобумажных и льняных тканей. Силикат натрия входит в состав синтетических моющих средств (от 5 до 10%) как электролит, придающий щелочность; улучшает сыпучесть синтетических моющих порошков. Силикат натрия предотвращает коррозию металлов (особенно алюминия), связывает ионы железа, имеющиеся в воде, что способствует получению более высокой белизны ткани, используется для стирки спецодежды.
Бура (тетраборат натрия, тетраборнокислый натрий) Na2B407 • ЮН20; d = 1,7; мол. вес. кристаллогидрата 381; Гпл 740° С.
Бура образует большие бесцветные прозрачные кристаллы, которые в сухом воздухе выветриваются с поверхности и мутнеют. При нагревании до 350—400° С бура полностью теряет кристаллизационную воду. Бура растворяется в абсолютном спирте и глицерине. Растворимость ее в воде невелика, но с увеличением температуры резко возрастает: при 90° С в 100 г воды растворяется 5 г буры, а при 100° С — 201 г.
Водный раствор буры имеет слабощелочную реакцию (рН для 0,1 н. раствора 9,3) из-за гидролиза, протекающего по уравнению: ,
Na, B407 + ЗН20 2 NaOH -I — 4 НВ02
Бура является солью тетраборной кислоты, которая в свободном виде не выделена. Поэтому при взаимодействии буры с сильными кислотами получается ортоборная кислота:
N А3В,07 + H2SO„ + 5H20=Na, S04 + 4 II3BO3
Характерной особенностью расплавленной буры является способность растворять окислы различных металлов с образованием двойных солей метаборной кислоты НВ02.
Na2B40, + С0О=Со(ВО2)2 • 2NaB02
Получающиеся метабораты образуют «перлы», окрашенные в цвет, характерный для иона данного металла (зеленый для хрома, голубоватый для кобальта и т. д.).
В лабораторных условиях буру можно получить, действуя на борную кислоту едким натром:
4 Н3В03 + 2Na0H=Na, B407 + 7 Н20
В промышленных масштабах в СССР буру получают при взаимодействии борной кислоты с содой:
4 Н3ВО3 + Na2C03— Na2B407 + C02 + 6 НаО
После отделения шлама на фильтре и охлаждения из раствора выкристаллизовывается бура; ее отделяют на центрифуге и промывают.
Бура выпускается двух сортов (ГОСТ 8429—57): техническая -— 49,5%-ная и пищевая — 51,5%-ная. Пищевую буру получают перекристаллизацией технической буры.
Для транспортировки буру упаковывают в многослойные бумажные мешки; хранят в сухих крытых помещениях.
Буру применяют в качестве слабой щелочи, а также для жесткого крахмаления мужских верхних сорочек.
 19 ноября, 2012
19 ноября, 2012  admin
admin 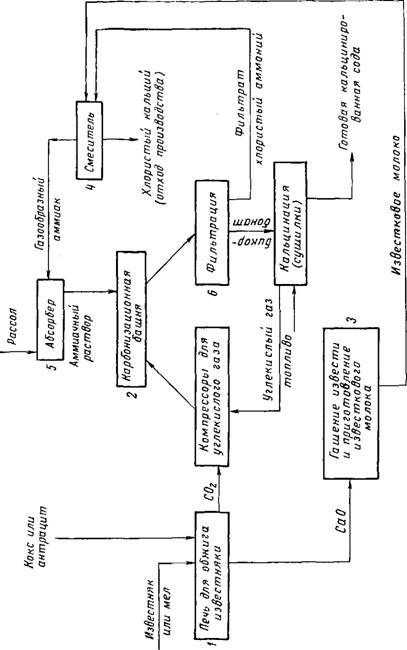
 Опубликовано в рубрике
Опубликовано в рубрике 