Молекулы высокомолекулярных веществ могут быть линейными и разветвленными, причем длина молекулярных цепей может быть сравнительно большой — превышать 1 мкм. Именно линейной формой макромолекул определяются типичные свойства полимеров; каучукоподобная эластичность, способность образовывать прочные пленки и нити, набухать, давать при растворении вязкие растворы и т. д.
Кроме цепных молекул, в определенных технологических условиях или в результате специальной обработки могут быть получены полимеры с пространственной структурой. Конечно, понятие молекулы у трехмерных полимеров теряет смысл, так как пространственные сетки могут достигать весьма больших размеров. Типичным примером полимера с пространственной структурой может служить вулканизованный каучук, состоящий из каучуковых молекул, «сшитых» друг с другом серными мостикадеи,
Ниже рассмотрены свойства цепных макромолекул, так как растворы, содержащие такие. молекулы, представляют наибольший интерес для теории и практики. Полимеры с пространственной структурой не способны растворяться, поэтому свойства молекулярных сеток в нашем курсе не рассматриваются.
Гибкость линейных макромолекул
Еще не так давно некоторые ученые считали линейные макромолекулы жесткими. Однако опыт последних десятилетий показал, что в большинстве случаев линейные макромолекулы обладают гибкостью.
Чтобы понять причину гибкости линейных макромолекул, рассмотрим строение молекулы этана. Ее можно представить как две группы —СН3, соединенные одинарной связью. Из органической химии известно, что группы —СН3 в молекуле этана способны вращаться вокруг одинарной связи С—С. Это хорошо согласуется с тем, что, например, ^симметричный дихлорэтан не имеет изомеров. Однако при низких температурах свободное вращение вокруг связи С—С затруднено, так как не все возможные положения групп —СН3 относительно друг друга равноценны в энергетическом отношении. Такая неравноценность обусловлена тем, что при повороте одной группы —СНз по отношению к другой изменяются расстояния между атомами водорода обеих групп. Это ведет к изменению энергии взаимодействия между группами —СН3. Поэтому при низких температурах —СН3-группы не вращаются вокруг оси С—С, а лишь вращательно колеблются на сравнительно небольшой угол. Только при достаточно высокой температуре благодаря увеличению кинетической энергии может быть преодолен энергетический барьер и группы —СН3 будут свободно вращаться вокруг соединяющей их связи.
Высота потенциального барьера вращения, естественно, тем больше, чем больше разность максимального и минимального значений энергии взаимодействия атомов или групп атомов при их вращении относительно друг друга. Понятно также, что свободное вращение затруднено тем больше, чем больше по размеру атомы, связанные с углеродными атомами. Опыт показал, что даже когда углеродные атомы связаны со сравнительно малыми атомами водорода, свободное вращение вокруг связи С—С требует энергии активации порядка 3000 кал/моль.
Следует заметить, что вращение возможно, если атомы углерода соединены одинарной связью. Вращение групп =СН2 или = СН (например, в молекуле этилена или ацетилена), т. е. вращение вокруг двойной или тройной связи, невозможно. Вместе с тем наличие двойной связи в углеводородной цепи благоприятно влияет на подвижность смежных с этой связью атомов или групп, соединенных одинарной связью. Так, в группе —СНг—СН=СН— потенциальный барьер, отвечающий вращению вокруг связи
СН2—СН, на 500 кал/моль ниже энергетического барьера вращения вокруг связи СН2—СН2.
Перейдем теперь к рассмотрению какой-нибудь линейной макромолекулы, например цепочки насыщенного углеводорода. Хорошо известно, что такая цепочка, состоящая из связанных одинарной валентностью атомов углерода и присоединенных к каждому из них двух атомов водорода, расположена не в плоскости, а в пространстве и имеет в идеальном случае зигзагообразную форму. При этом угол между каждыми тремя соседними атомами углерода имеет постоянное значение, равное 109°28′, и для изменения его требуется значительная затрата энергии. Строение цепочки насыщенного углеводорода схематически изображено на рис. XIV, 3.
Гибкость углеводородной цепочки, как показали Кун, Марк и Гут, обусловливается в основном вращением одних участков цепи относительно других вокруг оди — Рис. XIV, 3. Строение линейной углеводо— нарной валентной связи, со — родной цепи. единяющей соседние атомы
Углерода. Так как таких отдельных связей в макромолекуле множество, то становится понятной та исключительная гибкость, которой обладают углеводородные цепочки.
Кун, Марк и Гуг в первом приближении полагали, что вращение вокруг связей С—С в макромолекуле может происходить совершенно свободно, и считали углеводородные молекулы весьма гибкими нитями, которые могут принимать любую форму, совместимую с постоянством валентного угла. Однако Я. И. Френкель и С. Я — Бреслер показали, что и в этом случае, как и для молекулы этана, необходима некоторая энергия активации, т. е. необходимо преодолеть энергетический барьер, зависящий от природы атомов, из которых построена цепь. Иными словами, вращение вокруг связи С—С возможно только при достаточно высоких температурах. Такая зависимость свободы вращения от температуры становится понятной из следующих рассуждений.
|
|
С повышением температуры возрастает энергия теплового движения, равная, как известно, для каждой частицы в среднем произведению kT (где k— постоянная Больцмана, Т—абсолютная температура). Пока величина kT значительно меньше энергетического барьера, группы атомов только вращательно колеблются около положения равновесия. С возрастанием температуры амплитуда этих колебаний увеличивается и, когда значение kT становится соизмеримым со значением энергетического барьера, начинается вращение и молекулы приобретают гибкость. Естественно, что при понижении температуры наблюдается обратное явление—•
свободное вращение вокруг одинарной связи становится невозможным и молекула теряет гибкость.
Если при вращении вокруг связи С—С молекула может принимать не одно, а несколько положений равновесия, то полимер в каждом из таких положений по существу представляет собой отдельный изомер. Такие изомеры М. В. Волькенштейн назвал поворотными изомерами. Очевидно, обычные полимеры являются смесями поворотных изомеров. Поворотные изомеры отличаются от цис — и транс-изомеров тем, что энергетический барьер у них сравнительно невысок и они легко переходят друг в друга.
Мы рассматривали линейную макромолекулу как растянутую зигзагообразную цепочку. Такая форма отвечает наименьшей потенциальной энергии молекулы, и при очень низких температурах линейные макромолекулы стремятся принять эту форму. Вытянутая форма молекулярных цепочек способствует их ориентации, обеспечивает возможность компактной упаковки; именно этим и объясняется способность полимеров, состоящих из линейных макромолекул, кристаллизоваться при растяжении. С повышением температуры, вследствие увеличения гибкости макромолекул, возрастания интенсивности теплового движения отдельных звеньев И благодаря толчкам, получаемым от соседних молекул, линейные макромолекулы могут свертываться и образовывать клубки. Поскольку предельно вытянутое состояние линейной макромолекулы может быть лишь одним, а конформаций [32], которые может принимать макромолекула при свертывании, очень много, то естественно, что при достаточно высоких температурах все гибкие молекулы полимера будут представлять собой клубки. При этом состоянии энтропия полимерной системы максимальна, благодаря чему клуб — кообразное состояние гибких макромолекул при достаточно высоких температурах отвечает и минимуму свободной энергии.
Следует отметить, что цепные макромолекулы с ограниченным вращением звеньев часто представляют как цепи, состоящие из жестких участков, способных совершать тепловое движение как бы независимо друг от друга. Такое движение принято называть микроброуновским, а принимающие в нем участие отрезки цепи — сегментами. Под длиной сегмента, согласно В. А. Картину и Г. J1. Слонимскому, следует понимать значение молекулярного веса, которое должны были бы иметь молекулы полимера для того, чтобы полимер или его раствор подчинялись обычным для низкомолекулярных веществ закономерностям. Таким образом, сегмент является всего лишь эквивалентной величиной, позволяющей описывать поведение реальных полимерных систем при помощи хорошо известных закономерностей, свойственных идеальным системам.
Длиной сегмента часто приходится пользоваться при изучении физических свойств полимера или его раствора. Если эти свойства независимы друг от друга, то и сегменты могут не совпадать друг с другом. Так, длина сегмента, вычисленная по данным вискозиметрии, обычно не совпадает с длиной сегмента, найденной на основании осмометрических измерений. Поэтому, говоря о длине сегмента, всегда следует указывать, к какому свойству относится эта величина.
Понятно, что чем гибче молекула, тем меньше должен быть ее сегмент. Как правило, сегмент гибких молекул представляет собой отрезок цепи, состоящий из 20—30 атомов элемента, образующего главную цепь. У макромолекул, содержащих полярные группы, сегмент значительно больше."" У весьма жестких молекул размер молекулы и длина сегмента совпадают. Поскольку гибкость молекул зависит от температуры, то, понятно, что с увеличением _тем — пературы длина сегмента должна уменьшаться. Длина сегмента зависит также от времени воздействия внешней силы. Так как релаксационный переход молекулы от одной конформации к другой требует определенного времени, то при быстрых внешних воздействиях на молекулу часть конформаций не может осуществиться и конформационный набор обедняется. Это приводит к увеличению жесткости макромолекулы и возрастанию длины сегмента.
Из сказанного следует, что сегмент, несмотря на условность, является весьма показательной характеристикой гибкости цепи в данных конкретных условиях.
Выше мы рассматривали линейную макромолекулу независимо от остальных молекул вещества. Однако реальные макромолекулы всегда находятся в конденсированной фазе, т. е. окружены другими макромолекулами. Поэтому при рассмотрении поведения молекулы необходимо учитывать как взаимодействие между входящими в молекулу группами атомов, так и взаимодействие между этими группами и атомными группами соседних молекул. Таким образом, свобода вращения вокруг связи С—С зависит не только от расположения атомных групп в молекуле, но определяется и близлежащими атомными группами других молекул. Иначе, вследствие межмолекулярных взаимодействий возможность изменения формы цепных макромолекул определяется не только самой молекулой, но и соседними молекулами.
Рассмотрим теперь связь гибкости макромолекул с их химической природой. Наиболее гибкими линейными макромолекулами являются цепочки углеводородов, так как из-за незначительного взаимодействия —СН2— или —СН3-групп между собой энергетический барьер свободного вращения невелик. К таким высокомолекулярным углеводородам принадлежат натуральный каучук, по — либутадиен (бутадиеновый синтетический каучук), полиизобути — лен [33].
Наличие в макромолекуле полярных заместителей, например —С1, —ОН, —CN, —СООН, делает молекулу менее гибкой, так как взаимодействие между этими заместителями повышает энергетический барьер. Кроме того, полярные заместители обусловливают увеличение взаимодействия с полярными группами соседних молекул. Между этими группами, являющимися диполями, могут возникать как значительные межмолекулярные силы (например, в поливинилхлориде между атомами хлора), так и водородная связь, если имеются соответствующие условия (например, в полимерах акриловой кислоты между карбоксильными группами). Все это приводит к уменьшению гибкости цепи и повышает жесткость полимеров. К полимерам с цепями ограниченной гибкости (из-за содержания в них полярных групп) можно отнести целлюлозу, поливинилхлорид, полиакрилонитрил и т. д.
Разветвление у макромолекул также сильно влияет на их гибкость. Короткие и часто расположенные боковые цепи увеличивают жесткость макромолекул вследствие возрастания энергетического барьера вращения отдельных звеньев. Более редкие, но более длинные разветвления способствуют уменьшению межмолекулярных взаимодействий и обусловливают «разрыхление» высокомолекулярного вещества. Очевидно, при увеличении длины боковой углеводородной цепи выше оптимальной стерические затруднения начинают перекрывать эффект снижения молекулярных сил притяжения.
Существенно, что на гибкость макромолекулы могут влиять не только соседние молекулы того же полимера, но и молекулы растворителя или пластификатора (например, в растворах или пластифицированных полимерах). При этом наличие растворителя между молекулами полимера может приводить, не только к уменьшению энергетического барьера из-за понижения вязкости системы и экранирования полярных групп макромолекул, но и к увеличению энергетического барьера в результате своеобразной «адсорбции» молекул растворителя на макромолекулах, что, конечно, препятствует свободе вращения вокруг связи С—С. Короче говоря, следует помнить, что при растворении в зависимости от условий цепи полимера могут становиться как более гибкими, так и более жесткими.
Фазовые состояния высокомолекулярных веществ
Как известно, вещества могут находиться в трех фазовых состояниях — газообразном, жидком и кристаллическом. Критерием того, что данное вещество находится в том или ином фазовом состоянии, служат не внешние признаки, а степень упорядоченности ионов или молекул, из которых состоит вещество. Газообразное состояние является наиболее беспорядочным фазовым состоянием. В кристаллическом состоянии, наоборот, вещество имеет наиболее упорядоченную структуру; в этом случае наблюдается дальний порядок, т. е. в кристалле на всем его протяжении повторяется в определенном порядке один и тот же структурный элемент. Жидкое состояние занимает среднее положение, в нем отсутствует дальний порядок, но наблюдается ближний порядок, т. е. упорядочение структурных элементов в отдельных участках жидкости.
В результате многочисленных исследований структуры высокомолекулярных веществ установлено, что твердые высокомолекулярные вещества могут находиться как в жидком, так и в кристаллическом фазовом состоянии, К числу высокомолекулярных веществ, имеющих аморфную жидкую структуру при обычной (комнатной) температуре, следует отнести большинство высокомолекулярных веществ, в частности эфиры целлюлозы, натуральный и большинство синтетических каучуков, поли-изо-бутилен и другие продукты. Кристаллическими полимерами в этих же условиях являются полиамиды, полиэтилен.
Еще не так давно принимали, что в аморфном состоянии полимеры представляют собой систему хаотически перепутанных макромолекул. Однако работы последних десятилетий показали, что на самом деле уже в аморфном состоянии в полимерах наблюдается некоторая структурная упорядоченность. Эта упорядоченность, естественно, резко возрастает при кристаллизации. Согласно В. А. Каргину и Г. Л. Слонимскому, в аморфных прлимерных веществах точно так же, как и в обычных жидкостях, имеются области ближнего порядка, в которых молекулы ориентированы параллельно друг другу, образуя достаточной длины пучки, или пачки. Существование таких пачек ни в коей мере не противоречит высокой эластичности полимеров, так как макромолекулы могут принимать различные конформации и тогда, когда они образуют пачки. Молекулы могут различно располагаться в пачках, да и сами пачки могут принимать самую разнообразную форму.
В свою очередь пачки в полимерах могут образовывать более сложные структуры, вплоть до хорошо видимых в микроскоп кристаллов и сферолитов. Таким образом, очень часто полимеры, особенно с жесткими и стереоспецифиче — скими молекулами, не имеют той простой структуры, которую им приписывали ранее, а представляют собой весьма сложные системы, содержащие как отдельные молекулы, так и надмолекулярные структуры различной степени сложности. Понятно, что при растворении полимеров в зависимости от природы растворителя и условий растворения в раствор могут переходить как отдельные молекулы, так и целые фрагменты надмолекулярной структуры.
 1 ноября, 2012
1 ноября, 2012  admin
admin 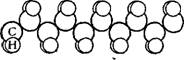
 Опубликовано в рубрике
Опубликовано в рубрике 