Конденсационный метод. Обычно считается, что образование коллоидных систем в результате конденсации является не чем иным, как процессом кристаллизации, а образовавшиеся частицы представляют собой мельчайшие кристаллики. Таких взглядов придерживался, наприм’ер, русский ученый П. П. Веймарн, один из первых исследователей, детально изучавших конденсационные методы образования лиозолей.
Образование обычных кристалликов протекает в две стадии:
1) возникновение зародышей (центров кристаллизации) в пересыщенном растворе, причем пересыщение может быть вызвано химической реакцией, приводящей к получению малорастворимого соединения, уменьшением растворимости соединения при замене лучшего растворителя худшим, охлаждением раствора и другими причинами;
2) рост зародышей, что приводит к образованию достаточно крупных кристаллов.
Долгое время принимали, что образование зародышей происходит самопроизвольно (спонтанно). Такую точку зрения развивал Тамман. Он считал, что в некоторых участках пересыщенного раствора, находящегося в метастабильном состоянии, молекулы или ионы растворенного вещества сами по себе без участия каких-нибудь посторонних взвешенных частиц могут располагаться в кристаллическом порядке, образуя мельчайшие зародыши, способные к дальнейшему росту.
Согласно этой точке зрения скорость образования зародышей Ti пропорциональна относительному пересыщению и может быть выражена уравнением:
Сп~Ся (VIII, 1)
СВ
Где K — коэффициент пропорциональности; си — концентрация пересыщенного раствора; Си— концентрация насыщенного раствора (обычная растворимость вещества).
Разность сп — сн представляет собой избыток вещества, способного образовывать кристаллы, и, следовательно, в известной степени может служить мерой скорости выделения вещества из раствора. Величина сн характеризует взаимодействие растворенного вещества с растворителем и, таким образом, -является мерой сопротивления выделению вещества из раствора. Считают, что Чем Больше разность сп — сн и меньше величина сн, тем скорее образуются зародыши, тем больше возникает центров кристаллизации и тем меньше по размеру окажутся коллоидные частицы, так как все количество способного выделиться вещества распределится между большим числом образовавшихся центров кристаллизации.
Однако уже довольно скоро было экспериментально установлено, что зародыши кристаллизации образуются, как правило, не путем удачного столкновения молекул или ионов в растворе вследствие флуктуаций концентрации, а в результате осаждения растворенного вещества на чужеродных мельчайших пылинках, случайно оказавшихся в системе. Например, было найдено, что в растворах, тщательно очищенных от посторонних взвешенных частиц, в течение долгого времени даже при значительном пересыщении не образуется кристаллов. Наоборот, при введении в такие растворы чужеродных зародышей или кристаллов растворенного вещества в них немедленно начиналась кристаллизация. Все это привело к тому, что стали считать вероятным образование зародышей (кристаллизационных центров) на уже готовых поверхностях раздела,
Теория образования новой дисперсной фазы зародилась в исследованиях Гиббса (1878 г.) по термодинамике поверхностных явлений и получила развитие в двадцатых годах нашего столетия (школа Фольмера) в экспериментальных и теоретических исследованиях конденсации пересыщенного пара. Взгляды Фольмера на образование зародышей в пересыщенном паре детально рассмотрены в гл. XI, посвященной аэрозолям. Здесь же лишь укажем, что растворимость или давление насыщенного пара малых частиц любой фазы, как это следует из термодинамики, больше, чем у крупных частиц (закон В. Томсона). Иначе говоря, увеличение дисперсности фазы повышает ее растворимость в окружающей среде, или способность вещества к выходу из данной фазы. Поэтому раствор, насыщенный относительно крупных кристаллов, является еще ненасыщенным относительно мелких кристаллов того же вещества. В таких условиях самопроизвольное образование достаточно крупных кристаллических зародышей мало вероятно, а очень мелкие зародыши, возникающие в результате флуктуаций, не могут вызвать кристаллизацию, так как по отношению к ним раствор не является пересыщенным. Очевидно, зародыши новой фазы могут образовываться лишь при очень высоких степенях пересыщения, когда возникновение сравнительно больших зародышей статистически более вероятно.
Все только что изложенное можно объяснить и несколько иначе. Процесс образования микрокрксталлнческих коллоидных частиц представляет собой не что иное, как переход метастабильной фазы в стабильную, сопровождающийся уменьшением свободной энергии системы. Этот процесс самопроизвольный, за исключением стадии образования зародышей. Для того чтобы Метастабільная фаза перешла в стабильную, необходимо образование достаточного числа зародышей. Однако для возникновения большего числа зародышей затрачивается энергия на создание новой поверхности раздела фаз — стабильной и метастабильной [15]. Поскольку процесс перехода метастабильной фазы в стабильную на первой зародышевой стадии всегда сопровождается не уменьшением, а увеличением свободной энергии вследствие образования новой поверхности, он не может происходить самопроизвольно до тех пор, пока зародыши, образующиеся в системе, не достигнут определенного размера. После этого переход совершается самопроизвольно.
Совершенно иначе обстоит дело, если в системе присутствуют чужеродные зародыши или в нее введены кристаллики стабильной
фазы, полученные отдельно. При этом образование новой фазы облегчено наличием в системе межфазной поверхности, на которой процессы конденсации протекают особенно легко.
Следует отметить, что введение чужеродных зародышей лежит в основе получения золей с заранее заданной дисперсностью, так как в пересыщенный раствор можно вводить любое число посторонних зародышей, между которыми и распределяется вещество, выделяющееся в виде кристаллической фазы. Более подробно об этом сказано далее, при описании методов синтеза отдельных коллоидных систем.
Из изложенного следует, что ценность формулы (VIII, 1) весьма ограниченна. Тем не менее она указывает путь регулирования дисперсности при образовании коллоидной системы. Для повышения степени дисперсности, согласно этой формуле, необходимо увеличить относительное пересыщение, т. е. увеличить значение сп или уменьшить сн, или, наконец, одновременно увеличить са и понизить с„.
Рассмотрим вторую стадию образования коллоидной системы —■ рост зародышей кристаллизации в результате отложения на них вещества из пересыщенного раствора. Для объяснения роста кристаллов в разное время было предложено много теорий.
Гиббс, Кюри, а впоследствии русский ученый Г. В. Вульф при интерпретации явлений, связанных с ростом кристаллов, исходили из связи между формой кристалла и поверхностной энергией всех его граней. Согласно диффузионным теориям процесс образования кристаллической грани протекает с бесконечно большой скоростью и поэтому зависит только от скорости подвода вещества к кристаллу из раствора, т. е. от скорости диффузии. В двадцатых годах нынешнего столетия для объяснения роста кристаллов Фоль — мер предложил адсорбционную теорию, согласно которой частицы кристаллизующегося вещества при достижении поверхности образуют своеобразный адсорбционный слой — двумерное кристаллическое образование, присоединяющееся затем к грани кристалла. Странский считает вероятным возможность образования на растущем кристалле ионных рядов или слоев, сходных с двумерными кристаллическими образованиями Фольмера.
Если принять диффузионный механизм роста кристаллов, то скорость их роста и2 можно представить уравнением:
Г>ч
«2 = ^(сп-сн) (VIII, 2)’
Где D — коэффициент диффузии; s — поверхность кристалла; 6 — толщина слоя раствора, через который происходит диффузия (в этом слое концентрация вещества растет от Сн на поверхности до сп в объеме пересыщенного раствора).
В результате роста зародыша степень пересыщения раствора уменьшается за счет перехода растворенного вещества в Кристал-, лическую фазу и одновременно снижается растворимость частиц из-за увеличения их размеров. Уравнение (VIII, 2) только в пер«
вом приближении описывает рост кристалликов и далеко не для всех условий. Часто связь между скоростью роста и степенью пересыщения весьма сложна, многие детали процесса еще не ясны. Есть основания полагать, например, что в некоторых случаях скорость роста кристалликов все же определяется не диффузией, а скоростью отложення молекул вещества на гранях кристалла. Помимо этого надо помнить, что процесс роста относительно хорошо изучен только для крупных кристаллов с хорошо сформированными гранями. В процессе же образования мельчайших коллоидных частиц существенны только начальные стадии роста.
При получении коллоидной системы скорость образования зародышей «і должна быть велика, а скорость роста кристаллика «2 мала, так как лишь в этом случае образуется множество кристалликов, каждый из которых соответствует коллоидным размерам. Наоборот, если скорость uj мала, а скорость «2 велика, то все выделившееся вещество отложится на небольшом числе зародышей и в результате образуется сравнительно небольшое количество крупных кристаллов.
Важно отметить, что в первом случае будут образовываться сравнительно монодисперсные золи, а во втором — полидисперсные. Действительно, при малой скорости образования зародышей и большой скорости их роста в начале процесса образования золей возникает небольшое число зародышей, которые — к концу процесса вырастут до кристалликов больших размеров, в то время как кристаллики, образующиеся на зародышах, возникших в конце процесса, останутся маленькими.
Очень существенное значение для получения коллоидных систем имеет концентрация реагирующих растворов. В результате химических реакций, приводящих к образованию плохо растворимых веществ, при малых концентрациях реагирующих веществ получаются золи, при больших концентрациях — осадки и прн весьма больших концентрациях — гели. Это хорошо можно проследить иа примере реакции желтой кровяной соли K4[Fe(CN)6] и хлорида железа FeClj, в результате которой образуется берлинская лазурь Fe, [Fe(CN)6]3. Если быстро смешать в эквивалентных количествах коицентрироваииые растворы хлорида железа и желтой кровяной соли, то берлинская лазурь выделяется в виде густого геля. Небольшое количество этого геля при размешивании в большом объеме воды дает стойкий золь Если вместо концентрированных растворов исходных веществ взять 10-кратио разбавленные растворы, то в результате реакции образуется осадок, ие способный переходить в золь, сколько бы его ие размешивали. Наконец, если растворы хлорида железа и желтой кровяной соли разбавить очень сильно и затем смешать, то получится устойчивый золь берлинской лазури.
Все эти явления можно объяснить следующим образом. В сильно разбавленных растворах скорость кристаллизации невелика, так как для роста кристалликов к иим сначала должно продиффундировать растворенное вещество. В этих случаях за время, нужное для перехода всего вещества в кристаллическую фазу, образуется достаточно большое число зародышей. В очень концентрированных растворах скорость образования зародышей велика потому, что кристаллизация ие может привести к ^быстрому использованию большого количества вещества и прекращению образования новых зародышей. В растворах средней концентрации скорости возникновения зародышей и кристаллизации примерно одинаковы, в результате чего и происходит образование относительно больших частиц.
Вводя в систему во время образования коллоидного раствора различные специально подобранные вещества, препятствующие возникновению зародышей или тормозящие их рост, Хиге еще в 1914 г. изучил раздельно роль скорости возникновения центров кристаллизации и скорости укрупнения микрокристалликов. Оказалось, что к веществам, предотвращающим или замедляющим образование зародышей, относятся Кз[Ре(СЫ)6] и К4Ре(СЫ)6], а к веществам, тормозящим рост кристалликов, — КВг и KI. При введении первых веществ кристаллики из пересыщенного раствора совсем не образуются, однако процесс кристаллизации легко можно вызвать, если в систему ввести чужеродные зародыши. При добавлении веществ, тормозящих рост кристалликов, можно получить золи с мельчайшими, субмикроскопическими частицами.
Действие веществ, препятствующих возникновению зародышей, вероятно, объясняется чисто химическими явлениями, происходящими в растворе. Действие веществ,- задерживающих рост зародышей, вызвано адсорбцией их на зародышевых кристалликах и образованием на поверхности кристалликов тончайшего чужеродного слоя, препятствующего дальнейшей достройке кристаллика. Это объяснение подтверждается тем, что зависимость скорости роста кристалликов от равновесной концентрации вещества, препятствующего росту, может быть выражена уравнением, по виду сходным с известным адсорбционным уравнением Фрейндлиха.
Интересно, что под влиянием специальных добавок может по — разному меняться скорость роста отдельных граней кристалликов. Так, при введении метилового фиолетового в процессе получения золя иодида серебра коренным образом меняется форма кристалликов Agl. Это объясняется, очевидно, тем, что молекулы метилового фиолетового адсорбируются преимущественно на определенных гранях кристаллика (на гранях с наибольшей поверхностной энергией), что и тормозит рост кристалла в направлении, перпендикулярном данной грани.
Наряду с теорией, рассматривающей образование коллоидных систем как процесс кристаллизации, уже сравнительно давно существовали взгляды, согласно которым при быстром осаждении вещества из раствора могут быть получены коллоидные системы с аморфными частицами, лишь впоследствии приобретающими кристаллическое строение. Например, Габер еще в 1-922 г. считал, что характер новой фазы зависит от скорости двух процессов — скорости упорядочения и скорости агрегирования молекул. Если скорости первого процесса больше, то могут получаться кристаллические частицы. Если, наоборот, быстрее протекает второй процесс, то возникает аморфная фаза. Аналогично высказывался и А. В. Думанский.
Детальные исследования В. А. Каргина и 3. Я. Берестневой показали, что образование аморфных частиц при синтезе коллоидных систем чаще является правилом, чем исключением. Эти исследования, сводившиеся к прямому наблюдению образовавшихся частиц с помощью электронного микроскопа, позволили установить, что при получении золей двуокиси тцтана, двуокиси кремния, сульфида мышьяка, гидроокиси алюминия, пятиокиси ванадия и золота сначала возникают круглые или бесформенные аморфные частицы. На рис. VIII, 1а приведена электронная микрофотография частиц свежеполученного золя двуокиси титана. Как можно видеть, частицы имеют размер от 0,1 до 0,8 мкм и образуют цепочечные агрегаты. Аморфность этих частиц видна из рис. VIII,2а, Представляющего собой электронограмму того же препарата.
|
Рис. VIII, 1. Электронные микрофотографии частиц золя двуокиси Титана: О—свежеприготовленны! золь; б — Эоль через 1—2 ч после приготовления. |
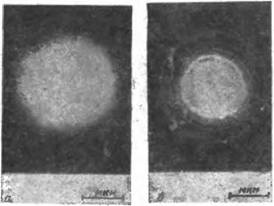
Однако спустя некоторое время после получения внутри частиц всех вышеперечисленных золей происходят явления упорядочения и кристаллизации, приводящие к распадению частиц на отдельные кристаллики. В качестве примера на рис. VIII, 1 б приведена электронная микрофотография препарата, изготовленного из постаревшего золя двуокиси титана. Как можно видеть, внутри первоначальных аморфных сфероидальных частиц образовалось множество мелких кристаллических по форме частиц. Одновременно на электронограммах, как это показано на рис. VIII, 2б, появились кольца из точечных рефлексов, что подтверждает кристаллическую структуру образовавшихся мелких частиц.
Продолжительность существования аморфных частиц весьма различна для разных коллоидных систем. Так, кристаллизация частиц золя золота происходит через 3—5 мин после его приготовления, золя пятиокиси ванадия — через 1ч, золя двуокиси титана— через 1—2 -ч, золя гидроокиси алюминия — через сутки, золя кремневой кислоты — через 2 года. МожНЪ предполагать, что скорость кристаллизации определяется быстротой образования упорядоченных участков и их числом.
Очень сильное влияние на скорость кристаллизации первоначально образовавшихся аморфных частиц оказывает температура. Например, частицы золей гидроокиси алюминия и двуокиси титана, приготовленных при 80—90 °С, сразу дают на электроно — граммах картину, характерную для мелкокристаллических частиц. Очевидно, у этих золей процесс кристаллизации при повышенных
|
Рис. VIII, 2. Электронограммы частиц золя двуокиси титана: а— свежеприготовленные золь; 6′—золь через 1-Я ч после приготовления* |
Температурах протекает настолько быстро, что практически невозможно получить электронограмму первоначально образующихся аморфных частиц.
Дальнейший процесс старения перечисленных коллоидных систем сопровождается как кристаллизацией частиц, так и образованием агрегатов, чаще всего в виде цепочечных или сетчатых структур. Возникновение таких структур свидетельствует о неоднородности коллоидных частиц. Но даже и первичные сферические аморфные частицы образуют цепочки. Это свидетельствует о том, что и на шарообразных частицах имеются более активные участки, по которым происходит их слипание. —
В. А. Каргин и 3. Я — Берестнева на основании наблюдавшихся ими явлений считают, что возникновение в растворах кристаллических образований в качестве первого акта синтеза коллоидных систем маловероятно, так как трудно допустить, что при соударении молекул, атомов или ионов они соединялись сразу в порядке, соответствующем их кристаллической решетке, тем более, что коллоидные системы получаются из сильно пересыщенных растворов. Более вероятно, что в пересыщенном растворе каждое соударение приводит к слипанию частиц. Поскольку соударения между молекулами, атомами или ионами равновероятны во всех направлениях, первичные частицы новой фазы имеют обычно шарообразную форму и аморфную структуру. Различная дисперсность образовавшихся коллоидных частиц обусловливается, по-видимому, теми же факторами, что и различная скорость роста отдельных плоскостей кристаллов в присутствии примесей, которые могут либо ускорять, либо замедлять рост.
Вследствие захвата молекул дисперсионной среды при образовании аморфных частиц и рыхлости их упаковки создаются условия, при которых молекулы, атомы или ионы, вошедшие в состав аморфной частицы, сохраняют достаточную подвижность внутри этих частиц. Так как образовавшаяся система неравновесна, частицы будут кристаллизоваться, что приведет к уменьшению свободной энергии системы. Благодаря возникновению кристаллических образований внутри аморфной частицы в ней создаются напряжения, и частица распадается на множество отдельных мелких, но уже кристаллических частичек. Таким образом, размер образовавшихся кристаллических частиц связан не с условием роста их из раствора, как предполагалось ранее, а с кристаллизацией при распаде первичных аморфных частиц. Весьма вероятно, что описанный механизм образования новой кристаллической фазы в коллоидных системах имеет очень широкое распространение.
Точку зрения В. А. Каргина и 3. Я. Берестневой на механизм образования коллоидных систем подтвердила М. Ф. Талина, изучавшая получение золей гидрата окиси железа по методу Грэма путем взаимодействия карбоната аммония с хлоридом железа. Однако ее электронно-микроскопические и рентгенографические исследования частиц золя Fe(OH)3, полученного с помощью гидролиза, показали иную картину — коллоидные частицы в этом случае имели аморфное строение.
Таким образом, из вышеизложенного напрашивается вывод, что образование частиц в золях может происходить по различным механизмам.
В рассмотренных выше теориях образования коллоидных систем в результате процессов конденсации основное внимание уделялось образованию достаточно малых частиц как условию, обеспечивающему коллоидной системе седиментационную устойчивость. Однако для получения длительно существующих коллоидных систем одного этого условия недостаточно, системе необходимо еще придать агрегативную устойчивость. На это особое внимание обратил еще Н. П. Песков. Он правильно указал на несостоятельность взглядов некоторых исследователей, считавших,4 что для получения золя необходимо лишь раздробить дисперсную ■фазу в дисперсионной среде до частиц, отвечающих коллоидным размерам.
Мы уже знаем, что агрегативная устойчивость коллоидных «систем может определяться одноименным зарядом коллоидных частиц вследствие избирательной адсорбции на их поверхности одного из ионов присутствующего в системе стабилизующего электролита. Существует и ряд других объяснений агрегативной устойчивости. Однако, каковы бы ни были взгляды на причины агрегативной устойчивости гидрофобных коллоидных систем, все они предусматривают адсорбцию присутствующего в системе стабилизатора на поверхности частиц, что и обусловливает взаимодействие между дисперсной фазой и инертной к этой фазе дисперсионной средой. Более подробно вопрос о стабилизации коллоидных частиц рассмотрен в разделе этой главы, посвященном строению мицелл различных золей, а также в гл. IX.
Одной из разновидностей метода конденсации является полимеризация, с помощью которой получают синтетические латексы, представляющие собой водные дисперсии полимеров, т. е. типичные коллоидные системы. Однако рассматривать механизм получения синтетических латексов мы здесь не будем: этот вопрос освещен в курсах химии и физики полимеров.
Диспергационный метод. Прежде чем говорить о получении коллоидных систем путем диспергирования грубых частиц, необходимо хотя бы кратко рассмотреть сущность процесса диспергирования вообще
Диспергированием называют такое измельчение твердых или жидких тел в инертной (не взаимодействующей с измельчаемым веществом) среде, при которое резко повышается дисперсность и образуется дисперсная система, обладающая значительной удельной межфазной поверхностью. В противоположность растворению диспергирование происходит, как правило, не самопроизвольно, а с затратой внешней работы, расходуемой на преодоление межмолекулярных сил при дроблении вещества. >
Процесс диспергирования имеет большое практическое значение в ряде производств и технологических процессов: при получении высокодисперсных порошков, служащих активными наполнителями для полимеров и пигментами для красок, при изготовлении суспензии графита для смазок, при измельчении руд полезных ископаемых перед их обогащением, при изготовлении муки и других пищевых продуктов и т. д.
В — результате изучения механизма диспергирования твердых тел было установлено, что при деформации твердого тела на его поверхности образуются микротрещины. Работы А. Ф. Иоффе и его школы показали, что именно образование микротрещин и особенно поверхностных микротрещин служит главной причиной резко пониженной прочности твердых тел по сравнению с теоретически возможной прочностью, вычисленной на основании данных об их строении.
Микротрещины образуются обычно в слабых местах кристаллической решетки._Все твердые тела обладают дефектами структуры, распределенными в объеме так, что участки твердого тела между ними имеют в среднем размеры порядка Ю-6 см. Иначе
говоря, один дефект встречается в среднем через 100 правильных межмолекулярных или межатомных расстояний. «Слабыми местами» могут являться границы между отдельными кристалликами, если тело состоит из микрокристалликов, и любые неоднородности. При снятии нагрузки, если не было достигнуто разрушения тела, образовавшиеся микротрещины, по П. А. Ребиндеру, смыкаются и исчезают, как бы «залечиваются». В случае же нагрузок, превышающих предел прочности, разрушение тела в основном идет по этим микротрещинам.
П. А. Ребиндер, Е. Д. Щукин и др. в своих работах показали, что развитие микрощелей под действием внешних деформирующих сил может происходить значительно легче при адсорбции различных веществ из среды, в которой ведется диспергирование. Адсорбироваться могут как ионы электролитов, так и молекулы поверхностно-активных веществ. Образуя на адсорбировавшей их поверхности двухмерный газ в результате нелокализован — ной адсорбции, они под давлением этого газа проникают в устья возникших микрощелей и стремятся раздвинуть каждую микрощель, содействуя таким образом внешним деформирующим силам и способствуя диспергированию.
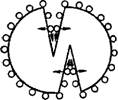
На рис. VIII, 3 схематически изображено развитие микрощелей под влиянием двухмерного газа, образовавшегося в результате адсорбции вещества на поверхности частиц. Следует отметить, что диспергирование облегчается не только благодаря давлению двухмерного газа, но и вследствие экранирования сил сцепления, действующих между противоположными поверхностями щели, при попадании в образующиеся микрощели постороннего вещества.
Облегчение диспергирования под влиянием адсорбции получило название эффекта Ребиндера или адсорбционного понижения твердости, а вещества, повышающие эффективность диспергирования, называются понизителями твердости.
Адсорбционное понижение твердости имеет большое практическое значение. Оно используется не только при получении дисперсных систем, но и при достаточно грубом разрушении и деформировании различных материалов, например при бурении горных пород, при обработке металлов на металлорежущих станках и т. д. Благодаря адсорбционному понижению твердости эти процессы ускоряются, снижаются энергетические затраты и удлиняется срок работы режущего инструмента.
|
Рис. VIII, 3. Схема развития микрощелей под давлением двухмерного газа. |
Переходя непосредственно к получению коллоидных систем методом диспергирования, следует указать, что при простом механическом дроблении или растирании образуются обычно порошки, размер частиц которых не меньше нескольких микрометров. Этот предел обусловен тем, что при механическом измельчении
происходит также и слипание частиц. Однако еще П. П. Веймарв в 1912 г. заметил, что если при растирании в обычной ступке нерастворимых окислов, сульфидов и хлоридов металлов добавлять к растираемому веществу сахар или другие органические соединения, то дисперсность продукта значительно увеличивается. Аналогичные результаты были получены в лаборатории Сведберга. При растирании серы с мочевиной и растворении полученной смеси в воде образовывались довольно стойкие суспензии серы. Подобное действие третьего компонента объясняется адсорбционным понижением твердости. Кроме того, способствующее диспергированию вещество может являться стабилизатором.
Тем не менее методы диспергирования обычно значительно уступают методам конденсации по дисперсности полученных систем. Способом диспергирования даже в присутствии стабилизатора редко удается получить системы, у которых частицы были бы меньше 1 мкм. Л
Метод пептизации. Пептизацией называют переход в коллоидный раствор осадков, образовавшихся при коагуляции. Термин пептизация был введен еще Грэмом на основании чисто внешнего сходства процесса пептизации с растворением белков под влиянием пепсина. Пептизация может происходить в результате промывания осадка или под действием специальных веществ — Пептизаторов. При этом из осадка удаляются коагулирующие ионы или пептизатор адсорбируется коллоидными частицами осадка, что ведет к образованию двойных электрических слоев или сольватных оболочек вокруг коллоидных, частиц и к преодоленик> благодаря ним сил сцепления между частицами. Ставшие свободными частицы под влиянием теплового движения распределяются равномерно во всем предоставляемом им объеме жидкости. Таким образом, пептизация является процессом, как бы обратным коагуляции.
Следует заметить, что пептизировать осадок удается далеко не всегда. Пептизации препятствуют явления рекристаллизации и старения, приводящие к сращиванию частиц друг с другом. Очень трудно также осуществить пептизацию осадка, полученного путем коагуляции золя поливалентными ионами, весьма прочно удерживающимися на поверхности адсорбировавших их частиц.
При пептизации, как и при коагуляции, не наблюдается сте — хиометрических отношений между количествами пептизатора й пептизированного осадка. Для пептизации осадка и получения лиозоля не требуется, чтобы вся поверхность частиц была покрыта слоем адсорбированного пептизатора. Так, Фаянс установил, что* для получения устойчивого золя бромида серебра частицы его должны быть покрыты всего на LU— ‘/ю часть от всей поверхности пептизатором, которым в этом случае будет электролит, содержащий бромид-ионы. Однако от количества пептизатора зависит дис-„ персность частиц в полученном золе. При малом содержании введенного пептизатора образуются частицы высших порядков, со
стоящие из нескольких первичных частиц, при достаточно большом — отдельные первичные частицы.
Пептизация протекает с определенной скоростью, причем при достаточном количестве пептизатора процесс вначале идет весьма быстро, а затем постепенно замедляется. Для скорости пептизации, понятно, имеет значение перемешивание системы. При хорошем перемешивании ускоряется проникновение пептизатора внутрь агрегатов, что способствует отрыву частиц друг от друга и переходу их в раствор. Скорость пептизации, как правило, возрастает с повышением температуры.
|
И —
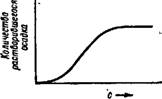
Количестбо осадка, Взятого для растборетя Рис. VIII, 4. Зависимость количества осадка, перешедшего в коллоидный раствор, от количества осадка, взятого для растворения (прн постоянном содержании пептизатора). |
При пептизации наблюдается весьма характерная зависимость между количествами пептизированного вещества, взятого осадка и пептизатора. Эта закономерность, называемая иногда правилом
|
Рис. VIII, 5. Зависимость количества осадка, перешедшего в коллоидный раствор, от концентрации введенного пептизатора с (при постоянном количестве осадка, взятого для растворевия). |
Осадка и изученная Во. Оствальдом и Бузагом, заключается в том, что при постоянном содержании пептизатора с возрастанием количества взятого для пептизации осадка количество осадка, перешедшего в раствор, сначала увеличивается, а затем уменьшается (рис. VIII, 4).
Объяснение правила осадка заключается в следующем. Для пептизации одной частицы осадка требуется некоторое минимальное количество пептизатора. Поэтому при введении первых порций осадка, когда в системе пептизатора много, а осадка еще мало, последний легко переходит в золь. Однако по мере добавления осадка на одну его частицу будет приходиться все меньше и меньше пептизатора. Это приведет сначала к снижению коллоидного растворения. Затем, когда пептизируемого вещества в системе станет много, осадок не только перестанет растворяться, но даже выпадет уже растворившийся осадок, так как вследствие перераспределения пептизатора между коллоидными частицами его уже не будет хватать для того, чтобы эти частицы находились в растворе.
Как следует из зависимости между количествами коллоидно растворенного осадка и взятого для растворения, пептизация резко отличается от обычного растворения, в ротором после достижения насущенця содержание растворенного вещества перестает зависеть от количества вещества, взятого для растворения. Такое различие объясняется, конечно, тем, что для коллоидного растворения требуется пептизатор, в то время как для истинного растворения никакой третий компонент не нужен.
Если брать для растворения одинаковые количества осадка и пептнзировать их различными, все увеличивающимися количествами пептизатора, то начнется пептизация, которая быстро возрастает с увеличением количества вводимого пептизатора, и, наконец, наступит полная пептизация осадка (рис. VIII, 5). Подобную зависимость также легко объяснить тем, что для коллоидного растворения осадка необходимо определенное количество пептизатора.
Явление пептизации имеет большое значение в технике при переведении различных осадков в коллоидные растворы, а также в препаративной коллоидной химии при получении золей. Однако часто пептизация может играть и отрицательную роль. Например, при извлечении сахара из свеклы диффузией возможна пептизация пектина и других веществ, содержащихся в растительных тканях.
Самопроизвольное диспергирование. Весьма интересно явление самопроизвольного образования равновесных и устойчивых коллоидных систем. Опыт показывает, что в отдельных случаях твердое тело или жидкость могут самопроизвольно диспергироваться в жидкой среде с образованием двухфазной, но термодинамически устойчивой коллоидной или микрогетерогенной системы. Такие системы, полученные в результате самопроизвольного диспергирования, П. А. Ребиндер, как уже мы указывали в гл. I, предлагает называть Лиофильными коллоидными системами, поскольку при этом достаточно сильно выражено взаимодействие между веществом дисперсной фазы и средой.
К таким системам относятся критические эмульсии, возникающие спонтанно при температурах, близких к критическим; высокодисперсные золи парафина в углеводородах; водные растворы эмульсолов — углеводородов с большим содержанием (10—40%)v мыл или мылоподобных поверхностно-активных веществ (эмуль — солы применяют в качестве смазочнорежущих жидкостей при хо-‘, лодной обработке металлов) и т. д. Эти системы могут существо-; вать длительное время без заметных изменений.
О причинах возникновения и существования подобных систем в последние годы велась оживленная дискуссия (П. А. Ребиндер, Г. И. Фукс, Е. Д Щукин и др), которая до настоящего времени не привела к окончательному решению: вопроса Однако учитывая большое принципиальное значение самопроизвольного, возникновения термодинамически равновесных двухфазных систем, этот процесс следует рассмотреть более подробно, всходя из представлений, развиваемы^ П. А. Ребиндером.
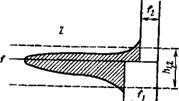
Как для классических лиофобиых, так и для лиофильных систем в новом смысле этого слова характерно существование межфазной груницы, разделяющей фазы 1 и 2 (рис VIII, 6а). Однако фактически межфазиая граница не является геометрической плоскостью, а имеет некоторую толщину Лі,2, хотя и — весьма малую вследствие резкого снижения действия молекулярных сил с расстоянием (см. рис. VIII, 66) В этом случае правильнее говорить о пограничном межфазиом слое.
Свободная энергия системы F, включая и межфазный слой, может быть выражена уравнением:
Fl^l + /2^2 + Ol, 2^1, 2 (VIII, 3)
Где F и Fj — свободные энергии первой и второй фаз, fi и f2 — плотности свободной энергии этих фаз; Vi и V2 — объемы фаз; F 1,2 — свободная энергия пограничного слоя; 0i,2 — сгущение свободной энергии в пограничном слое с площадью Sil2.
В объеме фаз плотности энергий Fi и Ft Постоянны. Однако вблизи поверхности разодела фаз плотность энергии возрастает с приближением к поверхности раздела под действием энергии взаимодействия фаз или некомпеисированности межмолекулириых сил в поверхностном слое. Таким образом, переход ог энергетического уровня первой фазы F 1 к энергетическому уровню второй фазы F2 совершается через энергетический барьер, отвечающий сгущению свободной энергии в поверхностном слое. Это слой иа рис. VIII, 7 показан в _виде заштрихованного «языка». Площадь «языка» соответствует сгущению свободной энергии в поверхностном слое или для слоя площадью в 1 см2 — межфазному поверхностному иатяжеияю Oi,2.
|
|
В типичных лиофобных коллоидных системах межфазный слой характеризуется большим увеличением плотности свободной энергии и четкой границей
Рис. VIII, 7. Изменение плотности свободной энергии F у межфазной границы лиофобных коллоидных систем.
Ряс. VIII, 8. Изменение плотности свободной энергии F у межфазной границы лиофильных коллоидных систем.
Раздела фаз. В этом случае 04,2 стИР, где сНР — критическое значение межфазного поверхностного натяжения, при котором возможно образование термо — ‘ динамически равновесной коллоидной системы, т. е имеет место самопроизвольное диспергирование в результате теплового движения вещества. Поэтому в лиофобных системах (при 0j, 2 Стир) самопроизвольно могут идти только процессы коагуляции, структурообразоваиия, рекристаллизации и т. д.
В лиофильных коллоидных системах межфазный слой характеризуется малым увеличением плотности свободной энергии и ие имеет^ четкой границы. На
Рис. VIII, 8 даиа схема, характеризующая сгущеиие энергии в поверхностном слое частиц лиофильиого золя.
Разность (Fi — Ft), как можно видеть из этого рисунка, очень мала и энергетический барьер в этом случае практически отсутствует. Поэтому лиофильиые системы (в ионом смысле этого слова) способны к самопроизвольному диспергированию под влиянием теплового движения.
Изменение свободной энергии AF при самопроизвольном диспергировании можно представить уравнением:
AF — ЛС/ + Aslt 2а1( 2 — Т AS (VIII, 4)
Где U — внутренняя энергия; S — энтропия.
В данном случае AU близко к нулю. Тогда условие самопроизвольного диспергирования очевидно будет выражаться неравенством:
Aslt2o1>2-T AS<0 (VIII,5)
Первый член левой части этого неравенства представляет собой возрастание свободной энергии при, диспергировании, а второй член левой части характеризует убыль свободной энергии вследствие равномерного распределения дисперсной фазы в объеме. При достаточно малой величине ш, 2 энтропийный член может превалировать, в результате чего и происходит самодиспергирование.
Из уравнения (VIII, 5) можно получить следующее:
Пага1і2<пукТ (VIII, 6)
Где п — число частиц; а — размер частиц; k — постоянная Больцмаиа; — безразмерный К9эффициент.
Величина па2 пропорциональна изменению поверхности, а величина nyk — изменению энтропии системы при диспергировании. Константа у при диспергировании до частиц коллоидных размеров имеет значение около 10.
Из уравнения (VIII, 6) можно получить критическое значение поверхностного натяжения:
0Гкр = -^г — (VIII. 7)
Для частиц коллоидных размеров ажЮ-6 см, а акр«0,01 эрг/см2. Иначе говоря, самопроизвольное диспергирование вбзможно для получения КОЛЛОИДНЫХ систем, У которых Oi, 2 < Окр я* 0,01 эрг/см2.
При самопроизвольном диспергировании образуются дисперсные системы, характеризующиеся нормальными кривыми распределения с некоторым наиболее вероятным радиусом частиц. Это значит, что существует какая-то оптимальная, характерная для данной системы дисперсность. Дальнейшее самодиспергирование вплоть до молекул П. А. Ребиндер с сотр. считают невозможным. Согласно их точке зрения термодинамическая устойчивость Двухфазных дисперсных систем определяется двумя условиями: достаточно низким межфазным поверхностным натяжением и быстрым его повышением с уменьшением радиуса частиц. Однако причины повышения межфазного натяжения с уменьшением размера частиц трудно объяснить.
Можно дать и другие объяснения, почему явление самодиспер — гирования не идет до молекул. Так, при разбавлении водой эмуль- солов отдельные молекулы углеводорода не могут существовать в системе из-за нерастворимости углеводорода в воде. По этой причине образовавшиеся молекулы углеводорода тотчас слипаются друг с другом в капельки, а присутствующее в системе поверхностно-активное вещество адсорбируется на этих капельках и понижает Оіі2 до значений, меньших Окр. Таким образом, при растворении эмульсола одновременно протекают два противоположно направленных процесса — растворение эмульсола до молекул и слипание молекул углеводорода в агрегаты, адсорбирующие поверхностно-активное вещество. При установлении равновесия между обоими процессами получается устойчивая равновесная эмульсия. Размеры капелек этой эмульсии определяются количественным соотношением углеводород : поверхностно-активное вещество, природой обоих компонентов, температурой и т. д.
В случае образования критических эмульсий при нагревании двух несмешивающихся при обычной температуре жидкостей невозможность растворения вплоть до молекул объясняется двумя одновременно протекающими, но противоположно направленными процессами. С одной стороны, идет диспергирование вплоть до молекул одной из фаз, а с другой — одновременно происходит ко- алесценция капелек этой фазы, в результате чего устанавливается динамическое равновесие, которое тотчас нарушается с изменением температуры. Конечно, состояние критической эмульсии также соответствует минимальной свободной энергии системы. Ч В заключение обобщим кратко те термодинамические положения, которые необходимо иметь в виду при рассмотрении различных методов синтеза коллоидных систем.
При получении коллоидных систем методом диспергирования работа, затрачиваемая на преодоление межмолекулярных сил при дроблении дисперсной фазы, запасается системой в виде свободной энергии на межфазной поверхности. Избыток свободной энергии делает систему термодинамически неустойчивой. Для придания системе агрегативной устойчивости избыток свободной энергии должен быть уменьшен посредством адсорбции. Однако практически в результате адсорбции никогда не удается избавиться от свободной поверхностной энергии полностью, и поэтому устойчивость типичных коллоидных систем носит обычно временный характер. При дроблении вещества, понятно, увеличивается энтропия системы. Однако увеличение энтропии благодаря сравнительно большим размерам частиц не сказывается сколько-нибудь заметно на устойчивости коллоидного раствора. Только прй очень малых межфазных поверхностных натяжениях увеличение энтропии может приводить к самопроизвольному диспергированию и образованию равновесных коллоидных систем.
Для пептизации внешней энергии на перевод осадка в раствор не требуется, так как свежий осадок представляет собой первичные частицы, очень непрочно слипшиеся друг с другом только в отдельных местах. Для преодоления сил сцепления в систему достаточно ввести пептизатор, диффундирующий к поверхности частиц и образующий на ней двойной электрический слой или соль — ватную оболочку.
Фактором, обусловливающим при этом равномерное распределение частиц по всему объему жидкости, ставших свободными и устойчивыми, является броуновское движение.
Получение коллоидных систем путем самопроизвольного диспергирования близко по своему существу к пептизации. В этом случае работа диспергирования мала благодаря небольшой межфазной свободной энергии. При этом работа диспергирования настолько невелика, что для коллоидного растворения достаточно одного теплового движения. Возрастание энтропии системы в результате более равномерного распределения диспергированного вещества с избытком компенсирует увеличение свободной поверхностной энергии вследствие возрастания поверхности раздела фаз.
Наиболее сложными кажутся на первый взгляд термодинамические условия получения коллоидных систем методом конденсации. Может даже показаться, что золи, синтезированные, например, в результате химической реакции, образуются самопроизвольно и, следовательно, их получение сопровождается уменьшением свободной энергии системы. Однако не следует забывать, что при химической реакции свободную энергию системы следует сравнивать не со свободной энергией растворов исходных компонентов реакции, а со свободной энергией полученной системы с выкристаллизовавшейся дисперсной фазой. При этом причины неустойчивости коллоидных растворов, полученных методом конденсации, становятся совершенно ясными.
 1 ноября, 2012
1 ноября, 2012  admin
admin 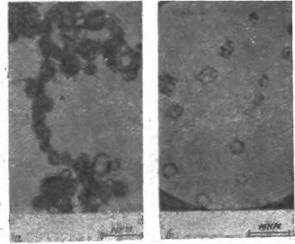

 Опубликовано в рубрике
Опубликовано в рубрике 