Адсорбция электролитов не укладывается в рамки учения о молекулярной адсорбции и требует специального рассмотрения, поскольку адсорбент может по различному адсорбировать ионы, на которые распадается молекула электролита в растворе. Так как наибольшее практическое значение имеют водные растворы электролитов, рассмотрим лишь адсорбцию электролитов из таких растворов.
На адсорбции ионов существенным образом сказывается природа адсорбента. Ионы, способные поляризоваться, адсорбируются обычно только на поверхностях, состоящих из полярных молекул или из ионов. Поэтому ионную адсорбцию часто называют также
|
Рис. VI, 5. Соотношение между истинными радиусами одновалентных катионов и их радиусами в гидратироЕанном состоянии. Li |
|
» ‘___ і— 1 А О I I 3 |
Полярной адсорбцией. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, несущие противоположный знак, непосредственно не адсорбируются, но под" действием сил электростатического притяжения остаются вблизи адсорбированных ионов, образуя с ними на поверхности адсорбента так называемый Двойной электрический слой. Строение этого слоя подробно рассмотрено в гл. VII, посвященной электрическим свойствам коллоидных частиц.
Радиус ионов сильно влияет на их способность адсорбироваться. Из ионов одинаковой валентности максимальную адсорбционную способность проявляют ионы наибольшего радиуса. Причина этого явления, с одной стороны, заключается в большой поляризуемости таких ионов и, следовательно, их способности притягиваться поверхностью, состоящей из ионов или полярных молекул, с другой стороны, в меньшей гидратации ионов (чем больше радиус иона, тем меньше при одном и том же заряде его гидратация). Гидратация вообще препятствует адсорбции ионов, так как наличие гидратной оболочки уменьшает электрическое взаимодействие.
Различие в гидратации одновалентных катионов иллюстрирует схема, приведенная на рис VI, 5. Сплошная линия обозначает границу самого иона, а пунктирная — границу его гидратной оболочки. Из схемы видно, что ион лития гораздо более гидрати-
рован, чем ион цезия. Ряды ионов, составленные в порядке уменьшения их способности связывать среду, называются лиотропными рядами, или рядами Гофмейстера. Одновалентные катионы можно поставить в следующий ряд по возрастающей способности адсорбироваться:
Li+ <Na+ < К+ <Rb+ < Cs+ Для двухвалентных катионов это будет следующий ряд-
Mg2+< Са2+ <Sr2+ <Ва2 +
Одновалентные анионы по их возрастающей способности адсорбироваться располагаются в такой последовательности:
СГ < Вг — < N03~ < I — < NCS-
|
+ |
|
+ |
|
+ |
|
• |
9 |
9 |
9 |
||||
|
О |
9 |
О |
9 |
О |
9 |
О |
9 |
|
• |
О |
9 |
О |
9 |
О |
9 |
О |
|
О |
9 |
О |
9 |
О |
9 |
О |
9 |
|
9 |
О |
9 |
О |
9 |
О |
9 |
О |
|
О |
© |
-к+ |
• |
-г |
|
Рис. VI, 6. Достройка кристалла иодида серебра в растворе иодида калия. Притягивается противоположно заряженными микроучастками поверхности. Катионы различной валентности по их возрастающей адсорбционной способности можно расположить в следующий ряд: K+<Ca2+<Al3+«Th4+ Особый интерес для коллоидной химии представляет адсорбция ионов поверхностью кристалла, в состав которого входят ионы той же природы. При этом адсорбцию можно рассматривать как кристаллизацию, т. е. как достройку кристаллической решетки способным адсорбироваться ионом. СогласноЛанету и ФаяисуТ* кристаллы достраиваются лишь теми ионами или атомами, которые входят в их состав. Например, кристаллы Agl, внесенные в раствор KI, адсорбируют на поверхности иодид-ионы. Если же |
Адсорбционная способность ионов весьма сильно зависит также от их валентности. Чем больше валентность иона, тем сильнее он
кристаллы Agl внести в раствор AgNC>3, то происходит адсорбция ионов серебра. Понятно, что силы, под влиянием которых происходит такая достройка, являются химическими и одновременно электростатическими силами, и ионы, достраивающие кристалл, адсорбируются в этом случае особенно прочно. На рис. VI, 6 показана схема достройки кристалла иодида серебра в растворе иодида калия (первоначальная граница кристалла Agl обозначена на схеме пунктиром).
Существенно, что достраивать кристаллическую решетку способны не только ионы, входящие в состав решетки, но и изоморфные с ними. Важно также, что образовать прочную связь с поверхностью кристалла могут не только ионы, входящие в кристаллическую решетку, но и вообще атомные группы, близкие к атомным группам, находящимся на поверхности. Так, уголь прочно удерживает органические радикалы, а окиси и гидраты окисей алюминия и железа прочно связывают группы, содержащие кислород.
В заключение отметим, что на поверхности адсорбента могут адсорбироваться как ионы, так и молекулы, из которых они образовались, причем между первыми и последними существует адсорбционное равновесие. Наличие молекулярной формы адсорбированного электролита на поверхности коллоидных частиц было показано в работах В. А. Каргина ца примере ферри — и алюмо — золей.
 1 ноября, 2012
1 ноября, 2012  admin
admin 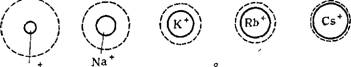
 Опубликовано в рубрике
Опубликовано в рубрике 