![ЗАЩИТА ГРАНИЦЫ В ДВУХФАЗНОЙ НЕРАЗМЕШИВАЕМОй. СИСТЕМЕ УГЛЕВОДОРОД-ЭЛЕКТРОЛИТ Подпись: Как уже указывалось, часто наблюдается сильная коррозия нефтехранилищ, баков горючего, нефтеперерабатывающей аппаратуры и других емкостей у линии раздела двух несмешивающихся жидкостей: электролит — углеводород. Гоник [191] показал, что скорость коррозии железа в присутствии сероводорода в системе бензин — 3% NaCl (Н20) на порядок выше, чем в отдельно взятых водной и углеводородной фазах. На установках деэмульгации нефти наибольшая коррозия наблюдается у границы раздела нефть — пластовая вода. Алюминий и его сплавы, по нашим данным, также подвергаются сильной коррозии при наличии двух несмешивающихся жидкостей, например хлористого натрия и топлива ТС-1, в особенности в зоне разде](/img/1208/image303.gif) |
ла фаз.
Долгое время механизм этого процесса оставался неясным. Выполненные за последнее время нами исследования позволили разобраться в нем. Металлы, покрытые окисной пленкой, гидрофильны; при их соприкосновении с водной средой и углеводородной жидкостью на границе раздела фаз образуется вогнутый мениск с тонкой пленкой электролита между металлом и углеводородной фазой (рис. 9,4). Такая форма мениска обусловлена избирательным смачиванием.
![]()
![]()
![]()
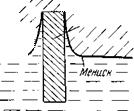 Реакция восстановления кислорода в тонком слое электролита протекает, как это было нами показано, вследствие конвективной диффузии со значительно большей скоростью, чем в объеме электролита. Поскольку растворимость кислорода в углеводородах значительно выше, чем в воде (например, 0,002 моль/л в топливе ТС-1 против 0,0002 моль/л в 0,1 н. NaCl), создаются благоприятные условия для того, чтобы в зоне мениска и в пленке над ним с большей скоростью протекали катодные процессы. Вследствие этого в двухфазной системе электролит — углеводород должен возникнуть своеобразный коррозионный элемент, в котором часть металла, находящегося в электролите, становится анодом, а часть металла, располагающегося в углеводородной фазе выше мениска — катодом.
Реакция восстановления кислорода в тонком слое электролита протекает, как это было нами показано, вследствие конвективной диффузии со значительно большей скоростью, чем в объеме электролита. Поскольку растворимость кислорода в углеводородах значительно выше, чем в воде (например, 0,002 моль/л в топливе ТС-1 против 0,0002 моль/л в 0,1 н. NaCl), создаются благоприятные условия для того, чтобы в зоне мениска и в пленке над ним с большей скоростью протекали катодные процессы. Вследствие этого в двухфазной системе электролит — углеводород должен возникнуть своеобразный коррозионный элемент, в котором часть металла, находящегося в электролите, становится анодом, а часть металла, располагающегося в углеводородной фазе выше мениска — катодом.
|
Рис. 9,5. Катодные поляризационные кривые, снятые на стальных электродах в 0,1 н. NaCl при различной длине / (в см) непогруженной в электролит части электрода і (сплошные линии относятся к системе электролит—(воздух; штриховые к системе электролит—топливо): I — 0; 2, 2′ — 0,5; 3, 3’— 1,0; 4, 4′ — 1,5; 5 — 1,0 (перемешивание топливной фазы); 5 — 1,0 (перемешивание обеих фаз). |
Если выдвинутая точка зрения верна, то при изменении зоны реакции в углеводородной фазе, что может быть осуществлено постепенным извлечением катоднополяризуемого электрода в углеводородную фазу, должен измениться катодный ток. Приведенные на рис. 9,5 кривые подтверждают, что в зоне мениска и пленке над ним генерируется значительный ток, который по мере извлечения электрода из электролита и перемещения его в углеводородную фазу непрерывно растет. Таким образом, прямыми опытами доказывается, что часть металла, расположенная выше границы раздела в углеводородной фазе, функционирует в качестве мощного катода. Средняя толщина (примерная оценка) пленки электролита, которая возникает в углеводородной фазе, в системе электролит — топливо равна 3,3-10-4 см, а в системе электролит — воздух — 3-10-4 см.
Эффективность работы катода в зоне мениска и пленке, расположенной выше, находится в сильной зависимости от потенциала. По мере смещения потенциала в отрицательную сторону скорость катодного процесса возрастает. Примечательно, что генерируемый в зоне мениска в двухфазной системе электролит — углеводород ток восстановления кислорода (ср = —0,350-1—0,450 В) примерно такой же, как в системе электролит — воздух. Отсюда следует, что углеводородная фаза является своеобразным аккумулятором кислорода, не уступающим воздушной атмосфере.
Исследование температурной зависимости катодного тока, генерируемого в пленке электролита, расположенной в углеводородной фазе, показало, что эффективная энергия активации составляет 21 кДж/моль. Следовательно, электрод в зоне мениска и пленке над ним работает в диффузном режиме и перенос кислорода к электроду лимитирует общую скорость катодного процесса. Размешивание углеводородной фазы должно способствовать росту катодного тока, что и наблюдается.
Реакции, протекающие в тонкой пленке электролита над мениском, подчиняются всем закономерностям теории электрохимической кинетики в тонких слоях, установленным нами в работе [204]. Катодные поляризационные кривые смещаются в положительную область потенциалов по мере увеличения зоны реакции в углеводородной фазе. Это указывает на сильное ускорение катодного процесса в пленке электролита.
Поскольку эффективность катодного процесса зависит от высоты поднятия пленки электролита в углеводородную фазу, а форма мениска на твердой поверхности в системе двух несмешивающихся жидкостей определяется смачивающей способностью этих жидкостей, представляется возможным изменить межфазное натяжение, а тем самым и форму мениска. Согласно взглядам, развитым академиком Ребиндером, адсорбция углеводородорастворимых поверхностно-активных веществ на твердой поверхности может значительно повысить смачивание поверхности металла углеводородом. Поэтому, если ввести в углеводородную фазу поверхностно-активные вещества (ПАВ), можно в предельном случае так повысить избирательную смачиваемость электрода углеводородом, что не будет вогнутого мениска и пленки электролита в углеводородной фазе. В качестве ПАВ нами были изучены анионоактивное вещество олеат магния и катионоактивное — соль дициклогексиламина. В согласии с теоретическими предсказаниями в присутствии этих ПАВ ток, генерирующийся в зоне мениска, резко падал, и при 0,1% ПАВ катодные кривые получались такими же, как и в объеме электролита, т. е. вогнутый мениск исчезал. Результаты, полученные при изучении электрохимической кинетики, хорошо согласовались с непосредственными коррозионными опытами. Изменяя с помощью ингибиторов смачиваемость металла углеводородом (топливом ТС-1), нам удалось подавить коррозионный процесс и добиться ~90%-ной защиты (табл. 9,13).
Сильное замедление коррозии в двухфазной системе с помощью ингибиторов удалось получить и на алюминиевых сплавах, в частности на сплаве Д-16 (табл. 9,14).
Как видно, с помощью небольших концентраций ингибиторов можно в десятки и сотни раз замедлить коррозию. Наилучшие результаты получены с углеводородорастворимыми ингибиторами: сульфированные масла (БМП), сульфонаты (ИКСГ), капроновая кислота, нитрилстеарат. Из водорастворимых ингибиторов лучший результат обнаружил катапин А.
|
Таблица 9,13. Влияние ингибиторов на коррозию стали в двухфазной системе 0,1 н. NaCl — топливо ТС-1 в присутствии ингибиторов
|
При защите металлов ингибиторами очень важно, чтобы электролит попал на поверхность сплава после контакта ее с ингибированным топливом. Предварительная адсорбция ингибитора резко снижает скорость коррозии. Были изучены три варианта контактирования сплава Д-16 с двухфазной системой: в первом варианте образец сначала полностью помещался в электролит, а затем наливалось ингибирозанное топливо; во втором варианте образец наполовину погружался в электролит, затем наливалось ингибированное топливо, в третьем варианте образец предварительно выдерживался в ингибированном топливе, а затем помещался в двухфазную систему электролит — углеводород таким образом, чтобы
|
Таблица 9,14. Влияние водорастворимых и углеводородорастворимых ингибиторов [0,05% (масс.)] на коррозию алюминиевого сплава Д-16 в двухфазной системе 10~4 н. Na2S04—топливо ТС-1
В—вода; У—углеводород. |
|
граница раздела проходила по середине образца. Результаты при-
|
Как видно, даже кратковременный контакт сплава Д-16 с ингибированным топливом обеспечил полное прекращение коррозии. Углеводородорастворимые ингибиторы, такие, как БМП и ИКСГ, замедляют коррозию благодаря адсорбции ингибитора из углеводородной фазы, а возможно, и миграции молекул ингибитора по поверхности металла в водную фазу. Катодный ток, генерируемый в зоне мениска, в присутствии этих ингибиторов резко падает, а в присутствии БМП он в определенных условиях даже меняет знак. Это свидетельствует о возникновении не вогнутого мениска, а выпуклого, что связано с улучшением смачиваемости металла ингибитором.
 9 сентября, 2015
9 сентября, 2015  admin
admin 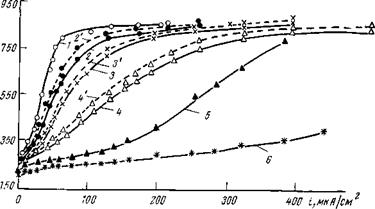
 Опубликовано в рубрике
Опубликовано в рубрике 