Наиболее дешевым и распространенным ингибитором является бикарбонат кальция, который присутствует в большинстве жестких природных вод и способствует отложению на металлических поверхностях карбонатных защитных пленок. Образование этих пленок зависит от жесткости воды и концентрации двуокиси углерода.
Различают общую жесткость воды, карбонатную жесткость и некарбонатную.
Общая жесткость Ж общ определяется суммой концентраций ионов кальция Са2+ и магния Mg2+, выраженных в мг-экв/л:
![]() [Са2+] , [Mg2+]
[Са2+] , [Mg2+]
»’общ 20)04 + 12 16
|
Карбонатная жесткость Жк обусловлена наличием в воде бикарбонатов кальция и магния; она вычисляется по формулам
|
В знаменателях формул (8,1) — (8,5) приведены эквивалентные массы, выраженные в мг/мг-экв: для Са2+ — 20,04; Mg2+—12,16; НСОз- —61,02.
Некарбонатная жесткость обусловлена наличием кальциевых и магниевых солей сильных кислот и вычисляется по разности между общей и карбонатной жесткостью. Осаждение на поверхности металла карбонатной пленки кальция (будет или нет) зависит от концентрации свободной двуокиси углерода СОг в воде. В водных растворах углекислых соединений существует равновесие между различными формами угольной кислоты:
![]() Н2С03 Н+ + НС03
Н2С03 Н+ + НС03
2НС03 СО!" + С02 + Н20
Соотношение между различными формами (СОг, НСОз и СОз’) зависит от температуры воды и pH (рис. 8,1). Из приведенного рисунка видно, что при рН = 3,7ч-4 (7’=25°С) вся находящаяся в воде угольная кислота находится в виде СОг. По мере увеличения pH доля_ С02 уменьшается, а доля НСОз увеличивается. При рН=8,3=8,4 практически вся присутствующая в воде угольная кислота находится в виде бикарбонатных ионов (более 98%). При дальнейшем увеличении pH воды (> 8,4) свободная двуокись углерода в воде не существует, возрастает доля
карбонатных ионов СОз’, уменьшается доля ионов НСОз • При рН = = 12 вся углекислота в воде находится в виде СОз". Таким образом, определенной концентрации ионов НСОз соответствует определенная концентрация свободной СОг, называемая равновесной. Если концентрация свободной СОг в воде больше равновесной, то произойдет растворение карбоната кальция:
CaCOs + С02 + Н20 ——— > Са(НС03)2 (8,8)
Осаждение карбоната кальция в такой воде невозможно и она считается агрессивной. Она препятствует отложению на металлических поверхностях пленки из СаСОз и способствует растворению ранее образовавшихся пленок. Поэтому ее подвергают каскадированию для удаления агрессивной двуокиси углерода. При этом вода насыщается кислородом, который окисляет Fe2* до Fe3+, что облегчает образование защитных пленок.
Эванс отмечает, что успехи, достигнутые в Англии при защите оцинкованных труб методом каскадирования воды, как раз обусловлены удалением из воды двуокиси углерода.
Воду, содержащую агрессивную двуокись углерода, можно также обработать щелочью в количестве, которое необходимо для осаждения карбоната кальция. Он осаждается в виде тонкого мелового покрытия. Мягкие кислые воды, содержащие малые количества кальция, обрабатывают карбонатом кальция, доломитом, известковым молоком.
При недостатке свободной С02 происходит распад части бикарбонатных ионов, повышение концентрации карбонатных ионов, которые реагируют о ионами кальция, выделяя из воды осадок карбоната кальция по уравнению
Саа+ + С01~——- »• СаС03 (8-9)
Вода с равновесной концентрацией свободной СО2 является стабильной.
Концентрацию (в мг/л) свободной двуокиси углерода определяют по формуле
где Щобщ — общая щелочность воды, определенная титрованием соляной или серной кислотой в присутствии метилового оранжевого (при pH < 8,4 она равна концентрации НС03); К—константа диссоциации угольной кислоты первой ступени; [і — ионная сила раствора.
Для пресных вод с общим содержанием солей до 1000 мг/л р,=0,0000Р (где Р — общее содержание солей в воде, мг/л).
Равновесную концентрацию свободной СОг определяют по формуле
[С02]равн = АЩ2о6щ (8,11)
А=Кг [Са2Н/(КіПРсаСО3-103 V» + 5’96) (8,12)
где Кг—константа диссоциации угольной кислоты второй ступени; ПРсасо3 — произведение растворимости СаСОз (для 20СС равно 5,22-109).
Таким образом, рассчитав по (8,10) и (8,12) концентрацию свободной двуокиси углерода в воде, можно судить об агрессивных свойствах воды и определить ее способность к карбонатным отложениям.
Для практических целей более удобным является метод расчета, предложенный Ланжелье [153]. По этому методу рассчитывают по данным химического анализа значения pH, соответствующие равновесному состоянию в растворе углекислых соединений. Эта величина обозначается через рНВас и означает pH равновесного насыщения воды карбонатом кальция:
рНнас = РКг — р ПРcaCOg — lg [Са2+] — lg [Щобщ] + 2,5ц + 7,6 (8,13)
где [Са2+] — концентрация ионов кальция, мг/л; [Щобщ] — общая щелочность воды, мг-экв/л, определяемая по расходу кислоты на титрование пробы воды с фенолфталеином и метиловым оранжевым.
Сравнив вычисленное значение рНнас с измеренным значением pH, можно сказать, насколько система отклонилась от равновесного состояния. Если
pH < рНнас (8,14)
то содержание С02 в воде выше равновесной концентрации. Такая вода является коррозионно-активной как по отношению к металлу, так и к бетону (растворяет входящий в состав бетона карбонат кальция). В такой воде возможность осаждения на стенках водопроводов защитной карбонатной пленки исключается. Если
рН>рНяас (8,15)
концентрация свободной двуокиси углерода в воде ниже равновесного значения. Такая вода является коррозионно-неактивной,
из нее может осаждаться на стенках водопроводов карбонатная защитная пленка. По Ланжелье [153], условия стабильности воды определяются с помощью индекса насыщения /
/ = РН-рН„ас (8,16)
При pH > рНнас индекс насыщения положительный и вода не является агрессивной. В этом случае вода пересыщена карбонатом кальция и способна осаждать на поверхности водопроводов’ карбонатные отложения. При рН<рННас индекс насыщения является отрицательным. Такая вода агрессивна, поскольку она не способна образовывать карбонатные отложения на поверхности металла. Более того, если они были осаждены на поверхности водопровода ранее, такая вода будет их растворять, оголяя металл. При pH = рНнас индекс насыщения / = 0, вода является стабильной. Она не образует карбонатных отложений и не растворяет их. Таким образом, для осаждения на поверхности водопровода карбонатной защитной пленки необходимо, чтобы вода имела положительный индекс. Это обычно делается в первый период эксплуатации водопровода. Для сохранения сформировавшейся защитной пленки необходимо индекс насыщения воды снижать и держать его близким к нулю. При отрицательном индексе насыщения воды карбонатная пленка начинает растворяться. Длительно поддерживать индекс насыщения воды на положительном уровне нельзя, поскольку при этом образуются толстые карбонатные слои, уменьшающие пропускную способность водопроводов.
Стабилизацию іводьі с положительным индексом насыщения производят с помощью технической серной или соляной кислот. Необходимое количество кислот (в мг/л) для воды с исходными значениями pH <8,4 определяется по формуле
D = ДЩ7 100/Р = ІООаЩобщІ/Р (8,17)
АЩ — сбЩобщ
где ДЩ — снижение щелочности воды при подкислении до состояния стабильности; I — эквивалентная масса кислоты (49 мг/мг-экв для H2SO4 и 36 мг/мг-экв для НС1); Р — содержание H2SO4 и НС1 в технической кислоте, % (масс.); а — коэффициент, зависящий от pH воды и индекса насыщения (находится по специальному графику [152]).
Необходимое количество кислоты (в мг/л) для воды с исходным значением рН0>8,4 (вода, умягченная известью или известью с содой) рассчитывается по формуле
Я=100/Ф/Р (8,18)
где Ф — щелочность воды по фенолфталеину.
Количество кислоты для стабилизации такой воды приблизительно равно щелочности воды по фенолфталеину.
Стабилизацию воды с отрицательным индексом, т. е. воды, содержащей агрессивную двуокись углерода, производят с помощью щелочи. Количество добавляемой щелочи должно быть таким,
чтобы после связывания части С02 в ионы НСОз по уравнению С02 + 0Н-—vHC03 наступило равновесное состояние между С02 и НСОз. При отыскании требуемого количества щелочи необходимо различать два случая: когда рН0<рННао<8,4 и когда рН0< <8,4<рННас. Для первого случая количество щелочи определяют ;[ 152] по формуле
о1 = 1ыцт/р = фщ0бщЩР (8,19)
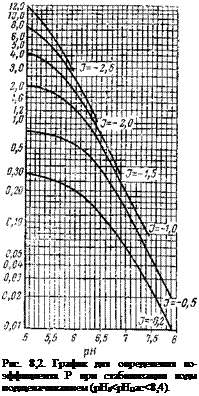
где I — эквивалентная масса щелочи, равная для NaOH 40 мг/мг-экв.-для Na2C03 53 мг/мг-экв, для Cai(OH)2 28 мг/мг-экв (в пересчете на СаО); Р — содержание активного вещества в техническом продукте, %; (5 — коэффициент (определяется по графику рис. 8,2); Щ0вщ — общая щелочность исходной воды, мг-экв/л; 5 Щ — необходимое увеличение щелочности воды для стабилизации, .мг-экв/л.
Для второго случая, характерного для маломинерализованных вод с повышенной коррозионной активностью[14]
Я2 = /(Х + | + Я?)Щобщ100/Р (8,20)
где х и і — коэффициенты, зависящие от рНо и рНнас соответственно (определяются по графику рис. 8,3); Щ0 бщ—общая щелочность исходной воды до ее обработки, мг-эив/л.
Для наращивания защитной карбонатной пленки необходимо индекс насыщения воды карбонатом кальция поддерживать на уровне 0,5+0,7. Приближенные формулы для расчета количеств реагентов (в мг/л), необходимых для поддержания/=+0,7, имеют следующий вид: при рНнас<7,7
![]() Щобщ^со? (5*10 l) 100/ . 220Щобщ-Ю-у + сСо2 J~
Щобщ^со? (5*10 l) 100/ . 220Щобщ-Ю-у + сСо2 J~
где ссо2 — концентрация свободной С02 в воде до ее обработки, мг/л
При рНнас >7,7
где
Обработку воды для получения необходимого индекса насыщения можно производить известковым молоком, едким натром и содой. Одновременно рекомендуется вводить 0,5—1,5 мг/л гекса
метафосфата натрия для ограничения скорости наращивания пленки на начальных участках водопроводной сети. Скорость движения воды в трубах для образования прочной пленки рекомендуется поддерживать не менее 0,8 м/с.
 Стабилизацию воды, содержащую агрессивную СОг (отрицательный индекс насыщения), можно также осуществить, пропуская ее через дробленый мрамор или полуобожженный доломит. При фильтровании воды через мраморную крошку протекает реакция (8,8), обеспечивающая содержание СОг, близкое к равновесной концентрации. Для осаждения карбоната кальция необходимо дополнительно подщелачивать воду известью. Расход мраморной крошки составляет 2,3 г на 1 г связываемой агрессивной СОг.
Стабилизацию воды, содержащую агрессивную СОг (отрицательный индекс насыщения), можно также осуществить, пропуская ее через дробленый мрамор или полуобожженный доломит. При фильтровании воды через мраморную крошку протекает реакция (8,8), обеспечивающая содержание СОг, близкое к равновесной концентрации. Для осаждения карбоната кальция необходимо дополнительно подщелачивать воду известью. Расход мраморной крошки составляет 2,3 г на 1 г связываемой агрессивной СОг.
![]()
![]() Еще более эффективных результатов ‘можно добиться, используя полуобожженный доломит (MgO-СаСОз). При фильтровании воды через такой зернистый продукт, называемый магнемассой, связывание двуокиси углерода происходит по реакциям
Еще более эффективных результатов ‘можно добиться, используя полуобожженный доломит (MgO-СаСОз). При фильтровании воды через такой зернистый продукт, называемый магнемассой, связывание двуокиси углерода происходит по реакциям
2СОа + MgO + Н20 ——— * Mg(HC03)2
С02 + СаС03 + Н20 ——— Са(НСОз)2
Основная масса двуокиси углерода связывается окисью магния, остальная часть — карбонатом кальция.
§ 2. УДАЛЕНИЕ ИЗ ВОДЫ КОРРОЗИОННО-АКТИВНЫХ АГЕНТОВ
Из рассмотрения механизма коррозионного процесса явствует, что основным катодным процессом при коррозии металлов в нейтральных электролитах является реакция восстановления кислорода. Поэтому если исключить эту реакцию или сильно ее затормозить, можно практически полностью подавить коррозионный процесс. На практике этот метод широко используется. В частности, процесс подготовки воды для атомных и обычных электростанций включает как один из обязательных элементов удаление кислорода. При этом в зависимости от состава конструкционных
|
|
материалов и допустимой скорости коррозии содержание кислорода в воде снижают до 0,05н-0,1 мг/л. При особых требованиях к воде можно концентрацию кислорода снизить и до 0,02 мг/л.
Удаление кислорода из воды можно осуществить тремя методами:
1) введением в воду химических соединений (восстановителей) , которые необратимо связывают кислород;
2) фильтрованием воды через электронообменные смолы или другие вещества, способные окисляться кислородом;
3) термической деаэрацией.
Одним из давно известных методов химического удаления кислорода из воды является введение в ее состав сульфита натрия, который взаимодействует с кислородом по реакции
2Na2S03 + 02 ——- ► Na2S04 (8,26)
Этот метод является весьма эффективным особенно при повышенных температурах воды; по данным [152], полного удаления кислорода из воды можно достигнуть за 1—2 мин при Т= =95-~ 100 °С при 5% избытке сульфита натрия против стехиометрического значения. Процесс можно сильно ускорить, если ввести в воду в качестве катализаторов соли меди или кобальта; опыт показывает, что при добавлении 0,001 мг/л кобальта или 1 мг/л меди скорость удаления кислорода увеличивается в десятки раз. При этом можно обойтись без избытка сульфита натрия, а сам процесс обескислороживания вести при нормальной температуре.
Для химического обескислороживания воды можно также использовать сернистый газ, гидросульфит ЫагБгС^ и тиосульфат ЫагБгОз натрия. Последние окисляются растворенным в воде кислородом до сульфата натрия. Сернистый газ вступает в реакцию с бикарбонатом кальция, образуя сернистый кальций, который, взаимодействуя с растворенным в воде кислородом, окисляется до сульфата кальция по реакциям:
S02 + Са(НС03)2 ——- ► CaS03 + 2СОа| + Н20 (8,27)
2CaS03 + 02 ——— v 2CaS04 (8,28)
Обескислороживание воды сернистым газом, гидросульфитом натрия и тиосульфатом натрия также катализируется солями кобальта и меди. Рекомендуется вводить медный купорос (2,5 мг/л) или сернистый кобальт (0,003 мг/л). Расчет необходимого количества (в мг/л) сульфита натрия или сернистого газа производится по формуле [152]
а = 1 ,ip [02] (8,29)
где р — расход реагента на связывание 1 мг/л кислорода (для безводного Na2S03 Р=7,9; кристаллического Na2S03-7 Н20 Р=16, S02 р=4); [02]—концентрация
кислорода, мг/л.
Применение сернистого ангидрида для обескислороживания воды является, на наш взгляд, небезопасным средством, поскольку сернистый ангидрид является сильным катодным деполяризатором, усиливающим коррозию. Поэтому он может привести к сильной коррозии аппаратуры, в которой производится процесс водоподготовки, а при избытке может вызвать и коррозию энергетических или иных установок. Следует учесть, что химическое обескислороживание воды рассмотренными выше реагентами хотя и является эффективным, но имеет один существеный недостаток: при окислении химических соединений кислородом в воде возникают сульфаты, которые сами по себе являются агрессивными агентами; накопление их в воде нежелательно. Поэтому за последнее время для обескислороживания воды начали применять в основном гидразин (N2H4) или гидразингидрат (ЫгН^НгО). Последние, являясь сильными восстановителями, взаимодействуют с кислородом по реакции
N2H4 + 02——— > 2НаО + N2 (8,30)
Преимущество гидразина перед другими восстановителями состоит в том, что конечным продуктом является азот, который легко удаляется из воды и не является коррозионно-активным агентом. Теоретически 1 мг гидразина связывает 1 мг кислорода. Однако обычно берут избыток гидразина (1—2 мг/мг Ог). Гидразингидрат выпускается в виде 35%-ного водного раствора. В воду же его добавляют в виде 0,5—1%-ного раствора. Обескислороживание воды идет быстро при высокой температуре (80—100°С); при более низких требуется вводить катализаторы (марганец, медь, кобальт). По сообщениям [150], фирма Байер (ФРГ) выпускает препарат (левоксин) с катализатором, который при с = =50 мг/л и pH = 10 практически полностью восстанавливает кислород, растворенный в воде при нормальной температуре.
К химическим методам обескислороживания воды также относится и метод фильтрования воды через стальную стружку, обработанную слабым раствором серной или соляной кислоты и промытую горячей водой. При фильтровании горячей воды через такую стружку обескислороживание происходит за счет окисления гидрозакиси железа до гидроокиси
4Fe(OH)2 + 02 + 2Н20 ——— v 4Fe(OH)3 (8,31)
При использовании этого метода вода должна быть предварительно умягчена (жесткость не выше 0,05 мг-экв/л). В противном случае стружка быстро покрывается карбонатными отложениями и процесс обескислороживания прекращается.
Красильщиков с сотр. [154, с. 471] предложил электрохимический метод обескислороживания воды. Заключается он в том, что вода пропускается через электролизер, в котором на одном электроде происходит восстановление кислорода по реакции
02 + 2Н20 — ь 4е~ ——— > 40Н~ (8,32)
а на другом — анодное растворение железа с последующим окислением гидрозакиси железа, возникающей в объеме, кислородом по реакции (8,31). Расход электроэнергии составляет 0,2 кВт-ч/м3 при содержании 8 мг/л кислорода в воде.
На принципе использования специальных восстановителей и ионов металлов низшей валентности таїкже основывается метод удаления кислорода с помощью электронообменных смол (ЭО) и электроноионообменных смол (ЭИ). Последние наряду с восстановительными свойствами обладают также ионообменными свойствами. Электронообменные смолы представляют собой продукты конденсации пиррогаллола, гидрохинона, пирокатехина или гидразина с фенолом или формальдегидом. Примером подобного поглотителя кислорода может служить смола ЭО-11, представляющая собой медную форму сульфокатионита, содержащего координационно связанный гидразин. Регенерация электронообменных смол производится 1—2%-ным раствором тиосульфата или сульфита натрия. Сорбционная способность смол, выпускаемых нашей промышленностью, по кислороду составляет: 450 мг-энв/л для ЭО-6; 600-^800 мг-экв/л для ЭО-7 и 5000 мг-экв/л для ЭО-11.
Электроноионообменные смолы (ЭИ) представляют собой катиониты или аниониты, на которых осаждают соединения меди и железа низшей валентности. При пропускании через них воды кислород связывается благодаря окислению ионов низшей валентности до ионов более высокой валентности. Примером подобного катионита, содержащего железо и медь, может служить смола ЭИ-12, которая способна поглотить 45 г кислорода на 1 м3 смолы. Аниониты после их обработки растворами сульфита или аммиаката меди также приобретают свойство поглощать кислород (до 5 кг на 1 м3 анионита). Регенерация подобного анионита после потери им восстановительной способности производится с помощью гидросульфита натрия.
Кроме химических методов удаления кислорода широкое применение находят и физические методы деаэрации. Они используют эффект уменьшения растворимости кислорода с повышением температуры (табл. 8,1).
Если заставить воду кипеть, то из нее практически выделится весь кислород. Процесс можно ускорить, если деаэрацию производить в тонком слое электролита. Для этих целей в термических деаэраторах воду разбрызгивают. Процесс обескислороживания можно еще более интенсифицировать, если его вести в вакууме.
|
Таблица 8,1. Растворимость кислорода в воде при различных температурах [суммарное давление воздуха и паров воды 0,1 мПа (1 кгс/см2)]
|
В вакуумных деаэраторах вода разбрызгивается на специальные насадки из колец Рашига, а внутри деаэратора (стальной цилиндрический резервуар) с помощью вакуум-насосов или паро — или водоструйных эжекторов создают необходимый вакуум. Вакуумные деаэраторы, по [152], были с успехом применены в Австрии для защиты от коррозии крупного водопровода (0=750 мм и L=560 км) и позднее в штате Луизиана (США) для защиты от коррозии водопровода производительностью 15000 м3/сут.
Уменьшить коррозию можно также посредством замедления другой реакции, лежащей в основе коррозионного процесса, а именно—анодной. Для этого необходимо из состава воды удалить те анионы, которые образуют с железом и другими металлами хорошо растворимые соединения и облегчают анодное растворение. Таковыми являются в основном хлориды и сульфаты. В последнее время в связи с совершенствованием техники обессоливания воды этот метод борьбы с коррозией стал технически осуществим и экономически оправдан. Он применяется при гидроиспытаниях сложнейшей аппаратуры и приборов, когда остатки солей могут отрицательно сказаться на дальнейшей работе аппаратуры, а также в процессе подготовки воды для электростанций, нужд пищевой промышленности, производства искусственных волокон и т. д. Обессоленная вода в сочетании с деаэрацией также находит применение в охладительных системах ускорителей, где требуется высокое удельное сопротивление (р>106 Ом-см), а также в электровакуумной промышленности при производстве полупроводниковых материалов и т. д.
В связи с этим рассмотрим вкратце основные методы обессоливания воды [155—159]. Снижение концентрации солей в воде до нескольких мг/л может быть достигнуто дистилляцией, ионным обменом и электродиализом. Термическая дистилляция известна давно и не требует особых пояснений, что же касается ионного обмена, то он основан на свойстве нерастворимых в воде полимерных органических кислот и оснований (катионитов и анионитов) обменивать содержащиеся в воде ионы на Н+- и ОН—ионы. В результате содержащиеся в воде соли после фильтрации через Н-катионитный фильтр превращаются в соответствующие кислоты:
[Кат] Н — f NaCl —— >- [Кат] Na + НС1 (8,33)
2 [Кат] Н + Na2S04 ——- >■ 2 [Кат] Na + H2S04 (8,34)
Последующее пропускание воды через анионит вызывает сорбцию сильных кислот
[Ан] ОН + НС1 —- ► [Ан] С1 + н20 (8,35)
2 [Ан] ОН + H2S04 —— V [Ah]2S04 + 2Н20 (8,36)
![]()
Когда емкость Н-катионитного фильтра исчерпана, его регенерируют 1-7-1,5%-ным раствором кислоты
а анионитные фильтры — 2-у 4% -ным раствором щелочи или кальцинированной соды
[Ah]2S04 + 2NaOH ——- »- [2Ан] ОН — f Na2S04 (8,38)
[Ah]2S04 + Na2C03 ——- >■ [Ah]2C03 + Na2S04 (8,39)
Обессоливание ионным обменом выгодно производить для вод с содержанием солей менее 800—1000 мг/л. По данным [152], если Н-‘катионитный фильтр одноступенчатой установки загружен суль — фоуглем, а анионитный фильтр — слабоосновным анионитом, то такая обессоливающая установка снижает содержание солей со 100—300 мг/л до 2—10 мг/л.
Для более глубокого обессоливания необходимо пользоваться двухступенчатой установкой, включающей две ступени Н-катиони — роваиия, а также слабо — и сильноосновные (для удаления кремниевой кислоты) анионитные фильтры. Содержание солей при этом может быть снижено со 100—400 мг/л до 0,1—0,2 мг/л, в том числе содержание кремниевой кислоты до 0,02—0,1 мг/л[15]. Полного обессоливания воды можно достигнуть на трехступенчатой ионит — ной установке. Наша промышленность (выпускает в настоящее время готовые установки для обессоливания воды.
 4 сентября, 2015
4 сентября, 2015  admin
admin 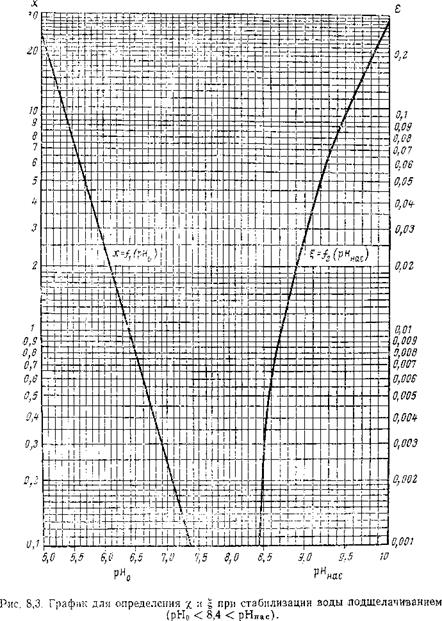
 Опубликовано в рубрике
Опубликовано в рубрике 