Ингибирующие свойства нитрита натрия сильно зависят от концентрации агрессивных ионов в электролите. «В связи е этим были изучены его защитные свойства как в разбавленных электролитах (30 мг/л NaCl + 70 мг/л Na2S04), имитирующих пресные воды, так и в концентрированных электролитах (0,1 н. Na2S04).
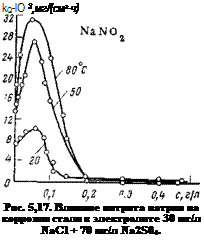
На рис. 5,17 представлена зависимость скорости общей коррозии стали в разбавленном электролите от концентрации нитрита натрия. Кривые, как видно, проходят через максимум, указывающий на то, что малые концентрации стимулируют коррозионный процесс. При некоторой концентрации, которую можно назвать критической, коррозия достигает максимального значения и далее начинает падать. При определенной концентрации, которая называется защитной, коррозионный процесс полностью приостанавливается. Как видно, нитрит натрия может усиливать не только истинную скорость коррозии, но и скорость общей коррозии.
Объясняется это тем, что нитрит натрия способен при неполной защите выводить более значительную часть поверхности из сферы анодной реакции и благодаря этому сильнее смещать потенциал к положительным значениям, чем другие ингибиторы. Скорость коррозии на той небольшой части электрода, которая осталась в активном состоянии, будет сильно возрастать.
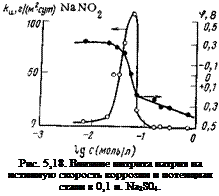
 Это хорошо иллюстрирует рис.
Это хорошо иллюстрирует рис.
5,18. Как видно, зависимость истинной скорости коррозии от концентрации NaN02 характеризуется кривой с более резко выраженным максимумом: при неполном заполнении поверхности пассивирующими ионами ингибитор выступает в качестве стимулятора, увеличивая истинную скорость коррозии почти на два порядка. При концентрациях ингибитора выше критической скорость коррозии начинает резко падать. Механизм усиления коррозии малыми концентрациями нитрита натрия такой же, как и у других рассмотренных выше анодных ингибиторов.
Электродный потенциал стали с изменением концентрация ингибитора меняется следующим образом: малые концентрации ингибитора слабо изменяют значение потенциала; при -—-5-10—2 моль/л отмечается резкое смещение потенциала в положительную сторону, которое сопровождается увеличением истинной скорости коррозии. Дальнейшее увеличение концентрации ингибитора вызывает сдвиг потенциала в положительную сторону, однако не такой сильный, как малые и средние концентрации.
 |
Если по данным рис. 5,18 построить кривую зависимости истинной скорости растворения стали от потенциала, получим поляризационную кривую с тремя характерными участками (рис. 5,19). На первом участке, простирающемся от стационарного потенциала до ф = 0,0 В (потенциал частичной пассивации), электрод находится в активном состоянии; смещение ингибитором потенциала в положительную сторону в соответствии с законами электрохимической кинетики приводит к увеличению скорости коррозии. На втором участке кривой металл находится в активно-пассивном
Такая закономерность в электрохимическом поведении стали объясняется тем, что смещение ингибитором потенциала стали от стационарного до потенциала частичной пассивации обусловлено в основном ускорением катодной реакции, в то время как смещение потенциала металла от потенциала частичной пассивации до потенциала полной пассивации обусловлено уже в значительной степени торможением анодной реакции. В области потенциалов, характерных для активного растворения, ускорение катодной реакции не столь велико, чтобы сместить потенциал металла до потенциала полной пассивации (основным катодным деполяризатором здесь является кислород и токи восстановления малы), и поэтому металл остается в активном состоянии.
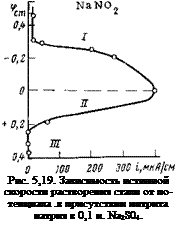 По мере смещения потенциала металла за потенциал частичной пассивации начинают все более и более проявляться пассивирующие свойства нитрит-ионов по отношению к анодной реакции, что облегчает переход металла в пассивное состояние. В пользу этого механизма указывает то обстоятельство, что степень заполнения ингибитором поверхности и, следовательно, исключение ее из сферы анодной реакции растет лишь до потенциала частичной пассивации. В области потенциалов, характерной для активнопассивного состояния, степень заполнения поверхности ингибирующим ионом не меняется, и, значит, эффективность катодного процесса остается постоянной. Падение скорости анодного процесса по мере смещения потенциала в положительную сторону является лишь следствием проявления пассивирующих свойств анионов по отношению к анодной реакции.
По мере смещения потенциала металла за потенциал частичной пассивации начинают все более и более проявляться пассивирующие свойства нитрит-ионов по отношению к анодной реакции, что облегчает переход металла в пассивное состояние. В пользу этого механизма указывает то обстоятельство, что степень заполнения ингибитором поверхности и, следовательно, исключение ее из сферы анодной реакции растет лишь до потенциала частичной пассивации. В области потенциалов, характерной для активнопассивного состояния, степень заполнения поверхности ингибирующим ионом не меняется, и, значит, эффективность катодного процесса остается постоянной. Падение скорости анодного процесса по мере смещения потенциала в положительную сторону является лишь следствием проявления пассивирующих свойств анионов по отношению к анодной реакции.
В отсутствие агрессивных ионов (дистиллированная вода) защитная концентрация нитрита натрия лежит, по данным разных авторов, в интервале 10”5—10-4 моль/л.
Защитные концентрации нитрита натрия зависят от температуры. Характер изменения коррозии в зави-
|
|
|
|
|
симости от концентрации при высоких температурах (50—80°С) такой же, как при комнатной. Однако стимулирующее влияние малых концентраций при повышенных температурах более резко выражено (см. рис. 5,17).
Изменение скорости коррозии железа с ростом температуры происходит в отсутствие ингибитора по закону, уже неоднократно отмечавшемуся в литературе: непрерывный рост коррозии наблюдается при повышении температуры до 50—60 °С; при дальнейшем повышении температуры скорость коррозии вследствие уменьшения растворимости кислорода падает. При введении в электролит нитрита натрия картина меняется: при малых концентрациях, не достаточных для полного подавления процесса, коррозия с ростом температуры непрерывно увеличивается. Вполне возможно, что при повышенных температурах перенапряжение для реакции восстановления нитрита натрия уменьшается; ингибитор начинает с небольшой скоростью восстанавливаться, поэтому ограниченная растворимость кислорода уже не может стать тем фактором, который лимитирует скорость коррозии.
Однако и при повышенных температурах увеличение концентрации нитрита натрия приводит к уменьшению скорости коррозии, которая при определенной концентрации полностью подавляется. О защитных свойствах нитрита натрия при повышенных температурах можно судить по следующим данным: при 25 °С защита стали в дистиллированной воде достигается при 2-Ю-4 моль/л, а при 70°С — 5-Ю-3 моль/л.
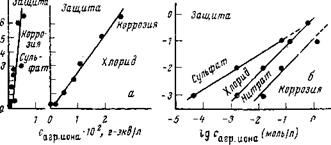
Защитные концентрации нитросоединений для стали непосредственно зависят от концентрации агрессивных ионов. В частности, установлено, что между концентрацией сульфат — и хлорид-ионов и защитными концентрациями 3,5-динитробензоата гексаметиленимина имеется линейная зависимость. Для сульфата отношение агрессивного иона к концентрации динитробензоата амина равно примерно 1 : 1, а для хлорида — 1:3 (рис. 5,20 а).
В работе [97] было установлено, что логарифмическая зависимость защитных концентраций нитрита натрия от концентраций агрессивных ионов выражается прямыми линиями, разграничивающими области коррозии и защиты (рис. 5,20 6). Наклон кривых определяется характером аниона. Для одновалентных ионов (хлорид и нитрат) он равен ~1,0, а для двухвалентного (сульфат) ~0,6.
Сильнее всего защитные свойства нитрит-иона подавляются сульфат-ионами, слабее — нитрат-ионами. Поэтому для одной и той же концентрации агрессивного иона при наличии сульфата требуется более высокая концентрация нитрита натрия, чем при наличии нитрата. Для подавления коррозии в присутствии хлорида требуется меньшая концентрация нитрита натрия, чем в присутствии сульфата. По мере повышения концентрации агрессивных ионов разница во влиянии сульфата и хлорида уменьшается, а между хлоридом и нитратом остается. Если исключить высокие концентрации ионов, то по агрессивности они расположатся в следующий ряд: сульфат>хлорид>нитрат. Аналогичные зависимости были получены и в других работах, хотя отношения ингибирующего компонента к агрессивному несколько отличались (табл. 5,3).
Как видно, при отношении концентраций ингибитора к хлористому натрию, равном 0,4, защиты не наблюдается. При отношениях, больших 0,7, достигается полная защита. В тех случаях, когда сталь предварительно выдерживали в хлористом натрии, а потом вводили нитрит натрия, защита не достигалась и при отношениях, равных 0,7-j-2,0.
Эти данные становятся понятными, если вспомнить результаты опытов с хроматами, описанные на стр. 165. Предварительная выдержка стали в агрессивном неингибированном электролите неблагоприятно сказывается на защите, поскольку адсорбция хлорид-ионов затрудняет адсорбцию пассивирующего иона. При совместном присутствии агрессивного и пассивирующего иона в результате конкурирующей адсорбции адсорбируется преимущест-
|
Таблица 5,3. Зависимость защитных свойств нитрита натрия от концентраций хлористого натрия [98]
|
венно пассивирующий ион. Иными словами, нитрит-иону, очевидно, труднее вытеснить с поверхности электрода уже занявший место хлорид-ион, чем не дать ему адсорбироваться.
В пользу этого предположения свидетельствуют значения потенциалов, которые, несомненно, связаны с количеством адсорбированного пассиватора. Когда перед пассивацией нитритом натрия предварительно адсорбируются агрессивные ионы, значение потенциала не превышает -1-0,16 В. Это значение характерно для стали, находящейся на границе активно-пассивного состояния.
При наличии в электролите различных агрессивных ионов, например хлоридов и сульфатов, защита достигается при концентрации нитрита натрия превышающей, как правило, суммарную концентрацию агрессивных ионов. Когда отношение концентрации ингибитора к суммарной концентрации агрессивных ионов меньше единицы, наблюдается коррозия [98]. Для чистого раствора хлорида и металла с неудаленной окисной пленкой для полной защиты достаточно, чтобы отношение [NaN02]/[NaCl] = = 0,4; для образцов, с которых окисная пленка была удалена, это отношение равно ~0,7. Более высокие концентрации нитрита натрия, необходимые для защиты стали от коррозии при одновременном присутствии сульфата и хлорида, по сравнению с концентрацией нитрита, которая требуется при защите от влияния индивидуального агрессивного иона, объясняется авторами ускорением гидролиза Fe(OH)2 за счет увеличения ионной силы раствора. Насколько это достоверно, сейчас сказать трудно.
Защитная способность нитрита натрия (10~2 моль/л), по данным различных авторов, сохраняется при следующих максимальных концентрациях хлорида (в моль/л): 8-Ю-3 (Хор, морская вода), 1,9-10-2 (Прайор и Коэн), 2• 10-2 (Мерсер с сотр.), 3,2- • 10-2 (Матсуда, Улиг), 3,2-10-2 (Вахтер) и 1,4 10-1 (Хор, капельные испытания).
Отмечается [97] также, что нитрит натрия более эффективен в подавлении агрессивных свойств хлоридов по сравнению с бензоатом и хроматом. В присутствии сульфатов нитрит примерно так же эффективен, как и хромат. По отношению к нитрат-ионам эффективность различных ингибиторов возрастает в следующем ряду: хромат>бензоат>нитрит.
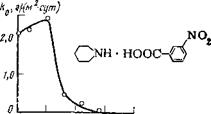
Из других соединений, содержащих группу N02 и используемых в качестве ингибиторов коррозии, известны нитрит дициклогексиламина (НДА) и соли нитробензойных кислот. Зависимость скорости коррозии стали от концентрации нитробензоата пиперидина представлена на рис. 5,21. При малых концентрациях ингибитора скорость общей коррозии увеличивается; истинная скорость коррозии возрастает еще в большей степени. Начиная с концентрации 0,01 моль/л коррозия падает и при -—- 0,1 моль/л полностью прекращается. С увеличением концентрации агрессивных ионов защитная концентрация всех солей нитробензойных кислот возрастает. Так, для 1 н. Na2SC>4 защитная концентрация нитробензоата
гексаметиленимина равна 0,5 моль/л при наличии на поверхности стали воздушнообразованной пленки. В тех же случаях, когда пленка с электрода удаляется методом травления, полная защита стали от коррозии в этом же электролите достигается при 3—5 моль/л нитробензоата гексаметиленимина. Это указывает на определенную роль в пассивации фазовых окисных слоев.
![]()
![]()
![]()
 Анодное растворение стали в присутствии нитрит-ионов протекает с большим перенапряжением, которое заметно возрастает по мере увеличения концентрации ингибитора (рис. 5,22). При малых плотностях тока наблюдается аномальное поведение электрода, что обусловлено разрушением естественной окисной пленки. Оно исчезает, когда концентрация ингибитора становится соизмеримой с концентрацией агрессивных ионов. По-видимому, большие концентрации способствуют сохранению естественной окисной пленки на железе.
Анодное растворение стали в присутствии нитрит-ионов протекает с большим перенапряжением, которое заметно возрастает по мере увеличения концентрации ингибитора (рис. 5,22). При малых плотностях тока наблюдается аномальное поведение электрода, что обусловлено разрушением естественной окисной пленки. Оно исчезает, когда концентрация ингибитора становится соизмеримой с концентрацией агрессивных ионов. По-видимому, большие концентрации способствуют сохранению естественной окисной пленки на железе.
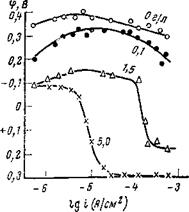 По мере увеличения концентрации ингибитора стационарный потенциал стали смещается в положительную сторону, а поляризуемость электрода возрастает. Чем больше концентрация ингибитора, тем при меньшей плотности тока наступает перегиб на поляризационной кривой, сопровождающийся сильным сдвигом потенциала в положительную сторону.
По мере увеличения концентрации ингибитора стационарный потенциал стали смещается в положительную сторону, а поляризуемость электрода возрастает. Чем больше концентрация ингибитора, тем при меньшей плотности тока наступает перегиб на поляризационной кривой, сопровождающийся сильным сдвигом потенциала в положительную сторону.
Однако этот сдвиг потенциала продолжается лишь до определенного значения, по достижению которого электрод активируется. Чем ниже концентрация ингибитора, тем при более отрицательном потенциале активируется электрод. Это, несомненно, обусловлено вытеснением хлорид-ионами с поверхности анода пассивирующих ионов. По мере смещения потенциала в положительную сторону должна облегчаться адсорбция как пассивирующих, так и активирующих ионов. Очевидно,
ЧТО При более положительных по — Рис. 5,22. Влияние добавок нитри-
тенциалах адсорбция хлорид-ионов та натр? ї? на ан°лное растворение г Ух ґ стали. (Состав электролита: ОД н.
сильнее, чем адсорбции паосивиру — NaCI+0,53 г/л, Na2CO3+0,42 г/л
ющих ионов, в результате чего NaHC03; рН=9).
178
электрод активируется. Чаще всего активация носит локальный характер.
Пассивирующие свойства нитрит-ионов большинство авторов связывает с образованием на поверхности стали окисной пленки РегОз, которая затрудняет процесс анодного растворения. Наличие такого окисла было подтверждено экспериментально. Спорным остается лишь вопрос о его происхождении. Согласно точке зрения, изложенной выше, пассивирующий окисел появляется на поверхности металла в результате окисления низшего окисла в более высокий кислородом воды. Нитрит-ионы, адсорбируясь на поверхности, уменьшают лишь свободную энергию системы и этим облегчают пассивацию.
Однако имеется и другая точка зрения: в частности, в работе [98] утверждается, что пассивное состояние наступает благодаря эффекту осаждения гидрата окиси железа. По мнению авторов, образование окислов железа с участием нитрит-ионов протекает по следующим реакциям.
Образование низшего окисла
N0; + 8Н+ + 6е~ = NH4 + 2Н20 (5,1)
9Fe(OH)2 3Fe304 + 6Н20 + 6Н+ + 6Г (5,2)
2На0 *=±: 2Н++ 20Н“ (5,3)
9Fe(OH)2 + N02" = 3Fe304 + NH4 4- 20H“ + 6H20 (5,4)
Образование высшего окисла
N02" + 8Н+ — f — 6Г = NH4 + 2Н20 (5,5)
6Fe(OH)2 2Fe304 + 4Н20 + 4Н+ + 4е~ (5,6)
2Fe304 + Н20 3 (y-Fe203) + 2Н+ + 2е~ (5,7)
2Н20 2Н+ + 20Н’ (5,8)
6Fe(OH)2 + NO2 = 3 (Y-Fe203) -f NH4 + 3H20 — f — 20Н" (5,9)
Как видно, предлагаемый авторами механизм пассивации сводится к окислению нитрит-ионами гидрата окиси железа и осаждению его на поверхности железа. Осаждение коллоидных мицелл гидроокиси может наступить в присутствии нитрит-ионов, по мнению авторов, уже при pH = 6,2—6,4. Поскольку ионы аммония, как было выше показано, не обнаруживаются в электролите, авторы высказывают предположение, что в аэрируемом электролите ионы аммония окисляются кислородом с регенерацией нитритионов по уравнению
NH4 — г 4Н20 — г 7202 — no; — f ЗН20 — г 2Н+ (5,10)
Таким образом, адсорбированные нитрит-ионы как бы катализируют реакцию окисления двухвалентного железа до трехвалентного кислородом, а сами регенерируются. Экспериментальные данные не позволяют пока с полной уверенностью выбрать какой-либо из предлагаемых механизмов пассивации, но мы склоняемся больше в пользу первого механизма, поскольку осаждение гидрата окиси железа из электролита, как неоднократно отмечал Эванс, вряд ли может обеспечить пассивацию.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 