Бензоат натрия (СбНвСОСЖа) давно применяется в качестве ингибитора коррозии. Его достоинства заключаются в том, что он защищает от коррозии не только сталь, но и некоторые цветные металлы. Поскольку бензоат натрия не является окислителем, мало вероятно, чтобы он ‘мог усиливать коррозию благодаря непосредственному участию в катодном процессе при концентрациях, недостаточных для полного подавления коррозии. Кроме того, по мнению Гейтоса [99], бензоат натрия, а также циннамат натрия (C6H5CH = CHCOONa) не образуют в противоположность неорганическим ингибиторам (силикаты, карбонаты, фосфаты) нерастворимых соединений и по этой причине они также не должны приводить к локальной коррозии.
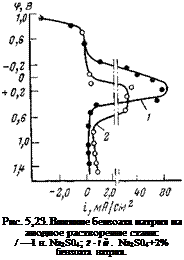
Потенциостатические исследования кинетики анодного растворения железа (рис. 5,23) показали, что анион бензойной кислоты оказывает сильное влияние на скорость анодного растворения железа. Даже в концентрированном растворе сульфата (1 н.) бензоат натрия при концентрации, равной 7-1СН моль/л, вызывал сильную анодную поляризацию, сдвигал потенциал пассивации в положительную сторону и уменьшал ток пассивации примерно на два порядка. Такое пассивирующее влияние бензоата натрия в присутствии кислорода объясняется тем, что анион бензойной кислоты СбТКСОО" образует, с железом через карбоксильные группы прочную химическую связь. Это уменьшает реакционную способность значительной части атомов железа на поверхности и облегчает пассивацию остальной части кислородом воды. На катодную реакцию, как й ожидалось, бензоат влияния не оказывает.
Защитные свойства бензоатов зависят от природы катиона. Например, бензоат диэтиламина (ДЭА) хуже защищает сталь, чем бензоат натрия, а катионы циклогексиламин (ЦГА), пиперидин (ПП) и гексаметиленимин (ГМИ), наоборот, облегчают защиту. Бензоат гексаметиленимина и пиперидина, кроме того, хорошо защищают медь. Аналогичными свойствами обладает и бензоат дициклогексиламина, но его растворимость ниже, поэтому в концентрированных растворах электролита, где требуются высокие концентрации ингибиторов, его защитные свойства ниже, чем у других бензоатов.
Эффективность бензоатов как ингибиторов находится в зависимости от pH, которое они создают в электролите:
Катион ингибитора. . ДЭА ЦГА ДЦГА ГМИ ПП Na
pH при cum=0,3 моль/л 3,25 7,00 6,45 6,75 6,75 7,0
Слабые защитные свойства бензоата диэтиламина, несомненно, связаны с низким значением pH. Остальные бензоаты имеют
примерно одинаковые pH, поэтому различия в их защитных свойствах следует приписать влиянию природы катиона.
 Бензоат натрия был подробно изучен в качестве ингибитора коррозии авторами работ [97]. Минимальная защитная концентрация для стали в дистиллированной воде зависит, в противоположность другим ингибиторам, от предварительной подготовки поверхности: наименьшая концентрация ингибитора (Ю~4 моль/л) требуется для защиты стали, которая предварительно протравлена в азотной кислоте, наибольшая — для стали, подвергшейся дробеструйной обработке (10-3 моль/л). Азотная кислота заметно пассивирует поверхность, поэтому
Бензоат натрия был подробно изучен в качестве ингибитора коррозии авторами работ [97]. Минимальная защитная концентрация для стали в дистиллированной воде зависит, в противоположность другим ингибиторам, от предварительной подготовки поверхности: наименьшая концентрация ингибитора (Ю~4 моль/л) требуется для защиты стали, которая предварительно протравлена в азотной кислоте, наибольшая — для стали, подвергшейся дробеструйной обработке (10-3 моль/л). Азотная кислота заметно пассивирует поверхность, поэтому
после обработки ею стали требуется меньшая концентрация ингибитора для полной защиты от коррозии. Особенно четко это проявляется у ингибиторов, которые не обладают окислительными свойствами. Дробеструйная обработка сильно увеличивает поверхность, поэтому при адсорбции ингибитора для полного заполнения поверхности требуется более высокая концентрация. Для
![БЕНЗОАТЫ Подпись: Ц [о2] (мг/л) Рис. 5,24. Влияние концен-трации кислорода на крити-ческое значение pH, необхо-димое для защиты железа эт коррозии бензоатом натрия.](/img/1208/image222.gif) шлифовальных образцов необходимо 10-5 моль/л, для травленых в соляной кислоте— 10~2 моль/л.
шлифовальных образцов необходимо 10-5 моль/л, для травленых в соляной кислоте— 10~2 моль/л.
По наблюдению авторов, при концентрациях ниже защитных наблюдается преимущественно общая коррозия. Защита зависит и от pH раствора: при
pH = 7 она достигается при меньших концентрациях (5-Ю-4 моль/л), чем при рН = 5,2 — 5,7 (МО-3 моль/л).
Влияние pH электролита — на защитные свойства бензоата натрия было также изучено Шлайманом и Девисом [100]. Было установлено, что в зависимости от pH раствора потенциал стали в бензоатных растворах (0,01—0,1 н.) может принимать различные значения (+0,15 В при pH = 8,5 и —0,45 В при pH = 5,5). Интервал изменения потенциала может достигнуть ~0,60 В.
Сильное изменение потенциала происходит при рН = 6. Отсюда делается вы
вод, что в воздушной атмосфере защита бензоатом натрия легче всего достигается при pH, превышающих это критическое значение. Однако, по мнению авторов, защита бензоатом натрия может быть успешно осуществлена и при более низких значениях pH. Для этого требуется заметно повысить концентрацию кислорода в электролите (рис. 5,24).
Минимальные концентрации кислорода, обеспечивающие защиту железа в 0,1 н. растворе бензоата натрия при разных pH, приведены ниже:
pH……………………………….. 5,38 5,50 5,80 6,08 6,72
ссо2.мг/л……………………….. 38,1 25,0 16,8 8,0 3,4
К сожалению, эти результаты были получены в отсутствие агрессивных ионов. Насколько справедлива эта закономерность в присутствии, например сульфата и хлорида, сказать пока трудно.
О сильном влиянии кислорода на защитные свойства бензоата натрия неоднократно упоминалось в литературе. Имеются также экспериментальные данные, указывающие на то, что в отсутствие кислорода защита вообще невозможна. Изучение электродных потенциалов стали [100] подкрепляет эту точку зрения. В деаэрированных растворах бензоата натрия (0,1 н.) потенциал стали держится на уровне —0,50 В, в то время как в этом же электролите, насыщенном воздухом, он устанавливается на уровне +0,10 В.
![]()
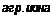
![]()
![]()
 Влияние посторонних агрессивных ионов на защитные свойства бензоатов изучал Гейтос [99]. В воде, содержавшей 17 мг/л NaCl, защита достигается при 0,05% (масс.) бензоата. При увеличении концентрации NaCl до 200 мг/л сталь активируется и защита достигается при более высоких концентрациях ингибитора [0,1%. (масс.)].
Влияние посторонних агрессивных ионов на защитные свойства бензоатов изучал Гейтос [99]. В воде, содержавшей 17 мг/л NaCl, защита достигается при 0,05% (масс.) бензоата. При увеличении концентрации NaCl до 200 мг/л сталь активируется и защита достигается при более высоких концентрациях ингибитора [0,1%. (масс.)].
 Этот же вопрос изучался в работе [97]. Если изобразить зависимость между концентрацией бензоата натрия и максимально допустимой концентрацией агрессивных ионов, не вызывающих коррозию, в логарифмических координатах, то она будет иметь линейный характер (рис. 5,25). Наклон прямых зависит от природы аниона; для одновалентных агрессивных ионов С1~ и NO3 отношение концентрации бензоата к аниону равно ~1, а для
Этот же вопрос изучался в работе [97]. Если изобразить зависимость между концентрацией бензоата натрия и максимально допустимой концентрацией агрессивных ионов, не вызывающих коррозию, в логарифмических координатах, то она будет иметь линейный характер (рис. 5,25). Наклон прямых зависит от природы аниона; для одновалентных агрессивных ионов С1~ и NO3 отношение концентрации бензоата к аниону равно ~1, а для
высоких концентрациях эта зависимость становится несколько иной (хлорид>сульфат>
 >нитрат).
>нитрат).
В присутствии агрессивных ионов при недостаточных для полного подавления коррозии концентрациях ингибитора коррозия носит локальный характер. В особенности это проявляется в присутствия хлорида и нитрата. В сульфате локальный характер коррозии выражен менее четко и проявляется он значительно реже, чем в хлористых и нитратных растворах. Локальный характер коррозии в присутствии бензоата не приводит, однако, по мнению автора, к столь глубоким питтинговым поражениям, как в присутствии хромата и нитрита натрия.
 Температура электролита оказывает существенное влияние на защитные свойства бензоата натрия: с повышением температуры защитная концентрация бензоата натрия возрастает. Она составляет при 40 °С 10_3 моль/л вместо 5* 10—4 моль/л при 25 °С и 10~4 моль/л при 5 °С. Однако начиная с 40 °С и до 80 °С, уже нет заметной разницы в значениях защитных концентраций. Очевидно, в данном случае большое значение приобретает растворимость кислорода, которая с ростом температуры падает. Защитная концентрация бензоата натрия может быть снижена при перемешивании электролита или продувке через него воздуха.
Температура электролита оказывает существенное влияние на защитные свойства бензоата натрия: с повышением температуры защитная концентрация бензоата натрия возрастает. Она составляет при 40 °С 10_3 моль/л вместо 5* 10—4 моль/л при 25 °С и 10~4 моль/л при 5 °С. Однако начиная с 40 °С и до 80 °С, уже нет заметной разницы в значениях защитных концентраций. Очевидно, в данном случае большое значение приобретает растворимость кислорода, которая с ростом температуры падает. Защитная концентрация бензоата натрия может быть снижена при перемешивании электролита или продувке через него воздуха.
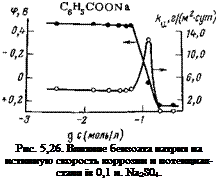
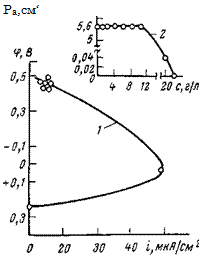
Исследование защитных и пассивирующих свойств бензоата натрия показало, что этот ингибитор в широкой области концентраций (от 0,5 до 10 г/л для 0,1 н. Na2SC>4) не изменяет ско — Рис. 5,27. Зависимость истинной ско — рость коррозии и электродный роста коррозии стали (/) от потен — потенциал стали (рис. 5,26). Обвішала в присутствии бензоата натрия ясняется это тем, что он не пас — в 0,1 н. ‘Na2S04 и изменение активной,
части электрода с изменением концеи- сивирует электрод частично (рис.
трации бензоата «атрия.(2). 5,27, кривая 2) подобно другим
ингибиторам. Лишь при приближении к защитным концентрациям отмечается рост истинной скорости коррозии, которая при последующем увеличении концентрации ингибитора падает до нуля. В связи с этим в присутствии бензоата натрия получается весьма своеобразная диаграмма зависимости скорости коррозии от потенциала (рис. 5,27) (построена по данным рис. 5,26): одному и то-му же потенциалу (~—0,5 В) соответствуют одинаковые скорости коррозии и лишь по достижению потенциала +0,05 В отмечается рост истинной скорости коррозии. Полная защита стали от коррозии достигается при ~0,25 В. .
Эти особенности бензоата натрия, несомненно, связаны с тем, что он не обладает окислительными свойствами и не образует труднорастворимых соединений с железом. Благодаря этому он в широкой области концентраций не приводит к частичной пассивации электрода и не представляет серьезной опасности даже в том случае, когда концентрация ингибитора по каким-либо причинам снижается ниже защитной.
Исследование молекулярного механизма действия бензоата натрия с помощью радиоактивных индикаторов (14С) показало, что в зависимости от концентрации бензоата количество адсорбированного на поверхности железа бензоата меняется oY 2 -10~8 до 4,8 • Ю"8 г/см2. Количество адсорбированного ингибитора, по мнению Гейтоса, часто не превышает 0,1 молекулярного слоя, причем 7з этого количества адсорбируется обратимо. В связи с этим высказывается мнение, что защита в значительной степени связана с наличием окисной пленки и защитные свойства ингибитора проявляются лишь в дефектных местах.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 