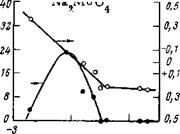
Защитные свойства молибдата натрия в 0,1 н. Na2S04 хорошо иллюстрирует рис. 5,14. Малые концентрации до определенного критического значения увеличивают интенсивность коррозии, большие ее уменьшают до весьма малых значений. При 5-Ю-2 моль/л коррозия полностью прекращается. В более разбавленных растворах (30 мг/л NaCl + 70 мг/л Na2S04) требуются совсем малые концентрации ингибитора (200 мг/л), чтобы полностью подавить коррозионный процесс. С увеличением концентрации хлорида (200 мг/л) защитная концентрация ингибитора возрастает до 1000—2000 мг/л. Если сравнивать защитные концентрации различных ингибиторов, то для молибдата они наименьшие.
С введением в электролит молибдата натрия электродный потенциал стали непрерывно сдвигается в положительную сторону вплоть до защитной концентрации. С дальнейшим увеличением концентрации ингибитора потенциал стали практически не меняется (см. рис. 5,14). Сопоставление кривой изменения интенсивности коррозии с кривой изменения потенциала показывает, что сдвиг потенциала в положительную сторону может сопровождаться как увеличением интенсивности коррозии, так и ее уменьшением. Поэтому по одному изменению потенциала судить о коррозии нельзя.
Исследование анодной реакции ионизации металла (рис. 5,15) показало, что малые добавки хотя и смещают потенциал в положительную сторону, однако поляризуемость электрода меняется мало. Все это указывает на то, что сдвиг потенциала в положительную сторону обусловлен, очевидно, в основном изменением кинетики катодного процесса. Большие концентрации ингибитора (1—2 г/л) способствуют сильной анодной поляризации электрода, что связано со специфической адсорбцией ингибитора и упрочнением химической связи по мере смещения потенциала в положи
кцуф^сут) у> з Исследование зависимости
![]()
![]()
 скорости растворения стали от потенциала методо м х им ич е с ко й пассивации также свидетельствует о различном механизме действия малых и больших концентраций молибдата натрия; смещение потенциала стали в положительную сторону от стационарного значения приводит вначале к ускорению анодной реакции, как и следовало ожидать, исходя из представлений электрохимической кинетики. Однако ускорение реакции наблюдается лишь до определенного потенциала (—0,1 В), после чего наступает замедление процесса. При потенциале ~ +0,2 В электрод полностью пассивируется. Как уже указывалось, основным катодным деполяризатором, обеспечивающим
скорости растворения стали от потенциала методо м х им ич е с ко й пассивации также свидетельствует о различном механизме действия малых и больших концентраций молибдата натрия; смещение потенциала стали в положительную сторону от стационарного значения приводит вначале к ускорению анодной реакции, как и следовало ожидать, исходя из представлений электрохимической кинетики. Однако ускорение реакции наблюдается лишь до определенного потенциала (—0,1 В), после чего наступает замедление процесса. При потенциале ~ +0,2 В электрод полностью пассивируется. Как уже указывалось, основным катодным деполяризатором, обеспечивающим
осаждение пассивирующего окисла, и в этом случае является растворенный в электролите кислород.
Что касается возможности непосредственного, а не косвенного участия молибдата натрия в формировании защитных пассивирующих слоев, в состав которых входят окислы молибдена низшей валентности, то на этот вопрос электрохимические исследования однозначного ответа пока не дают. Если сравнить катодные поляризационные кривые, полученные в буферном электролите при исследовании реакции восстановления кислорода в отсутствие молибдата натрия и при его нали- ‘ чии в растворе, то можно обна — %в
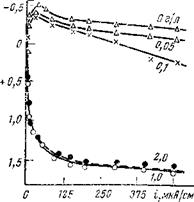 ружить небольшое увеличение предельного диффузионного тока и снижение перенапряжения для реакции в кинетической области.
ружить небольшое увеличение предельного диффузионного тока и снижение перенапряжения для реакции в кинетической области.
Однако связывать это уверенно с реакцией восстановления молибдата пока нельзя, поскольку никаких перегибов на кривых, которые бы указывали на появление нового процесса деполяризации, не отмечено. Кривая катодной поляризации смещается в положительную сторону, по-видимому, благодаря пассивации поверхности, возникающей вследствие специфической адсорбции, Рис — Влияние молибдата
я не воротя нов гтения ингибитопя натрия на анодное растворение
а не восстановления ингиоитора. стали в карбонатно-бикарбо-
В отрицательной области потен — натном буфере (рН=9).
циалов в присутствии молибдата отмечается небольшое снижение перенапряжения реакции, что, возможно, связано с участием молибдата в катодной деполяризации вследствие его восстановления.
§ 4. ВАНАДАТЫ
Электрохимическое и коррозионное поведение металлов в присутствии ванадатов различно и зависит от состава последних. Поведение ортованадата натрия Na.-iVC^ ничем не отличается от поведения рассмотренных выше ингибиторов с общим анионом типа МО?" (рис. 5,16 а), а поведение метаванадата натрия NaV03, наоборот, существенно отличается. Метаванадат по мере увеличения его концентрации в растворе непрерывно уменьшает скорость коррозии, не приводя к увеличению ее интенсивности. При концентрации 0,25 моль/л коррозия стали в 0,1 н. Na2S04 полностью приостанавливается (рис. 5,166). Такое удивительное поведение ингибитора связано с тем, что он. не выводит из сферы анодной реакции часть поверхности электрода, пока металл не переходит полностью в пассивное состояние. Растворение происходит по всей поверхности. Этот ингибитор не косвенно, а непосредственно влияет на кинетику анодной реакции; эффективность катодного процесса при этом не изменяется, что сказывается на характере изменения потенциала (см. рис. 5,166). В широкой области концентраций метаванадат натрия не оказывает влияния на электродный потенциал; последний остается таким же, как и в фоновом электролите. При этом различным скоростям растворения соответствуют одинаковые значения потенциала.
Такая ситуация может возникнуть в двух случаях: во-первых, когда анодный процесс протекает без какого-либо перенапряжения (неполяризуемый анод), а катодный процесс тормозится; во — вторых, когда наблюдается одновременно торможение как катодной, так и анодной реакции примерно в одинаковой степени. Последний механизм является наиболее вероятным. Метаванадат не может ускорить катодную реакцию, поскольку он не приводит к строгой дифференциации электрохимических реакций по поверхности электрода. Кроме того, как показали исследования, анодный процесс ингибитором замедляется. На основании этого постоянное значение потенциала в широкой области концентрации ингибитора не может быть объяснено наличием неполяризуемого анода.
Изучение зависимости скорости коррозии от потенциала методом химической пассивации показало, что на поляризационной кривой отсутствует участок активного растворения. При введении уже первых порций метаванадата натрия сталь находится на границе активно-пассивного состояния. Поскольку этот ингибитор в широкой области концентраций не изменяет площадь, на которой протекает анодная реакция растворения (см. рис. 2,23), он не увеличивает эффективности катодного процесса. Уменьшение скорости коррозии в условиях, когда потенциал остается постоянным, объ-
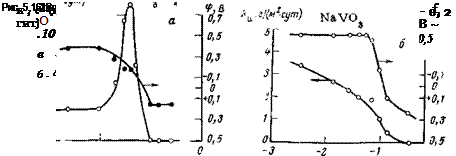 |
ясняется тем, что ’ингибитор при малых концентрациях тормозит обе электродные реакции. По мере приближения концентрации ингибитора к защитной отмечается сильный сдвиг потенциала в положителыную сторону, т. е. ингибитор начинает преимущественно тормозить анодную реакцию ионизации металла.
Метаванадат натрия в широких пределах концентраций не приводит к локализации коррозионного процесса, поэтому он не усиливает ни скорость общей коррозии, ни ее интенсивность. В этом отношении он имеет преимущества перед другими ингибиторами. Его следует отнести к безопасным ингибиторам. Потенциал полной пассивации у метаванадата примерно такой же, как у других ингибиторов. Отсюда можно сделать вывод, что природа пассивирующего окисла для этих ингибиторов одна и та же.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 