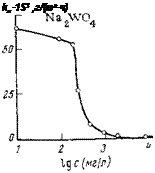
О защитных свойствах вольфрамата натрия можно судить по рис. 5,11. Малые концентрации ингибитора увеличивают интенсивность коррозии; максимальное значение наблюдается при 0,01 моль/л (0,1 н. Na2SOi). При дальнейшем увеличении концентрации этого ингибитора интенсивность коррозии падает. Для полного подавления процесса требуется «0,075 моль/л.
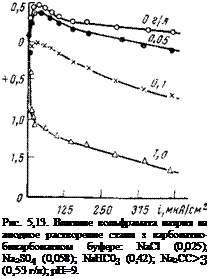
Если взять другие электролиты, например смесь 30 мг/л NaCl + 70 мг/л Na2S04, имитирующая обычные пресные воды, то картина будет примерно такая: малые концентрации ингибитора (до 200 мг/л) слабо изменяют общую коррозию; при концентрации 500 мг/л коррозия резко уменьшается, а при 2000 мг/л она полностью прекращается (рис. 5,12).
В буферном электролите (pH = 9) защита сильно облегчается и уже первые порции ингибитора (100 мг/л) очень сильно уменьшают коррозию. Защитная концентрация ингибитора уменьшается при этом в 2 раза (1000 мг/л вместо 2000 мг/л). С увеличением концентрации хлорида (200 мг/л) защита затрудняется и для полного подавления коррозии концентрацию ингибитора требуется увеличить в несколько раз.
Потенциал стали линейно смещается в положительную сторону с ростом логарифма концентрации ингибитора, как в области концентраций, которые увеличивают интенсивность коррозии, так и тех, которые замедляют коррозию. Полная защита стали от коррозии достигается при потенциале +0,2 В (см. рис. 5,11).
Сдвиг потенциала в положительную сторону, сопровождающийся увеличением интенсивности коррозии (см. восходящую ветвь кривой коррозии), возможен лишь в том случае, когда эффективность катодного процесса возрастает. В то же время спад потенциала, сопровождающийся уменьшением интенсивности коррозии, может быть вызван лишь уменьшением скорости анодной реакции.
Рис. 5,11. Влияние вольфрамата натрия на истинную скорость коррозии и потен-
циал стального электрода в 0,1 н. Na2S04.
Рис. 5,12. Влияние вольфрамата натрия на скорость общей коррозии в пресной
воде (30 мг/л NaCl + 70 імг/л Na2S04).
Поэтому, сопоставляя результаты опытов по изменению необратимых электродных потенциалов и интенсивности коррозии, можно прийти к заключению, что увеличение интенсивности коррозии при добавлении малых количеств вольфрамата обусловлено увеличением эффективности катодного процесса. Уменьшение интенсивности коррозии при добавлении больших концентраций ингибитора, превышающих критические, вызвано замедлением анодной реакции ионизации металла.
Исследование кинетики анодной реакции ионизации металла методом гальваностатической поляризации в буферном электроли-
![]()
 |
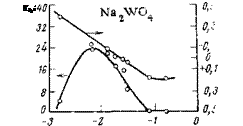 |
те (рН=9) показало, что при добавке 1 г/л вольфрамата наблюдается сильная анодная поляризация стали (рис. 5,13). Малые концентрации ингибитора,, хотя и смещают потенциал в положительную сторону, однако не оказывают существенного влияния на анодную поляризуемость стали. Это подтверждает вывод, сделанный при изучении этого же вопроса методом химической пассивации, о преимущественном влиянии малых концентраций ингибитора на эффективность катодного процесса.
При увеличении концентрации агрессивного иона в электролите пассивирующие свойства вольфраматов сохраняются, однако для того, чтобы заполяризовать.
стальной электрод до потенциала +1,3-=—[-1,4 В, требуются более высокие концентрации ингибитора (при 200 мг/л NaCl— 15 г/л Na2W04).
Усиление малыми концентрациями вольфрамата натрия интенсивности коррозии нельзя объяснить его деполяризующей ролью по отношению к катодному процессу. Исследование реакции восстановления этого ингибитора на железном катоде в буферном электролите показало, что он не восстанавливается в нейтральных электролитах на железе. Более того, даже при отрицательных потенциалах, когда казалось он мог уже восстанавливаться, перенапряжение катодной реакции возрастало. Поэтому увеличение истинной скорости растворения стали малыми концентрациями вольфрамата объясняется ростом эффективности катодного процесса восстановления кислорода, а не ингибитора.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 