Мембранные методы разделения смесей основаны на избирательной пропускающей способности пористых тел — свойстве пористых тел пропускать предпочтительнее одни вещества, чем: другие. В соответствии с движущей силой переноса вещества мембранные методы можно разделить на диффузионные, электрические и гидродинамические. Иногда движущие силы переноса вещества совмещают для ускорения переноса или улучшения разделения. К диффузионным методам относят газовую диффузию и диализ. Под действием электрического поля протекает электродиализ. Гидродинамическими методами являются фильтрация, ультрафильтрация и обратный осмос.
В каждом методе применяются соответствующие мембраны. Различия в прохождении веществ через мембраны могут быть связаны как с равновесными, так и с кинетическими свойствами разделяемой системы. По этому признаку мембраны подразделяют на фильтрационные (полупроницаемые) и диффузионные. Первые из них способны разделять вещества в равновесных условиях, размер их пор соизмерим с размерами проникающих частиц или молекул. Диффузионные мембраны обычно применяют для разделения газов методом газовой диффузии. Размер пор у них должен быть таким, чтобы обеспечивать кнудсенов — ский поток газов через мембраны. Фильтрационные мембраны в свою очередь можно классифицировать на макропористые, пе — реходнопористые и микропористые (подобно адсорбентам). Микропористые мембраны могут быть нейтральными или ионитов ы ми.
Мембраны готовят из различных материалов: полимерных пленок, пористого стекла, керамики, металлической фольги, ионообменных материалов. Наибольшее применение получили мембраны на основе полимеров: ацетата целлюлозы, поливинилхло — рида, полистирола, полиамидов и др. Первые искусственные мембраны были получены в начале шестидесятых годов из ацетата целлюлозы. Жизнедеятельность организма человека и других живых существ поддерживается благодаря поступлению питательных веществ через тонкие стенки кишок — биологические мембраны. Избирательная проницаемость биологических мембран обеспечивает доступ нужных организму веществ в легкие и другие органы.
Применяемые для разделения мембраны должны обладать хорошей селективностью (разделяющей способностью), высокой проницаемостью (удельной производительностью), стойкостью к действию среды, механической прочностью и т. д.
Метод газовой диффузии основан на том, что в кнудсенов — ском газовом потоке молекулы движутся независимо друг от друга. Отношение потоков разделяемых газов [см. уравнение 4(IV. 112)3 характеризует коэффициент разделения:
»І/»Ї=Р’л = УШЩІ (IV. 120)
.’где Afj и Мг — молекулярная масса компонентов газовой смесн.
Р с IV16- ^ выводу уравнения для диффузионного потока прн диализе
Из соотношения (IV. 120) следует, что эффективность разде — газов зависит только от различия их молекулярных масс. "Iе соотНОшение является следствием молекулярно-кинетиче — й TPODHH; оно аналогично закономерности, экспериментально
СКОИ ‘^ г v vi v г< »
Тановленнои в середине XIX века 1 рэмом, который показал, о скорость прохождения газа через пористую перегородку в 4 KvvM обратно пропорциональна квадратному корню из моле-
Кулярной массы.
Легкие молекулы обладают большей скоростью, чем тяжелые опекуны, и чаще сталкиваются с пористой диафрагмой (мем — б аной). чТО способствует их предпочтительному прохождению Р Hge. Чтобы обеспечить режим кнудсеновской диффузии, 4 аметр отверстий в диафрагме должен быть меньше!/ю сред — Дрго свободного пробега молекул. Таким образом, метод газовой диффУзни основан на рэзличии кинетических свойств разделяемых газов.
Этот метод был впервые применен в 1932 г. для разделения топов неона. В настоящее время он широко применяется для "аздеЛениЯ изотопов урана 235 и 238 (р,/2= 1,0043); уран пред — а ительно превращают в газообразный гексафторид урана, сублимирующий при 56 °С.
Диализ—метод разделения компонентов раствора, основания различной диффузии их через мембрану. Этот метод няется главным образом для отделения частиц золей, нё ПР * дЯщих через мембрану, от истинно растворенных веществ?, ПР ш0 диффундирующих через нее. Диализ проводят как fc хо? альной, так и с ионитовой мембраной. 1
|
Рис. IV. 17. Принципиальная схема электродналнзатора с одной мембраной |
Пля вывода уравнения диффузионного потока при диализё нейтральной мембраной рассмотрим схему, представленную на пис. IV. 16. Обозначим концентрации диффундирующего ве — ества в растворах по обе стороны от мембраны через сх и с%. Так как возможна адсорбция, то концентрации вещества ira бране с обеих сторон ее соответственно равны ся и Cjfe. Бу еМ считать, что адсорбция подчиняется закону Генри, тогд’а
СмІС = См2Іс2=*Кт ■ Если пренебречь сопротивлением прилегающих диффузных слоев, то по закону Фика диффузионный поток вещества через мембрану будет равен:
. Рм(См — С Мі) РмКг(с — С2) …. ‘ ‘
1=1-.————- J————- =3————— J———————————- (IV.121)
Где Р„ — коэффициент диффузии в мембране; I — толщина мембраны.
Из уравнения (IV. 121) следует, что диффузионный поток через мембрану тем интенсивнее, чем больше коэффициент диффузии в мембране DM, константа Генри /Сг. разность концентраций по обе стороны мембраны и чем меньше толщина мембраны I. Если с одной стороны мембраны концентрация будет равна нулю (с2 = 0), то поток переносимого вещества будет пропорционален концентрации С.
Ионитовая мембрана специфична к диффузии ионов разного знака заряда. При диффузионном переносе сильного электролита (с катионом и анионом) его распределение между поверхностью мембраны и объемом раствора должно подчиняться уравнению Доннана (IV.58) и (III.154), тогда для одно-одновалентного электролита имеем:
СмііСе + СмО^Ка^ (IV. 122)
Где се — емкость ионитовой мембраны.
Принимая, что Се~>смі, получим:
См, се=кс21 и смі = кс2і/се (IV. 123)
С учетом выражения (IV.123) уравнение Фика для потока электролита принимает вид:
Рм(см1 — см2) РМК , .
» «=—— Ї——- {с~<?г)
Или
|
(IV. 124) |
РМК A C(Ct +с2)
I
В отличие от диффузии в нейтральной мембране при диффузии в ионитовой мембране поток электролита уменьшается с увеличением емкости мембраны. Если концентрация электролита с одной стороны мембраны с2->- 0, то получим, что поток электролита во столько раз меньше потока неэлектролита, во сколько раз емкость мембраны больше концентрации электролита с другой стороны мембраны сJ.
Иначе протекает диффузия отдельных ионов через ионитовую мембрану. Для катионитовой мембраны можно пренебречь диффузией анионов. Чтобы через катионитовую мембрану диффундировали катионы, с одной ее стороны должны находиться катионы одной природы, с другой стороны мембраны — другие ка-
Тцоны, т. е. должна быть обеспечена ионообменная диффузия (в соответствии с условием электронейтральности). Таким образом, поток одних ионов в одну сторону должен быть равен потоку других ионов в противоположную сторону. Рассуждая так же, как и при рассмотрении диффузии неэлектролитов, и учитывая, что Кг = сеК, получим выражение для потока катионов при условии равенства их концентраций с обеих сторон мембраны:
DMceK ‘
T= ■ у (iv .125)
Из уравнения (IV. 125) следует, что поток катионов через ка — тионитовую мембрану тем больше, чем больше емкость мембраны се и ее сродство (/С) к данному иону. Таким образом, иони — товая мембрана препятствует диффузии электролитов, но пропускает соответствующие ионы (противоионы).
Электродиализ — диализ, обусловленный миграцией ионов через мембрану под действием приложенной разности потенциалов (электромиграцией). На рис. IV. 17 показана схема электродиализатора, представляющего собой сосуд, разделенный мембраной М, по обе стороны которой находятся электроды; на электроды подается напряжение постоянного электрического поля.
Рассмотрим принцип электродиализа на примере переноса хлорной кислоты НСЮ4 через различные мембраны. Если пропустить через водный раствор хлорной кислоты количество электричества, равное числу Фарадея (96 485 Кл/моль), то по закону Фарадея на электродах должно выделиться по 1 экв элементов водорода и кислорода. При электродиализе на катоде протекает процесс восстановления ионов Н+, а на аноде в результате окисления молекул воды они накапливаются:
Н++Є — —>• VaHa t; ‘/гН20 — е — —* ‘/402+Н+ (IV.126)
Одновременно через раствор осуществляется перенос катионов (к катоду) и анионов (к аноду), количества которых пропорциональны их числам переноса T+ и T_ — долям электричества, переносимым ионами данного вида Л = <7;/<7, где Q — количество электричества, переносимого всеми ионами (^+-f^_=l).
Если мембрана нейтральная, то числа переноса для раствора НС104 равны /h+5=s4/5 и <cio4~’/5. В соответствии с этим в катодном пространстве в результате восстановления количество лонов Н+ уменьшается на 1 экв Н+, поступает из анодного пространства 4/б экв Н+ и уходит в анодное пространство Vs экв СЮ4- В итоге из катодного пространства уйдет Vs экв НС104. В анодном пространстве в результате окисления появится 1 экв Н+, уйдет в катодное пространство 4/s экв Н+ и придет из катодного пространства Vs экв С104_. В итоге в анодном пространстве появится Чь экв НСЮ4. Таким образом, при электродиализе с нейтральной мембраной происходит накопление хлорной кислоты в анодном пространстве.
Если в рассмотренном процессе использовать анионообм«н — ную мембрану, то переносом электричества катионами водорода можно пренебречь, тогда число переноса для перхлорат-иона будет равно единице, т. е. электричество будет переноситься только этими ионами. В катодном пространстве при тех же условиях в результате восстановления содержание Н+ уменьшится на 1 экв и в анодное пространство перейдет 1 экв CIO4-. Одновременно в анодном пространстве появится в результате окисления 1 экв ионов Н+ и придет в него из катодного пространства 1 экв ионов CIO4- Таким образом, концентрирование хлорной кислоты в анодном пространстве с ионитовой мембраной идет в 5 раз быстрее (выход по току), чем с нейтральной мембраной. Если электродиализ проводить с катионитовой мембраной, непроницаемой для анионов, то Н+-ионы, которые генерируются в анодном пространстве и проходят через мембрану, будут восстанавливаться в катодном пространстве. В итоге концентрирования кислоты происходить не будет.
Электродиализ часто проводят с двумя ионообменными мембранами (катионитовой у катода и анионитовой у анода). В этом случае из среднего отделения электродиализатора, куда вводят раствор электролита, будут уходить как катионы, так и анионы. Этот вариант используется, например, для очистки гидрозолей от примеси электролитов. Электродиализ применяют и при некоторых синтезах. Например, при поступлении в среднее отделение диализатора раствора Na2S04 на катоде будет образовываться NaOH, а на аноде H2S04.
Фильтрация — процесс разделения суспензии с помощью пористой перегородки (мембраны), через которую под давлением проходит жидкая фаза (фильтрат), а частицы суспензии задерживаются (осадок). Перепад давления Ар может создаваться гидростатическим давлением слоя суспензии (до 50 кПа), вакуумом (остаточное давление 50—90 кПа), или давлением сжатого воздуха (не более 300 кПа). Общее дифференциальное уравнение фильтрации подобно уравнению для потока в пориСтом теле {см. например (IV. 101)]:
|
|
(iv. 127)
Где V — объем фильтрата; s — площадь фильтра (пористой перегородки); і — время фильтрования; rj — вязкость жидкости (среды); I — толщина слоя осадка; K — коэффициент проницаемости, учитывающий проницаемость осадка и пористой перегородки.
Величина, обратная коэффициенту проницаемости K, характеризует сопротивление осадка и пористой перегородки.
При стационарном режиме фильтрования (Ap = const, I = = const или Ap/l=const) объемная скорость накопления фильтрата постоянна, а объем фильтрата пропорционален времени фильтрования (IV. 127).
-При нестационарном фильтровании происходит накопление осадка на фильтре, поэтому скорость фильтрации непрерывно уменьшается со временем. Если концентрация поступающей на фильтрование суспензии с остается постоянной, то масса осадка на фильтре должна быть пропорциональна объему отфильтрованной жидкости m = cV. Толщину слоя осадка можно выразить соотношением
L=am=acV (1V.128)
Где а — коэффициент рыхлости осадка.
Подставляя значение I из этого уравнения в (IV.127), разделяя переменные и интегрируя, получим:
Или
Lg V=o+0,5 lg т (IV. 1301
Где о — постоянная, включающая все параметры уравнения (IV.129), кроме времени.
При интегрировании предполагалось, что а — постоянная величина, т. е. структура осадка не изменяется во время фильтрования. Если же структура осадка изменяется, то от времени будет зависеть и величина а. Коэффициент проницаемости, включая и а, зависит от природы суспензии, от ее способности образовывать рыхлые или плотные структуры.
Ультрафильтрация предназначена для концентрирования лио — золей, растворов полимеров и их очистки от низкомолекулярных веществ. От обычного фильтрования она отличается главным образом размером пор мембраны: поры мембраны для ультрафильтрации не должны превышать размеров частиц золя. Поэтому перепады давлений при ультрафильтрации достигают 1- • 103 кПа и выше. Кроме того, этим методом получают более концентрированный лиозоль (суспензию), а не осадок, который образуется при обычном фильтровании. Механизм ультрафильтрации близок к обычному фильтрованию или просеиванию.
Обратный осмос — процесс фильтрования (концентрирования) растворов под давлением. При обратном осмосе применяют микропористые мембраны и для преодоления их сопротивления необходимо давление до 10 МПа и выше. Кроме сопротивления мембраны в. процессе разделения преодолевается действие осмотического давления л, направленного в другую сторону (отсюда и название процесса — обратный осмос). Таким образом, перепад давления при обратном осмосе равен:
Ар=рм+п (IV.131)
Где рм—давление, необходимое для преодоления сопротивления мембраны.
Механизм проницаемости при обратном осмосе значительно сложнее, чем при ультрафильтрации. В порах лиофильной мембраны находится связанная вода (при фильтрации водных растворов), которая уменьшает размеры пор и препятствует прохождению сильно гидратированных ионов. В то же время лио — фильность мембраны способствует прохождению молекул воды.
Основными характеристиками ультрафильтрации и обратного осмоса являются проницаемость и селективность мембран. Проницаемость (или удельная производительность) выражается количеством фильтрата V, отнесенным к единице времени т И единице поверхности s мембраны:
G=V/Sr (IV.132)
Селективность определяют (в %) по следующей формуле:
<р*= Cl~C2 100=! — -^-j 100 (IV.133)
Где с і и с2 — концентрация растворенного вещества или дисперсной фазы соответственно в исходной смеси и в фильтрате.
Из формулы (IV. 133) следует, что при 100%-ной селективности мембрана пропускает только растворитель. Как правило, увеличение концентрации фильтруемой системы приводит к снижению проницаемости и селективности мембраны. В то же время G и ф увеличиваются с повышением давления, конечно же, до определенного предела. Так как через мембрану преимущественно проходит растворитель, то у ее поверхности значительно увеличивается концентрация растворенных или диспергированных веществ. Это явление называется концентрационной поляризацией. Оно может привести к снижению скорости процесса, к осаждению растворенного вещества и коагуляции дисперсной фазы, к порче мембраны. Основной способ предотвращения концентрационной поляризации — интенсивное перемешивание фильтруемой системы.
 2 ноября, 2012
2 ноября, 2012  admin
admin 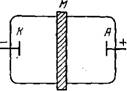
 Опубликовано в рубрике
Опубликовано в рубрике 