Движущей силой адсорбции является разность химических потенциалов компонентов в объеме и на поверхности, которые в Ходе адсорбции выравниваются. В результате наступает адсорбционное равновесие. Процесс адсорбции в одних системах может протекать очень быстро, а в других — сравнительно медленно, иногда в течение большого промежутка времени (сутки и более). Уравнения, характеризующие изменение величины адсорбции А со временем т
А = ( (т); dA/dx = !’W (111.44)
Называют уравнениями кинетической кривой в интегральной и дифференциальной форме. Типичный вид интегральной кинетической кривой адсорбции показан на рис. III.9. Производная характеризует скорость адсорбции.
|
|
Скорость адсорбции на однородной поверхности с образованием мономолекулярного слоя (ленгмюровская адсорбция) складывается из скоростей двух противоположных процессов. Скорость прямого процесса определяется скоростью закрепления молекул адсорбата на поверхности адсорбента t’t, а обратного — скоростью удаления молекул с поверхности 1>2. Первая скорость пропорциональна числу столкновений молекул адсорбата v с единицей поверхности адсорбента, доле свободной поверхности (1—0) и доле молекул а, способных к закреплению
на поверхности. Скорость обратного процесса (десорбции) пропорциональна доле уходящих молекул [} с единицы площади насыщенной поверхности и степени заполнения поверхности 0. В результате скорость адсорбции выразится суммарным уравнением
DO/dx—v, — i’2=av(l — 0) — j}0 (111.45)
При равновесии скорость адсорбции равна нулю и уравнение
(111.45) переходит в уравнение адсорбции Ленгмюра (число столкновений молекул адсорбата с поверхностью адсорбента в соответствии с молекулярно-кинетической теорией пропорционально давлению газа-адсорбата).
Обозначим скорость адсорбции через х:
</0 /dx = av — а-9 — ре = * 11И .46)
Правую часть уравнения (111.45), выраженную через х, продифференцируем по 0:
Dx/dQ= — (av+p)=— kc (II 1.47»
Обозначив полученное выражение через константу Kc, которая является константой скорости адсорбции, интегрированием уравнения (III.47) получим новое выражение для х. Так как х отражает скорость адсорбции, то при х = 0 степень заполнения поверхности равна степени заполнения при достижении равновесия, т. е. 9 = 9Р. Для этих пределов имеем: * о
Fdx=— f МО и х — А’с(ер — Є) (II 1.48)
Ь %
Подставив значение х из уравнения (III.48) в уравнение
(111.46) , получим следующее выражение для скорости адсорбции:
Di)/dx = kciOP — 0) (III.49)
Произведем замену переменных и их разделение:
0Р — В — І/ ; dy = —dQ Dy/y = —kcdx d In y = — kcdx (111.50)
При т = 0 степень заполнения 8 = 0 и г/ = 0Р. Интегрируем (III.50) в соответствующих пределах: 6-е т
Р Г" 0 _ 6
I d In (Op — 9) = — I kcdx In—I—=S — kcx
0p о
Окончательно получим:
0 = 0р(1 — е~кс) или Л=Лр(1 — е-*е*> (III.5I)
Полученное уравнение отражает зависимость, показанную на рис. III.9.
Формальный вывод уравнения (III.51) можно было начать с соотношения (III.49). Приведенный вывод позволяет вскрыть физический смысл константы скорости адсорбции Kc. Именно от ее значения зависит время установления адсорбционного равновесия. В соотношении (III.47) для Kc величину v можно представить с помощью выражения из молекулярно-кинегиче — ской теории:
IsLW« _ /isLVA _ Р ,,,, vn
2 пт) -~квТ2лт) у2ят/гБГ l111’^
(p = nkftT И n = p/kftT) —►
Где п — число молекул в единице объема; и—средняя скорость молекул в заданном направлении; m — масса молекулы адсорбата.
Доля уходящих молекул {} с единицы площади насыщенной поверхности равна числу молекул, обладающих Энергией Сдес, достаточной для отрыва от поверхности, т. е. {J пропорционально фактору Больцмана:
£ = ехр (— Елес/кьТ) (111.53)
Где £Дес — энергия активации десорбции.
Учитывая соотношения (III.52) и (III.53), выражение для константы скорости адсорбции (III.47) можно записать в следующем виде:
+ Р ° У^г +Ч-1И (ПЬ54>
Выражение (111.54) вместе с ранее полученными позволяет проанализировать зависимости константы скорости адсорбции от различных факторов. Из уравнения (III.49) следует, что в начале процесса адсорбции, когда степень заполнения поверхности мала, скорость адсорбции максимальна, по мере же роста степени заполнения она снижается. Если энергия активации десорбции велика, что характерно, например, для хемосорбции и конденсации пара на поверхности адсорбента, то вторым членом в уравнении (III.54) можно пренебречь и константа скорости будет пропорциональна давлению газа. При малых давлениях скорость адсорбции мала и равновесие устанавливается очень долго, при больших же давлениях равновесие может достигаться почти мгновенно. В зависимости от давления время установления адсорбционного равновесия меняется в широких пределах — от нескольких часов до 10~~7 с.
Коэффициент а, выражающий долю достигших поверхности молекул, способных к закреплению на ней, представляет собой вероятность того, что молекула закрепится на поверхности. Поэтому эта доля равна
А=ехр (— £а яс/^Б Т) (111.55)
Энергия Еадс, необходимая для закрепления молекул на поверхности адсорбента, называется энергией активации адсорбции. Если энергия активации равна нулю, что, как правило, характерно для физической адсорбции, то а=1. Этот случай отвечает неактивированной адсорбции. Скорость неактивированной адсорбции обычно большая и, как видно из уравнения
(111.54) , уменьшается при p = const с повышением температуры. Наличие потенциального барьера и необходимость предварительной затраты энергии (энергии активации) характерно для активированной адсорбции. Скорость активированной адсорбции мала и увеличивается с повышением температуры
(111.55) .’ Потенциальный барьер возникает в том случае, если для совершения акта адсорбции необходимо предварительное ориентирование атомов и молекул. Это в большей степени характерно для специфической химической адсорбции, энергия активации которой может достигать 40—150 кДж/моль.
Если после установления адсорбционного равновесия давление в системе уменьшить до нуля, то начнется процесс десорбции. При условии пренебрежения адсорбцией, получим из (III.45):
De/dt=—ре (III.56)
Или интегрируя, имеем:
9 т
Rfe/61= — Pdr, j D In Є = — j Pdx
EP 0
Є = Єре-»т (111.57)
Уравнение (III.57) характеризует кинетику десорбции. Коэффициент ji пропорционален фактору Больцмана (III.53), который указывает на увеличение скорости десорбции с повышением температуры.
 2 ноября, 2012
2 ноября, 2012  admin
admin 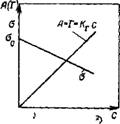
 Опубликовано в рубрике
Опубликовано в рубрике 