В полимерных цепях макромолекул могут происходить различные химические превращения (реакции), изменяющие структуру полимера. Эти превращения могут быть трех типов.
1. Реакции полимеров, приводящие к увеличению их степени полимеризации. К этому типу превращений относятся процессы синтеза блок-сополимеров и привитых сополимеров (см. разд. 1.4.3).
2. Реакции полимеров, протекающие без изменения степени полимеризации их основных цепей. Так протекают реакции по- лимераналогичных превращений, при которых изменяется структура функциональных групп, связанных с основной цепью. К этому же типу относятся и специфические реакции внутримолекулярных превращений, при которых проходят реакции меж — ду функциональными группами, расположенными вдоль одной и той же полимерной цепи или между концевыми группами цепи (в последнем случае проходят реакции циклизации макромолекул).
3. Реакции, сопровождающиеся уменьшением степени полимеризации макромолекулы. Это процессы деструкции (распада, разрушения) макромолекул, проходящие в силу естественных причин или иногда вызываемые искусственно.
Элементарные акты перечисленных химических реакций полимеров практически не отличаются от элементарных актов аналогичных реакций низкомолекулярных соединений. Однако большие размеры и полифункциональность макромолекул придают некоторые особенности реакциям полимеров. Причиной этого является ряд специфических эффектов.
Широкие возможности для синтеза новых типов полимеров с разнообразными свойствами предоставляют реакции поли- мераналогичных превращений. Эти реакции проходят между макромолекулами и мономерными низкомолекулярными соединениями (взятыми зачастую в стехиометрическом избытке). При этом фрагменты низкомолекулярного реагента (атомы, группы атомов) входят в состав получаемого полимера.
Полимераналогичные превращения могут быть весьма разнообразными. Они представляют собой реакции замещения и присоединения, широко известные в органической химии, которые используют применительно к полимерам. Так, непредельные полимерные углеводороды, например полиизопрен (натуральный каучук), можно эпоксидировать и галогенировать, получая полимеры, содержащие в цепи эпоксидные группы или атомы галогена. Примером полимераналогичных превращений для насыщенных полимерных углеводородов (полиэтилен и др.) являются реакции их хлорирования и сульфохлорирования. Разнообразным полимераналогичным превращениям подвергается целлюлоза, образующая сложные и простые эфиры.
Некоторые полимеры можно получить только путем полимераналогичных превращений. Поливиниловый спирт не может быть получен прямой полимеризацией, поскольку мономерный виниловый спирт (СН2=СНОН) не существует в свободном виде. Поэтому поливиниловый спирт получают гидролизом поливинил ацетата в кислой или щелочной среде. Из поливинилового спирта, подвергая его в кислой среде ацеталированию (формальдегидом, уксусным, масляным и другими альдегидами), получают поливинилацетали — уже другой тип полимера, с иными свойствами. Дополнительным хлорированием поливинилхлорида {—[—СН2—СН(С1)—]х—} получают поливинилпер- хлорид (перхлорвинил). Некоторые из подобных реакций будут рассмотрены ниже.
Реакции полимераналогичных превращений обладают специфическими особенностями, не присущими низкомолекулярным веществам, что обусловлено длинноцепочечной структурой полимера, которая, в свою очередь, оказывает влияние на реакционную способность их функциональных групп.
1. Пространственные (стерические) затруднения, вызываемые различной конфигурацией соседних звеньев цепи, могут привести к изменению направленности, скорости и степени завершенности реакции полимераналогичных превращений. Например, изотактические и синдиотактические виниловые полимеры имеют различную реакционную способность при этих реакциях вследствие неодинаковых условий реализации эффективного переходного состояния реакции.
2. Конформация макромолекул в реакционной среде (в частности, возможность их свертывания в статистический клубок), их электростатическое взаимодействие с реагентами, явления
Ассоциации и агрегации компонентов реакции также влияют на полимераналогичные превращения.
3. На реакционную способность определенной функциональной группы (звена) может влиять ее ближайшее окружение, изменяющееся в ходе полимераналогичных превращений. Этот так называемый «эффект соседа», могущий вызвать изменение скорости и механизма полимераналогичной или внутримолекулярной реакции, обусловлен влиянием прореагировавшей группы на соседнюю, еще не вступившую в реакцию. Следовательно, реакционная способность данной группы или звена может быть функцией степени завершенности (конверсии) реакции.
Количественно оценить влияние на процесс всех перечисленных факторов очень трудно. В полимераналогичных превращениях наиболее четко проявляется эффект соседних звеньев (эффект соседа). Он может ускорять реакцию (анхимерное содействие) или замедлять ее.
Рассмотрим реакцию гидролиза полиметилакрилата:
Н2о
~СН2—СН—СН2—СН—СН2—СН~ ————- ►
| | | — он
СООСНд СООСНз СООСНз > ~СН2—СН—СН2—СН—СН2—СН~ + СНоОН и т. д. (1.120)
I I I
СООН СООСНз СООСНд
Образовавшиеся при гидролизе карбоксильные группы в цепи могут оказывать влияние на последующий гидролиз соседних сложноэфирных групп.
Подобные процессы можно описать по упрощенной схеме. Если исходный полимер содержит в повторяющихся звеньях
Функциональные группы А, способные при полимераналогичном превращении переходить в группы В под влиянием избытка
Низкомолекулярного реагента, то можно записать:
AAA ——— »■ ААВ ——— > ВАВ (1.121)
В соответствии с уравнением (1.121) можно различать три типа расположения реагирующей группы А:
1. Группы с двумя соседями А — триады типа ААА (их концентрация N0, константа скорости реакции превращения А в
В —*„);
2. Группы с соседями А и В — триады типа ААВ (концентрация Nu константа k)
3. Группы с двумя соседями В — триады ВАВ (концентрация N2) константа k2).
Тогда суммарная скорость реакции будет равна:
— dN^/dx—kQNo—(1.122) где Na=N0+Ni+N2 — общая концентрация групп (звеньев) А.
Ш Рис. 1.13. Анаморфозы кинетических кривых реакций полимераналогичных превращений (Na — концентрация групп А; т — время). Объяснение см. в тексте
|
Ч» |
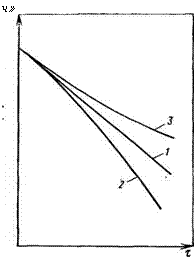 Соотношение величин констант k0k: k2 может сильно влиять на кинетику процесса и строение образующегося нового полимера. Возможны три предельных случая:
Соотношение величин констант k0k: k2 может сильно влиять на кинетику процесса и строение образующегося нового полимера. Возможны три предельных случая:
A) k0=k = k2. Влияния соседних звеньев нет. Уравнение скорости реакции имеет обычный вид:
— dNk/dx=k (N0+N,+N2) = kNf,.
(1.123)
При избытке низкомолекулярного реагента превращение А в В можно считать реакцией псевдопервого порядка. Следовательно,
ДгА=Л">Ае-м, (1-124)
Где Na° — исходная концентрация групп А.
Кинетическая кривая такой реакции спрямляется в полулогарифмической системе координат (рис. 1.13, прямая 1);
Б) ko^ki^.k2. Ускоряющий эффект соседа, математическая обработка кинетических данных сложная. Этому процессу соответствует кривая 2;
В) Замедляющий эффект соседних звеньев; кинетическая зависимость соответствует кривой 3.
Следует отметить, что знание кинетики и механизма макро — молекулярных реакций имеет большое практическое значение.
 31 августа, 2013
31 августа, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 