Влияние пигментов на противокоррозионные свойства покрытий проявляется главным образом в электрохимических процессах, происходящих под лакокрасочным покрытием на границе металл пленка, так как диффузия в покрытии, хотя и сказывается на скорости развития коррозионного процесса, не является его определяющим фактором. Это обусловлено тем, что при эксплуатации покрытий в различных условиях (атмосфера, водные растворы) основные коррозионно-активные агенты (вода и кислород) через сравнительно небольшое время от начала эксплуатации покрытия оказываются на границе пленка — металл в количестве, достаточном для развития коррозионного процесса. Так, для развития коррозии на стальной поверхности необходимо поступление воды в количестве 0,008—0,023 г/см2 в год и кислорода — 0,002—0,003 г/см2 в год. Экспериментально установлено, что под покрытиями различной природы, как наполненными, так и ненаполненными, после года эксплуатации содержание воды и кислорода вполне достаточно для развития коррозионного процесса [55]:
|
[Н20^ Г/см |
![]() [Ог] г/см
[Ог] г/см
Льняное масло — литопон 1,125
Полиэфир — карбонат свинца или 1,122
Оксид цинка
TOC o "1-5" h z Алкид — красный железоокисный пигмент 1,8 0,003
Эпоксиполиамид — красный железоокис — 1,8 0,002
Ный пигмент
Хлоркаучук — красный железоокисный 1,3 0,006
пигмент
Однако коррозионный процесс при наличии достаточного количества воды и кислорода не развивается, так как лакокрасочное покрытие (в том числе и пигмент) оказывает большое влияние на электрохимические процессы, протекающие на границе пленка — металл. В общем случае эти процессы и условия их протекания могут быть описаны с позиций микроэлектродной теории коррозии, представляющей поверхность металла, в силу его структурной неоднородности, как комбинацию микрокатодов и микроанодов. Наличие лакокрасочного покрытия создает дополнительную неоднородность различных участков поверхности металла. Установлено, что при любом пленкообразователе, пигменте, режиме получения и отверждения покрытий между металлом и покрытием остается слой сорбированной воды толщиной около 1 нм. На некоторых участках (впадины между неровностями) между покрытием и подложкой остаются газовые прослойки, имеющие толщину, которая соответствует средней высоте микрошероховатостей поверхности, т. е. около 1 мкм. Чаще всего такие прослойки образуются при получении покрытий методом злектроосаждения. Неоднородность межфаз’ного слоя способствует образованию микроанодных (под воздушной прослойкой, содержащих сорбированную воду) и микрокатодных (с хорошей адгезией) участков [56]. Очевидно, что между микроанодными и микрока — тодными участками возникает разность потенциалов Л£, определяемая в общем виде соотношением:
£ = р2(1/5а+1/5к)*£5а (1.13)
Где р — удельное электрическое сопротивление пленки, насыщенной коррозионноактивными агентами; б — толщина покрытия; 5а и 5К — площади анодных и катодных участков; /а — плотность тока на анодных участках.
Хотя величина /а мала, ток вызывает изменение параметров коррозионной среды, особенно на катодных участках, где происходит заметное подщелачивание (pH возрастает до 10—13), приводящее к снижению адгезионной прочности в результате гидролиза пленкообразователй и отслаиванию покрытия. На анодных участках происходит подкисление, способствующее ускорению коррозионного процесса и разрушению адгезионной связи между металлом и покрытием. Таким образом, коррозионную ячейку в системе лакокрасочное покрытие — металл можно представить в виде комбинации в различной степени аэрированных микрокатодов и микроанодов (рис. 1.14), на которых происходят различные электрохимические процессы [57].
Область 1 — слабоаэрированныйкатод (pH = 7-^9,Е= 0,2В):
2 + 2Н20+4е —► 40Н~
|
‘ ( |
<атс >2 Н |
Ід Го |
Анод |
Каї О* |
■под I НгО ГрПродуктыфЬъ С* коррозии? хЯ |
||
|
77Ш |
V//. 1 |
777//Л |
‘/7/7/7, 2 |
У777/7/ 3 |
У??77/ 4 |
‘7/7/////У/ |
7/7777/777/Ш, 5 |
|
Металл Рис. 1.14. Схема коррозионной ячейки под лакокрасочным покрытием. |
Области 2, 3 — де — и слабоаэрированный анод (pH = 2^4,Е= —0,5В) :
Ге ;*=► Гег++2е; Ге2+ ?е3*+е Ре2++Н20 ГеОН++Н+
Ге2++ 2Ге31"+4Н20 Ге304 + 8Н+; 2Н"+2е ^ Н2
Область 4 — аэрированный анод (pH = 2-=- 3) :
Ге3++ЗН20 Ге(ОН)3+ЗН+
Область 5 — аэрированный катод (рН= 10^ 13,Е~ 0,2В): 02+2Н20+4е ^ >- 40Н-
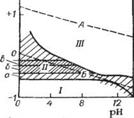
Влияние пигментов на процессы, происходящие на различных участках коррозионной ячейки под лакокрасочным покрытием, а также механизм пассивации можно наиболее наглядно представить, используя известные диаграммы потенциал — pH (по М. Пурбэ и Н. Зубову), изображенные для стали на рис. 1.15. На диаграмме различают область отсутствия коррозии I (в силу термодинамических причин), или область катодной защиты; область пассивирования III, или область анодной защиты, — образование стабильных, плотных оксидных пленок; и область коррозии
II, имеющая зоны с различной интенсивностью протекания процесса коррозии: а — слабая коррозия (до 10 мм в год), б — умеренная коррозия (до 100 мм/год), в — интенсивная коррозия (до 1000 мм/год). Линии А и Б разграничивают области стабильного и нестабильного состояний воды:
Л) 2Н20 02+4Н++4е 40Н~
Б) Н2 2Н++2е
20Н“+Н2<=^ 2НгО +2е
Таким образом, между линиями А и Б располагается область стабильного состояния воды. Очевидно, что области пассивного состояния железа и стабильного состояния воды не совпадают, вследствие чего сталь в обычных условиях (при значениях равновесного потенциала —0,45В и pH = 6-^8) корродирует в присутствии воды.
Рис. 1-15. Диаграмма потенциал — pH для стали в присутствии воды.
 Механизм противокоррозионного действия пигментов, как правило, включает целый ряд процессов, связанных с воздействием на анодный процесс или смещением потенциала в область катодной защиты, смещением pH в щелочную область, образованием оксидных пленок и ингибирующих комплексов, изменением диффузионных характеристик покрытий и т. д. Поэтому целесообразно рассмотреть механизм противокоррозионного действия отдельных групп пигментов и наполнителей.
Механизм противокоррозионного действия пигментов, как правило, включает целый ряд процессов, связанных с воздействием на анодный процесс или смещением потенциала в область катодной защиты, смещением pH в щелочную область, образованием оксидных пленок и ингибирующих комплексов, изменением диффузионных характеристик покрытий и т. д. Поэтому целесообразно рассмотреть механизм противокоррозионного действия отдельных групп пигментов и наполнителей.
|
 Противокоррозионное действие хроматных пигментов. Благодаря растворимости в воде хроматные пигменты обладают способностью генерировать в покрытии при его эксплуатации хромат-ионы, диффундирующие к поверхности металла и расширяющие область пассииного состояния стали (рис. 1.16) за счет повышения электродного потенциала и pH [53]:
Противокоррозионное действие хроматных пигментов. Благодаря растворимости в воде хроматные пигменты обладают способностью генерировать в покрытии при его эксплуатации хромат-ионы, диффундирующие к поверхности металла и расширяющие область пассииного состояния стали (рис. 1.16) за счет повышения электродного потенциала и pH [53]:
Хромат кальция Хромат капия-бария Хромат цинка Хромат стронция Тетрагидроксихромат цинка Хромат бария Силикохромат свинца
По зтим данным, чем выше растворимость хромата, тем больше смещение потенциала стальной поверхности в область пассивного состояния. Аналогичный результат получен при сопоставлении анодных поляризационных кривых стальных электродов в водных вытяжках хроматных пигментов. С зтой точки зрения в противокоррозионных покрытиях более предпочтительно использование пигментов-хроматов с большей водо- растворимостью, однако это сопряжено с повышением гидрофильности покрытия и быстрым выщелачиванием хроматного пигмента в процессе эксплуатации покрытия. С целью обеспечения долговременного противокоррозионного действия покрытия быстрорастворимые хроматы используют в смеси с труднорастворимыми (тетрагидроксихромат цинка, хромат бария, силикохромат свинца).
Как показали исследования систем защитных покрытий, содержащих грунтовочные слои на основе хромата цинка, уже через 6 сут от начала эксплуатации покрытия в водной среде вблизи поверхности металла образуется раствор хромата цинка, по концентрации близкий к насыщенному (10-2 моль/л). Это является причиной высокой эффективности пигментов-хроматов, так как раствор хромат-ионов такой концентрации
|
Обладает сильным пассивирующим действием по отношению к стальной поверхности (см. рис. 1.16) [59]. Время достижения равновесной концентрации хрома — тов вблизи поверхности металла определяется их растворимостью и диффузионными характеристиками пленкообразо — вателя. Полагают, что пассивирующее действие хромат-ионов обусловлено их специфической адсорбцией на разных участках поверхности металла. Существенное влияние на пассивирующее действие хромат-ионов оказывает конкурирующая адсорбция других ионов, например СГ, , проникающих к подложке из атмосферы или при Сутствующих в качестве примесей в хроматных пигментах. Концентрация зтих коррозионно-активных ионов в водных вытяжках хроматных пигментов не должна превышать 0,00015—0,00025 М [60], поскольку при большей концентрации эффективность хроматных пигментов резко уменьшается. В настоящее время под специфической адсорбцией хромат-ионов понимают их хемосорбцию в результате образования координационных связей с металлической подложкой. Установлено, что в присутствии воды хроматные пигменты образуют комплексные ионы [61]: ГпСг04-4Н2о ;^[гпсю4(он)в]8-+8Н+ Которые способны взаимодействовать с подложкой с образованием гетероингибирующего комплекса [гпСг04(0Н)8]8“-4Ре0 Или адгезионного комплекса с участием функциональных групп пленко — образователя: [гпСг04(НСОО)г(ОН)6]-4ГеО Кроме того, хромат-ионы на катодных участках коррозионной ячейки при pH>5 (см. рис. 1.14, области 1, 5) восстанавливаются с образованием пленок гидроксида хрома, что способствует пассивации металла: |
|
+0,8 |
|
О |
|
-0,8 |
|
1 |
|
О |
|
10 |
|
74 PH |
|
|
||
 |
|||
|
|||
|
Как видно из диаграммы потенциал — pH (см. рис. 1.16), хроматы не эффективны в кислой среде при рН< 4 и даже усиливают коррозию за счет повышения потенциала железа в зоне коррозии (зоны а, б на рис.
1.15).
Таким образом, наиболее существенными параметрами, определяющими эффективность хроматных пигментов, являются их растворимость и pH коррозионной среды под лакокрасочным покрытием. Регулирование противокоррозионного действия хроматов осуществляется путем их комбинации с пигментами, изменяющими их растворимость и pH водной вытяжки, в частности, с фосфатами [62]:
|
Массовый состав пигментной Части покрытия, %
|
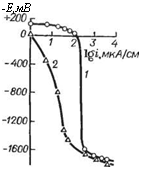
Увеличение растворимости хроматных пигментов при определенном содержании фосфата хрома (первоначально зто связывали с уменьшением pH водной вытяжки) обусловлено реакциями замещения между хроматом и натрийсодержащими примесями фосфата хрома (сульфаты и фосфаты натрия) с образованием хорошо растворимого хромата натрия. В результате этого в водной вытяжке смеси пигментов при анодной поляризации сталь корродирует значительно медленнее (рис. 1.17) [62].
Противокоррозионное действие фосфатных пигментов. Фосфатные пигменты получают в настоящее время все большее применение как экологически более полноценные, чем хроматные пигменты.
Механизм противокоррозионного действия фосфатных пигментов (фосфаты хрома, цинка, марганца, железа, алюминия) включает их диссоциацию под действием воды, проникающей в покрытие, и образование комплексной кислоты [57]:
Гп-(Р04)2-4Н20 =*=*- [2п(ро4)2(н2о)2(он)2]2> 2Н +
|
-Е, мВ |
 Комплексная кислота или ее комплексы с пленкообразователем реагируют с ионами железа на микроанодных участках коррозионной ячейки (области 2, 3 на рис. 1.14) с образованием стабильного, прочно удерживаемого комплексного ингибитора коррозии: [гп3(Р04)2(Н20)2(0Н)(С00)]Ре
Комплексная кислота или ее комплексы с пленкообразователем реагируют с ионами железа на микроанодных участках коррозионной ячейки (области 2, 3 на рис. 1.14) с образованием стабильного, прочно удерживаемого комплексного ингибитора коррозии: [гп3(Р04)2(Н20)2(0Н)(С00)]Ре
Я И
Рис. 1.17. Анодные поляризационные кривые стали в водных вытнжках хроматного пигмента (7) и смеси (2) хроматиого и фосфатного пигментов (в соотношении 30 : 70).
Если с подложкой взаимодействуют комплексы фосфатов с пленко — образователем, возрастание противокоррозионных свойств покрытий, пигментированных фосфатами, связано й с повышением адгезионной прочности. Благодаря более сильной комплексообразующей способности фосфатные пигменты лучше, чем хроматные пигменты, защищают подложки, содержащие следы ржавчины.
По некоторым данным [60, 63], фосфатные пигменты не обладают пассивирующим действием. В частности, это установлено для фосфата хрома и обусловлено наличием в нем в качестве примесей ионов 80^ концентрация сульфат-ионов в водной вытяжке пигмента в 3 раза превышает концентрацию фосфат-ионов. Результаты ускоренных испытаний покрытий, пигментированных фосфатом хрома, показывают их неудовлетворительную водостойкость [62]. Поэтому фосфат хрома рекомендуется использовать в смеси с ингибиторами коррозии [63] или с хро — матными пигментами. Смеси фосфатных и хроматных пигментов проявляют синергизм, так как окислительное действие хроматов ведет к образованию пленки оксида железа (III), необходимой для эффективного ингибирующего действия фосфатов.
Заметное влияние на противокоррозионное действие фосфатных пигментов оказывает дисперсность: чем она выше, тем выше ингибирующее действие пигментов, что обусловлено более интенсивным взаимодействием с пленкообразователем.
Противокоррозионное действие свинцового порошка. Механизм противокоррозионного действия металлического свинца включает катодную защиту, так как в областях коррозионной ячейки, имеющих высокие значения pH (области 1, 5 на рис. 1.14), свинец является анодом по отношению к железу и проявляет протекторное действие. Кроме того, свинец в высокодисперсном состоянии обладает весьма высокой химической активностью по отношению к агентам, вызывающим коррозию стали (кислород), а также к ионам и газам, способствующим развитию коррозионного процесса. Он активно взаимодействует с сульфат-ионами, проникающими в покрытие при их эксплуатации в промышленной атмосфере, давая нерастворимый сульфат свинца, а это приводит к уплотнению покрытия и уменьшению его проницаемости. Свинец реагирует с углекислым газом с образованием карбоната, еще менее растворимого, чем сульфат; поэтому введение карбоната кальция заметно улучшает защитные свойства покрытий, наполненных металлическим свинцом. Аналогичным образом свинец связывает и весьма коррозионно-активные хлорид-ионы.
Существенную роль в противокоррозионном действии свинцового порошка играет образование свинцовых мыл с карбоксилсодержащими пленкообразователями. Это увеличивает непроницаемость пленок, связывает полярные группы, повышает стойкость пленкообразователей к гидролизу и, следовательно, адгезионную прочность покрытия на мик — рокатодных участках (области с высоким значением pH), что затрудняет восстановление кислорода и тормозит коррозионный процесс. Свинец
реагирует также с жирными низкомолекулярными кислотами С6—С8, образующимися в результате деструкции алкидов в процессе сушки и эксплуатации покрытий и являющимися сравнительно сильными коррозионными агентами. При этом получаются продукты, которые являются адсорбирующимися ингибиторами в области значений pH 4—6. Они мигрируют и адсорбируются на поверхности микроанодов, создавая защитную пленку, блокирующую анод от внешней среды. Установлено, что адсорбционный слой свинцовых мыл не изменяет электрохимического потенциала железа, поэтому свинецсодержащие пигменты не являются опасными с точки зрения ускорения процесса кирризии [57].
|
ЗРЬО + 2 ОН |
![]() Противокоррозионное действие свинцового сурика. Свинцовый сурик РЬ304 ведет себя как щелочной окислитель (при pH 9—10), восстановление которого на микрокатодных участках электрохимической кор розионной ячейки (область 1 на рис. 1.14.) приводит к образованию весьма реакционноспособного и хорошо растворимого оксида свинца:
Противокоррозионное действие свинцового сурика. Свинцовый сурик РЬ304 ведет себя как щелочной окислитель (при pH 9—10), восстановление которого на микрокатодных участках электрохимической кор розионной ячейки (область 1 на рис. 1.14.) приводит к образованию весьма реакционноспособного и хорошо растворимого оксида свинца:
РЬ304 + Н20 + 2е
При его растворении образуются ионы свинца, механизм противокоррозионного действия которых рассмотрен выше [57].
Ионизация свинцового сурика происходит также в результате разры ва связи кислород — свинец (II) :
О. О
РЬ<^ /РЬ /рь О О
РЬ<" )РЬ— О—РЬ+
О
Образующийся продукт реагирует с гидроксидом железа на микрс — анодных участках коррозионной ячейки (области 2, 3 на рис. 1-14) с образованием устойчивого комплексного соединения.
В некоторых работах механизм противокоррозионного действия свинцового сурика связывают с образованием в качестве продукта гидролиза комплексной кислоты [57].
/° /° Нг°
РЬ’ /РЬ
О=рь<^ ^>рь(н2о)з
0-
|
+ 2НҐ |
![]() =РЬ(^ ^)РЬ(НпО)(ОН)2
=РЬ(^ ^)РЬ(НпО)(ОН)2
Такая кислота способна образовывать с ионами железа стабильный комплексный ингибитор коррозии без участия (I) или при участии (II)
|
Функциональных групп пленкообразователя.
|
|
I II |
Кроме того, свинцовый сурик — пигмент основного характера, расширяющий область пассивного состояния стальной подложки (см. рис.
1.15) . В процессе эксплуатации покрытий, пигментированных свинцовым суриком, на поверхности стальных подложек методом Оже-спектро — скопии обнаружены следы металлического свинца. Микрофаза свинца облегчает катодное восстановление кислорода на поверхности оксида железа, что приводит к повышению плотности тока на анодных участках коррозионной ячейки, особенно в местах повреждения пассивирующей оксидной пленки. В результате постепенно устраняется дефектность структуры оксидной пленки и сохраняются стабильные противокоррозионные свойства покрытия [55].
Противокоррозионное действие цинковой пыли. Электрохимический потенциал цинка ниже, чем железа (—760 и 440 мВ соответственно), поэтому в электрохимической паре цинк — железо, возникающей в покрытиях в присутствии воды, частицы пигмента выполняют роль анода и растворяются в процессе эксплуатации покрытия:
Металлическая подложка выполняет функцию катода:
2НгО + 02 + 4е 40Н-
В результате имеет место пассивация стали за счет подщелачивания. Полагают, что электрохимическое (протекторное) действие цинковой пыли является первой стадией процесса, происходящего в цинкнапол- ненном покрытии [64], после чего следует стадия уплотнения структуры покрытия вследствие взаимодействия ионов цинка с диоксидом и оксидом углерода. Эта стадия сопровождается образованием нерастворимых продуктов, выделение которых на подложке приводит к появлению защитных слоев, препятствующих коррозии, а выделение их в объеме покрытия — к его уплотнению и усилению.
Противокоррозионное действие пигментов основного характера. Пигменты, имеющие щелочную водную вытяжку, расширяют область пассивного состояния железа (см. рис. 1.15) и в большинстве случаев увеличивают противокоррозионное действие покрытий. Одним из условий успешного применения таких пигментов является создание в коррозионной ячейке под лакокрасочным покрытием концентрации гидроксильных ионов, достаточной для перевода железа в пассивное состояние, но не превышающей концентрацию, при которой становится возможным гидролиз пленкообразователей. На этом основано противокоррозионное действие свинцовых и цинковых белил; карбонатных наполнителей; метабората бария, образующего под лакокрасочный покрытием буферные растворы с pH ~ 9,3; ферритов цинка и кальциЯ> образующих, кроме того, мыла с пленкообразователями алкидного типа, что уменьшает гидролиз отвержденного пленкообразователя в области микрокатодов коррозионной ячейки; плюмбата кальция, формирующего на подложке ингибирующие комплексные соединения.
К пигментам-ингибиторам катодного процесса относится гидрид кремния 8ЩХ, содержащий 10-80% водорода, обеспечивающего восстановление гидроксильных групп на катодных участках (яп. пат, 55—46078).
 1 сентября, 2013
1 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 