Рассмотрим реакции карбоновых кислот и их производных об-
Щей формулы И—Сч, где Х = С1, ОН, ОА1к, ОАг, ЫН2, с нук — ХХ
Леофилами. Наибольший интерес с точки зрения синтеза упомянутых выше видов пленкообразующих представляют такие нуклеофильные соединения, как спирты, амины, фенолы и вода.
Общим фрагментом структуры всех производных карбоновых кислот является ацильная группа НС = 0. Атом углерода в этой группе находится в
Состоянии А’/Я-гибридизации с углом между связями 120 °С. Двойная связь С = 0 сильно поляризована за счет различной электроотрицательности атомов С и О и большой подвижности я-электронов двойной связи. Ее дипольный момент к 2,5—2,9 И.
Реакции производных карбоновых кислот с нуклеофильными реагентами ВН включают атаку свободной электронной пары нуклеофильного реагента на атом углерода ацильной группы, несущий частичный положительный заряд. Атом кислорода ацильной группы, несущий частичный отрицательный заряд, может быть центром электрофильной атаки, которая облегчает реакцию с нуклеофильными агентами. Реакция протекает по механизму присоединения — отщепления, а не прямого нуклеофильного замещения:
TOC o "1-5" h z О ОН О
// I II
Я—С/У +вн :*=> Я—С—X :*=£ Я—С + НХ (2.1)
X в в
тетраэдрический аддукт 0)
На стадии присоединения атом углерода переходит в состояние «р3-гибридизации и становится тетраэдрическим. В тетраэдрическом аддукте заместители должны располагаться более тесно, благодаря чему на скорость реакции большое влияние оказывают стерические факторы.
Образование тетраэдрического аддукта может быть в некоторых случаях доказано химическим путем, например при гидролизе сложных эфиров, амидов и ангидридов кислот — наличием изотопного обмена.
Аддукт I неустойчив и склонен в результате реакций отщепления превращаться в продукты реакции или исходные реагенты. Это определяет равновесный характер большого числа реакций производных карбоновых кислот с нуклеофилами.
Кинетика такого рода взаимодействий описывается закономерностями бимолекулярных реакций, протекающих с разрывом связи углерод—ацил, которые классифицируются как Ас2. По
Механизму АДс2 протекают такие реакции, как этерификация кислот, переэтерификация и аминолиз сложных эфиров, гидролиз сложных эфиров, ангидридов.
Реакционная способность производных карбоновых кислот в рассматриваемых реакциях зависит от строения заместителя К и замещаемой группы X.
Эффект заместителя /?, увеличивающего частичный положительный заряд на углеродном атоме ацильной группы, ускоряет реакцию. Так, при последовательном введении хлора, обладающего сильными электроноакцепторными свойствами, в ацильную группу этилацетатов относительная скорость гидролиза возрастает на пять порядков:
СНзСОО—С2Нв<С1СН2СОО—С5Н5<С12СНСОО—С2Н5<С13ССОО—С2Н5
1 761 16000 100 000
Удлинение и разветвление углеродной цепи карбоновых кислот приводит к снижению реакционной способности как самих кислот, так и их производных:
СНзСООН>СНзСН2СООН> (СН3)2СНСООН> (СНз)зССООН
|
Пространственное Экранирование |

|
(2.2) |
![]()
|
Зависимость реакционной способности ИСОХ от замещаемой группы X определяется влиянием последней на величину положительного заряда на углероде ацильной группы: заместители X, способствующие увеличению 6+, повышают скорость взаимодействия ацильного соединения с нуклеофильным реагентом, и наоборот. Группа X всегда является электронодонорной (—1-эффект) , но этому индуктивному эффекту противодействует сопряжение, особенно сильное у заместителей, содержащих кислородные атомы. Сопряжение обусловливает уменьшение частичного положительного заряда на реакционном центре и снижение скорости. В итоге по своей реакционной способности в реакциях |
 Так, например, триметилуксусная кислота практически не эте — рифицируется в обычных условиях, так как три метальные группы, находящиеся в непосредственной близости от реакционного центра, препятствуют приближению молекулы нуклеофильного реагента, вследствие чего тетраэдрический промежуточный аддукт оказывается неустойчивым:
Так, например, триметилуксусная кислота практически не эте — рифицируется в обычных условиях, так как три метальные группы, находящиеся в непосредственной близости от реакционного центра, препятствуют приближению молекулы нуклеофильного реагента, вследствие чего тетраэдрический промежуточный аддукт оказывается неустойчивым:
С нуклеофильными агентами производные карбоновых кислот располагаются в ряд:[3]
-С-С1 > —» — С-^ОАг > хлорангид-
Рид ангидрид эфир
-С^0А1к > — С^КК2 > —С-^-ОН >
ЭФИР амид кислота соль
Эта закономерность в реакционной способности производных карбоновых кислот иногда нарушается из-за влияния пространственных факторов.
Очевидно, что скорость реакции с нуклеофильными агентами будет возрастать с увеличением нуклеофильности (или основности) нуклеофильного партнера. Сравнительные данные об основности, выраженные в единицах рКвн+, приведены ниже:
TOC o "1-5" h z Основание В рКвн+ Основание В РКвн +
С2Н5МН2 10,6 изо-С3Н7ОН —3,2
С(1Н5ЫН2 4,6 С6Н5ОН —6,74
Н20 —1,74 С6Н5СООС2Н5 —7,36
Не все ацильные производные чувствительны к нуклеофильной атаке каждым из перечисленных реагентов. Наиболее реакционноспособные (хлорангидриды, ангидриды) могут реагировать с большинством из них, менее реакционноспособные — только с сильными нуклеофильными реагентами, например алифатическими аминами. В других случаях применяют катализаторы.
Для реакций производных карбоновых кислот с нуклеофильными реагентами эффективны кислотный и основный катализ.
Кислотные катализаторы повышают полярность карбонильной группы, присоединяясь к атому кислорода. В зависимости от характера электрофильного агента различают специфический и общий кислотный катализ.
Специфический кислотный катализ, отвечающий схеме
О ^ +
Я—С’С + Н+^±|?—с=0—Н^=±К-С-0-Н= 5^)Н (2.4)
Хх I I Xх
Реализуется в случае сильных, полностью диссоциированных протонных кислот (НС1, Нг504 и др.).
Общий кислотный катализ характерен для слабодиссоцииро- ванных кислот (карбоновые кислоты). Активность ацильного производного в этом случае увеличивается за счет образования водородно-связанного комплекса:
TOC o "1-5" h z Я И
^С=0+НА ^)С=О…НА. (2.5)
X X
Частным случаем общего кислотного катализа является катализ ионами некоторых металлов, способных образовывать комплексы с производными карбоновых кислот. В основе такого комплексообразования лежит донорно-акцепторное взаимодействие неподеленной пары электронов карбонильного кислорода с ионами металла, что приводит к увеличению частичного положительного заряда на атоме углерода.
Основания, в частности ионы гидроксила, также могут ускорять реакции производных кислот, переводя реагент НВ в гораздо более реакционноспособный анион В~ (например, спирты — в алкоголят-анионы):
ВН+НО- Н20+В-. (2.6)
Реакции свободных карбоновых кислот не могут катализироваться основаниями, так как при этом образуются карбоксилат — анионы, не обладающие карбонильной активностью (см. ряд, активности 2.3):
+ НСГ——- ► ЯСС У- + Н20 (2.7)
Он
Целесообразность применения катализа того или иного типа определяется в каждом конкретном случае. Так, при кислотном катализе необходимо учитывать, что кислота-катализатор взаимодействует и с нуклеофильным реагентом, превращая его в соль, и тем самым блокирует его свободные электронные пары: ВН+Н+ ВН2+. (2.8)
Реакция (2.8) приводит к уменьшению действующей концентрации нуклеофильного партнера, которая зависит от константы диссоциации сопряженной кислоты, определяемой по уравнению
К 1ВИ][И+] г 0)
№4 ‘ <29>
По-видимому, при прочих равных условиях действующая концентрация нуклеофильного реагента будет выше, если рКа име-
8-474
ет большую величину. Поэтому в случае нуклеофильных агентов, являющихся сильными основаниями, например аминов, кислотный катализ неэффективен независимо от структуры производного карбоновой кислоты. При применении менее сильных оснований существенного снижения активной концентрации нуклеофильного агента за счет реакции (2.8) не происходит, и кислотный катализ целесообразен. Действительно, реакцииэфи — ров и карбоновых кислот со спиртами подвержены кислотному катализу.
При основном катализе наряду с увеличением реакционной способности нуклеофильного агента вследствие его депротони — рования (реакция 2.6) возможно присоединение ионов ОН к карбонильной группе, что может привести к снижению действующей концентрации производного карбоновой кислоты, а в ряде случаев — к его гидролизу:
К X О
![]()
|
Х~+НгО НХ+ОН- |
![]()
|
;С=0+-0Н R—С—О" |
![]()
|
А» |
![]() >
>
X
2.1. СЛОЖНЫЕ ПОЛИЭФИРЫ (ОЛИГОЭФИРЫ)
Сложные полиэфиры — это гетероцепные полимеры, содержащие в основной цепи регулярно повторяющиеся сложноэфирные
О
II
Группы —С—О—. Их получают по реакции поликонденсации полиатомных спиртов с поликарбоновыми кислотами или с их производными. Ниже приведены наиболее часто используемые исходные вещества:
НО—(СН2)г—ОН — этиленгликоль
НО— (СН2) гО (СНа) 2—ОН — диэтилёнгликоль
НО—СНг-СН (ОН) —СНг—ОН —глицерин
CHs—С(СН2ОН)з — триметилолэтан (метриол)
С2Нб— С(СН2ОН)з — триметилолпропан (этриол)
С(СН2ОН)4 — пентаэритрит
НООС—(CH2)4—СООН — адипиновая кислота
НООС—(СН2)в—СООН — себациновая кислота
|
СН—СО
|
— малеииовый ангидрид
|
НООС |
— фталевый ангидрид
|
—COOII Ндсоос—СООС113 |
|
Со |
|
НООС |
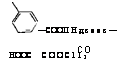 |
|
|
|
|
![]()
Олигоэфиры, полученные поликонденсацией двух — и поли- функциональных спиртов и карбоновых кислот или их производных, принято называть немодифицированными.
Среди немодифицированных олигоэфиров в отдельную группу обычно выделяют олигоэфиры, полученные с использованием виниловых исходных компонентов, например малеинового ангидрида или акриловых кислот. Эти олигоэфиры называют ненасыщенными.
Олигоэфиры, полученные с применением различных модификаторов, называют модифицированными. В качестве модификаторов обычно используют предельные и непредельные монокар — боновые жирные кислоты или их триглицериды (растительные масла), кислоты канифоли, ароматические монокарбоновые кислоты и другие соединения. Модифицированные олигоэфиры известны также под термином алкидные олигомеры (или ал — киды) [4].
Классификацию основных типов олигоэфиров можно представить схемой, приведенной на с. 116.
Кроме этих основных типов сложных олигоэфиров известно большое число их всевозможных модификаций — как за счет сочетания олигоэфиров разного строения, так и в результате их химического взаимодействия с мономерами, олигомерами и полимерами других классов (например, алкидноакриловые и ал — кидностирольные, меламино — и карбамидоалкидные олигомеры и др.).
ОЛИГОЭФИРЫ
|
^модифицированные |
![]() Модифицированные (адкиды)
Модифицированные (адкиды)
|
|
|
|
|
|
|
|
|
Олигозфир- |
Олигозфир- |
|
|
Иалеинаты |
Акрнлаты |
|
Замена части масла бензойной кислотой канифолью, СЖК |
![]()
Органорастворимые ЛКМ
|
Порошковые ЛКМ |
![]()
ЛКМ без растворителей
ЛКМ с высоким содержанием основного вещества
Водоразбавляемые
ЛКМ
 3 сентября, 2013
3 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 