Модифицированные олигоэфиры, являются наиболее распространенным типом пленкообразующих веществ, применяемых в лакокрасочной промышленности. Это обусловлено сочетанием комплекса ценных свойств покрытий на основе этих олигомеров с наличием обширной и разнообразной сырьевой базы для их получения. При производстве модифицированных олигоэфиров наиболее полно реализуются условия широкого и направленного варьирования свойств лакокрасочных материалов. На основе модифицированных олигоэфиров получают эластичные
Атмосферостойкие покрытия с высокой механической стойкостью, способные в большинстве случаев отверждаться на воздухе. Благодаря хорошим технологическим свойствам и высокому качеству покрытий эти материалы составляют значительную долю всей синтетической лакокрасочной продукции.
Как и при получении немодифицированных олигоэфиров, основная полимерная цепь алкидов образуется за счет поликон- денсации многоатомных спиртов с полиосновными кислотами. Для этой цели используют такие спирты, как глицерин НОСН2—СН(ОН)СН2ОН, триметилолэтан СН3С(СН2ОН)3,
|
О |
![]()
|
Ноос |
![]() Триметилолпропан С2Н5С(СН20Н)з, пентаэритрит С(СН2ОН)« и кислоты (или их ангидриды): ангидрид о-фталевой кислоты (фталевый ангидрид) СбЙ4(С0)20, тримеллитовый ангидрид
Триметилолпропан С2Н5С(СН20Н)з, пентаэритрит С(СН2ОН)« и кислоты (или их ангидриды): ангидрид о-фталевой кислоты (фталевый ангидрид) СбЙ4(С0)20, тримеллитовый ангидрид
Адипиновая НООС(СН2)4СООН, себа-
Циновая НООС(СН2)8СООН кислоты и др.
Наиболее часто при синтезе алкидов используют глицерин или пентаэритрит в сочетании с фталевым ангидридом. Такие алкиды называют соответственно глифталями и пентафталями.
Модификация достигается в основном за счет использования кислотных модификаторов, представляющих собой различные монокарбоновые кислоты и их производные: растительные масла (или их жирные кислоты), синтетические жирные кислоты с линейной или а-разветвленной цепью, канифоль, ароматические монокарбоновые кислоты, талловое масло.
Модификация такого типа является наиболее распространенной. В последнее время наметилась и тенденция модификации алкидов за счет изменения структуры их спиртового фрагмента, которая осуществляется введением в рецептуру алкида а-оксидов, оксалей и др.
Растительные масла представляют собой смешанные триглицериды карбоновых кислот (триглицериды):
ОСОК’ ОСОЙ"ОСОЙ"’
Где ГГ, И", К’" — алифатические радикалы с прямой цепью ненасыщенных и насыщенных жирных кислот общей формулы С„Н2„_„ в которых п=15—17; л-==0; 2; 4; 6.
К таким маслам относятся в первую очередь тунговое, льняное, подсолнечное, соевое, хлопковое. Применяемое иногда касторовое масло содержит в своем составе гидроксикислоту С17Н32(ОН)СООН с одной двойной связью.
Жирные кислоты растительных масел используют и в свободном виде. Подробные характеристики растительных масел и жирных кислот, входящих в их состав, приведены в разд. 8.1.1.
Синтетические жирные кислоты с линейной цепью — предельные одноосновные карбоновые кислоты, получающиеся путем окисления парафинов. Они представляют собой смесь кислот с различным числом атомов углерода. Промышленность выпускает их в виде фракций, например Сю—С13, Сю—С16. Данные о составе этих фракций приведены ниже:
Содержание во фрак — Содержание во фрак — Кислота ц1ш Сю—С|3, % цин С,0—Си, %
TOC o "1-5" h z Каприловая (Св) 0,2 3,4
Пеларгоновая (С9) 7,0 10,3
Каприновая (Сю) 14,0 11,1
Ундекановая (Си) 25,5 14,8
Лауриновая (С)2) 27,1 14,2
Тридекановая (Сіз) 18,7 14,3
Миристиновая (См) 7,5 11,3
Пентадекановая (С]5) — 8,9
Пальмитиновая (Сі6) — 8,1
Маргариновая (С17) — 3,4
В промышленности синтетические жирные кислоты этого типа принято называть сокращенным термином СЖК.
Синтетические жирные кислоты с а-р азвет — вленной цепью. К таким кислотам относятся высшие изомерные карбоновые кислоты (ВИКК), представляющие собой смесь а — и а, а-разветвленных предельных одноосновных карбоновых кислот Сд—С17. Их можно получать инициируемой пероксидами теломеризацией этилена или других олефинов при участии кислот. Образование а-разветвленных кислот по этому методу обусловлено перегруппировкой радикалов с 1,5-миграцией водорода по схеме:
„ I I I
СН3—С—— О—О—С—СН3 —— V 2СН3—С—О — (2.38)
СНз СН3 СНз
СН3 СНз
СНа—С—О-+ СНзСООН ——— > — СН2—СООН+СНз—С—ОН (2.39)
СНЯ СНз
•СН8—С:^ + СН2=СН2 > — СН2(СН2)2-СООН (2.40)
•СН2(СН2)2СООН+СН2=СН2 —*• — СН2(СН2)4—СООН (2.41)
|
(2.42) |
![]()
|
Перегруппировка • ,t -СН2(СН2)4СООН——————————— СН3(СН2)3СНСООН |
![]() CHs(CH2)3CHCOOH + nCH2=CH2
CHs(CH2)3CHCOOH + nCH2=CH2
СН3( СН2)3—СН—СООН (2-43)
(СН2—СНг),,-!—сн2—СН2 СН3— (СН2) з—СН—СООН — г СНзСООН *
(СН2—СНг)«.!—СН2—сн2
—— >- СН3(СН2)з—СН— СООН + СН2СООН (2-44>
(СН2—СН,)^!—СН2СН3
Усредненный состав ВИКК приведен ниже:
Кислота Содержание" (масс.)
|
SO |
![]() А-Метил-а-бутилмасляная а-Метилкаприловая
А-Метил-а-бутилмасляная а-Метилкаприловая
А-Метил-ос-бутилкапроновая
TOC o "1-5" h z а-Метил-а-этилкапрнловая ^
«-Метилкаприновая
А-Метил-а-бутилкаприловая 15- 20
А-Метил-а-этилкаприновая
А-Метиллауриновая
А-Метил-ос-бутилкаприновая
А-Метил-а-этиллауриновая 2
А-Метилмиристиновая 2 3
А-Метил-а-бутилауриновая 3 5
Для модификации часто используют глицидиловые эфирЬ1 ВИКК: R—СОО—СН2—СН—СН2, где RCOO —остаток ВИК*.
О
Что обусловлено низкой реакционной способность!0 «-разветвленных кислот в реакциях этерификации.
Канифоль — смесь изомерных одноосновных кислот тер^ пенового ряда с общей формулой С19Н29СООН (подробнее составе и характеристике кислот канифоли см. разд. 8.2.1).
Талловое масло — побочный продукт сульфатно-целлК’* лозного производства. Вязкая жидкость от темнО’кРасного Д темно-бурого цвета с неприятным запахом. По химическому составу талловое масло — смесь одноосновных кислот теРпе1 вого ряда и одноосновных жирных кислот с нейтральным веществами и продуктами окисления. Оно не имеет устойчива физико-химических констант, что обусловлено ег° непост янным составом. Состав таллового масла зависят от вида сорта перерабатываемой древесины, условий произрастай дерева, времени рубки, а также от метода переработки суЛ фатного мыла.
Усредненные характеристики таллового масла приведены ниже:
Кислотное число, мг КОН/г 100—160
Число омыления, кг КОН/г 120—180
Содержание, % (масс.):
TOC o "1-5" h z кислот терпенового ряда 20—40
Жирных кислот 40—50
Неомыляемых веществ 5—35
Кислоты терпенового ряда, входящие в состав таллового масла, являются смесью изомеров кислот С^НгдСООН, близких по составу к кислотам канифоли.
В состав жирных кислот таллового масла входят в основном ненасыщенные и в небольшом количестве насыщенные кислоты с числом углеродных атомов от 14 до 24.
Ниже приведен примерный состав жирных кислот таллового масла, %:
Ненасыщенные кислоты:
TOC o "1-5" h z олеиновая 32—48
Линолевая 45—79
Линоленовая 0—6
Насыщенные кислоты (миристиновая, 5—7
пальмитиновая, стеариновая и др.)
Нейтральные (неомыляемые вещества) таллового масла содержат фитостерины, высокомолекулярные алифатические спирты и смолы.
Обычно для модификации алкидных олигомеров используют не само талловое масло, а продукты его дистилляции. Наиболее часто для этой цели используют фракции, полученные при дистилляции (первая фракция не используется).
Вторая фракция — жирные кислоты таллового масла — (ЖКТМ) представляет собой смесь олеиновой и линолевой кислот со степенью чистоты 97—98%.
Третья фракция — дистиллированное талловое масло — (ДТМ) содержит 30% кислот терпенового ряда и 66% жирных кислот.
Четвертая фракция — кислоты терпенового ряда со степенью чистоты 94%.
Наибольшее практическое значение для модификации алкилов имеет вторая фракция ЖКТМ, состав которой по существу близок к жирнокислотному составу высыхающих растительных масел. Третья и четвертая фракции используются при получении алкидов, близких по свойствам к модифицированным канифолью.
Из бензойных кислот для модификации олигоэфироа используются:
|
СООН |
![]()
|
СООН |
![]()
|
-сн. |
![]() СООН 6
СООН 6
|
С(СНа)3 ?ег-бутилбензойная Кислота |
![]() СНз
СНз
2,4-диметилбензойная
Кислота
Бензойная кислота п-
Основными из приведенных выше модификаторов ЯВЛЯЮТСЯ’ растительные масла, которые вводятся в состав алкидов в количестве от 30 до 70% (масс.).
В зависимости от количества растительных масел, входящих в рецептуру алкида, различают: жирные, средние и тощие алкиды с содержанием жирных кислот соответственно более 45, от 35 до 45 и менее 35% (масс.). Наличие в триглицеридах алифатических жирнокислотных остатков с длинно» цепью придает алкидам в покрытиях исключительно высокие физико-механические свойства. Двойные связи, содержащиеся в большинстве масел, сообщают олигомерам важное в практическом отношении свойство — способность отверждаться на воздухе за счет окислительной полимеризации, но в то же время повышают склонность покрытий к старению и ухудшают светостойкость.
Применение других приведенных выше модификаторов; (СЖК, ВИКК, канифоль, бензойные кислоты) вызвано прежде всего стремлением к экономии растительных масел. Несмотря на то, что ни один из этих модификаторов не содержит в своей структуре активных в реакции окислительной полимеризации двойных связей, при частичной замене масла этими модификаторами еще сохраняется способность алкидов отверждаться на воздухе.
Принципиально возможно получение и безмасляных алкидов. Для их синтеза используют в основном СЖК и ВИККи. Канифоль и бензойные кислоты как самостоятельные модификаторы не применяют из-за высокой хрупкости получаемых продуктов. Безмасляные алкиды не способны к процессу окислительной полимеризации, их отверждают иными способами.
Таким образом, варьируя состав модификаторов и их количество в рецептуре алкида, удается целенаправленно изменять свойства олигомеров в широких пределах. За счет модификации также значительно улучшается растворимость олигомеров в относительно дешевых неполярных углеводородах, что имеет важное значение с экономической точки зрения.
Основная полимерная цепь алкидов состоит из регулярно повторяющихся фрагментов полиатомных спиртов и полиоснов — ных кислот. Возможность введения в состав алкидов монофункциональных кислот-модификаторов достигается использованием полиатомных спиртов с функциональностью больше двух (глицерин и пентаэритрит), за счет которых удается сохранить среднюю функциональность системы, по крайней мере, близкую к двум, несмотря на значительную долю монофункциональных модификаторов.
Так, при взаимодействии глицерина с одним молем кислоты-модификатора (или пентаэритрита — с двумя молями) образуются бифункциональные спирты, участвующие в дальнейшем в поликонденсации, например с фталевым ангидридом, с образованием продуктов линейного строения.
Поэтому, при введении монофункциональных модификаторов не исключается возможность получения олигомерных продуктов с достаточной степенью поликонденсации.
При использовании в качестве модификаторов растительных масел, представляющих собой триглицериды монокарбо — новых кислот, не имеющих свободных функциональных групп, их предварительно превращают в спиртовые компоненты, содержащие жирнокислотные остатки, путем переэтерификации (алкоголиза) многоатомными спиртами (глицерином или пентаэритритом).
Различная химическая природа модификаторов (свободные монокарбоновые кислоты, растительные масла или их смеси) определяет выбор метода синтеза алкидного олигомера.
Существуют следующие методы синтеза алкидов: глицерид — ный, жирнокислотный и комбинированный.
Глицеридный метод используется при получении алкидов, модифицированных маслами. По этому методу процесс проводят в две стадии.
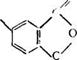
Первая стадия — алкоголиз растительных масел (переэтери — фикация), в результате которого образуются неполные эфиры полиатомных спиртов, состав которых в первую очередь определяется мольным соотношением масло: многоатомный спирт. Так, например, при мольном соотношении масло: глицерин 1:1 переэтерлфикат содержит в основном смесь моно — и диглицеридов:
|
|
|
А при соотношении 1:2—преимущественно моноглицериды: СН2ОССЖ’ СН2ОН СН2ОСОИ’ СН2ОСОИ" СН2ОСОЯ"’ |
|
СНОСОК" + 2 сн—он ^ СН20С01Г" СН2ОН (2.46> Аналогичным образом протекает и переэтерификация масла пентаэритритом: СН2ОСОЯ’ СН2ОН I I СНОСОК + НОСН2—С—СН2ОН ъ=гъ |
|
Снон I СН2ОН |
|
• снон I СН2ОН |
|
+ снон I Сн2он |
|
СН2—о—СОЯ’ I Сн—он I Сн2—осо Ул |
|
СООН |
|
О |
|
/ : / |
|
О |
|
О |
|
I СН. ОН |
|
2ОСОЯ’" СН2ОСОЯ’ |
|
СНоОН |
|
СН—ОН + Я"ОСО—СН2—С—СН2ОН СН2ОН СН2ОСОЯ’" |
|
(2.47), |
|
В состав пентафталей, как мы видим, в этом случае будут входить фрагменты как четырех-, так и трехатомного спиртов. На второй стадии моно — и диглицериды взаимодействуют с фталевым ангидридом с образованием неполных кислых эфиров: |
 |
|
 |
|
|
|
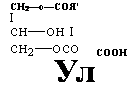 |
|
|
|
![]()
Неполный кислый эфир (I)
|
/ : Ч |
|
О О |
|
+ |
|
СНаОН К "ОСО—СН8—С—СН2ОН I СН2—ОСОЙ’" |
 |
![]()
СН4ОН
|
(2.49), |
![]() И"ОСОСН2—С—СН2—осо-
И"ОСОСН2—С—СН2—осо-
СН2—ОСОЙ’" Ноос неполный кислый эфир (II)
Эти неполные кислые эфиры (I) и (И) сразу же вступают в реакцию полнконденсации:
|
П + пІГ <- СН2—OCOR’ I Сн—оос I Соосн2 |
|
СН2—OCOR"- |
|
Соосн2—с—сн2о- |
|
Н- |
|
CH, OCOR’" |
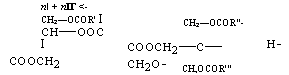 |
|||
|
|||
|
|||
|
|
![]()
Переэтерификацию проводят при 210—240°С в присутствии катализаторов PbO, Na2C03, CaO. Затем температуру понижают до 180 °С, вводят фталевый ангидрид и ведут процесс при постепенном повышении температуры до 240 °С.
Иногда, например в полунепрерывном и непрерывном способах получения алкидов, оказывается целесообразным стадии получения неполных кислых эфиров и полиэтерификации разделять во времени и выполнять как отдельные операции. В этом случае на стадии образования неполных кислых эфиров температура реакционной массы не должна превышать 180 °С.
Для облегчения удаления низкомолекулярного побочного продукта (воды) из реакционной массы на завершающих стадиях реакции поликонденсации возможно применение вакуума. Воду можно также удалять в виде азеотропной смеси с толуолом или ксилолом.
Следует отметить, что приведенная схема образования алки — да по глицеридному методу является упрощенной. Вследствие равновесного характера реакции переэтерификации переэтери — фикат имеет сложный состав: помимо моно — и диглицеридов в нем всегда содержится некоторое количество свободных по — лиатомных спиртов и триглицерида (см. табл. 2.4).
|
Таблица 2.4. Состав продукта переэтерификации хлопкового масла глицерином
|
Вследствие этого в реакции поликонденсации помимо моно — и диглицеридов всегда принимают участие и другие компоненты, что значительно усложняет структуру образующегося алкидного олигомера. Существенное влияние на структуру олигомера и его молекулярно-массовое распределение оказывают также протекающие на второй стадии в условиях высокотемпературной равновесной полиэтерификации реакции межцепного обмена (эфиролиз, алкоголиз, ацидолиз).
Среди возможных побочных реакций при синтезе алкидов следует отметить также гомоконденсацию полиатомных спиртов (polyйthйrification), приводящую к образованию простых полиэфиров, например, полиглицеринов:
2НОСН2—СН (ОН)—СН2ОН НОСН2—СН(ОН)—СИ.
|
(2.51) |
![]() —О—СН2—СН (ОН) — СН2ОН + н£о.
—О—СН2—СН (ОН) — СН2ОН + н£о.
Эта реакция протекает при высоких (^200°С) температурах. сопровождается выделением воды и катализируется теми же катализаторами, что и основной процесс полиэтерификации (polyestйrification). Однако скорость ее на два порядка меньше скорости переэтерификации.
Синтез алкидов с использованием масел, содержащих в своем составе непредельные жирные кислоты, может также осложняться процессом окислительной полимеризации по двойным связям жирнокислотных остатков, что в свою очередь влияет на характеристики образующегося продукта. Относительную долю этого процесса можно уменьшить проведением синтеза в атмосфере инертного газа, не содержащего кислорода. Однако даже в отсутствие кислорода при температурах выше 200 °С трудно избежать процессов термической полимеризации жирнокислотных остатков, протекающих в основном по реакциям диенового синтеза.
Жирнокислотный метод используется для получения алкидов, модифицированных свободными кислотами (кислоты растительных масел, СЖК и др.). Процесс проводят в одну или две стадии. При одностадийном способе все компоненты загружают одновременно и процесс ведут при постепенном подъеме температуры от 150 до 210 °С.
|
СН„—он |
![]()
|
О |
![]()
|
Сн. г-он |
![]()
|
Которые при дальнейшем подъеме температуры этерифицируют- |
![]() В силу более высокой реакционной способности фталевого ангидрида в сравнении с кислотами вначале образуются неполные кислые эфиры фталевого ангидрида:
В силу более высокой реакционной способности фталевого ангидрида в сравнении с кислотами вначале образуются неполные кислые эфиры фталевого ангидрида:
Ся кислотой и подвергаются поликонденсации:
С. Н2—ОН СН2—ОСОЯ
|
+ н2о- |
![]() СН—ОН V/ + К С. 001-1 <—> сн—он
СН—ОН V/ + К С. 001-1 <—> сн—он
|
Сн,—оос соон |
(2.53)
|
С112осон I П СН—ОН <!:н2оос. .соон |
|
Пол икоиденса ция |
|
СН2ОСОГ^ I СН2—ООС с— |
|
(2.54) |
|
ОН+ (2и — 1)Н20 |
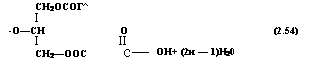 |
|
|
|
![]()
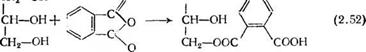
Двухстадийный процесс осуществляется по двум вариантам. По одному из них вначале в реакционную смесь вводят поли — атомный спирт и фталевый ангидрид и после завершения реакции между ними — кислоту-модификатор. В этом случае процесс может быть описан реакциями (2.52) — (2.54).
По второму варианту на первой стадии при 200—210 °С проводят реакцию между полиатомным спиртом и монокарбоно — выми кислотами, в результате которой получают неполные эфиры полиатомных спиртов:
|
+ ЗНгО (2.55) |
|
СН—он I Сн2—о—сои |
|
|
||
|
|||
А на второй стадии при 180—240 °С проводят реакцию неполных эфиров с фталевым ангидридом, приводящую в конечном счете к образованию алкидных олигомеров. Процесс на этой стадии идет по той же схеме, что и в случае глицеридного метода [см. реакции (2.34) и (2.36)].
Следует отметить, чте жирнокислотный метод дает возможность получать алкиды более регулярной структуры с хорошо воспроизводимыми характеристиками. Этот метод позволяет
Также осуществлять синтез алкидов, не содержащих в цепи глицеридных фрагментов.
Комбинированный метод включает элементы и глицеридного и жирнокислотного методов. Он используется в том случае, если для модификации алкида применяются растительные масла в сочетании со свободными кислотами (СЖК, канифоль, бензойные кислоты). По этому методу процесс ведут в две стадии, причем на первой стадии проводят одновременно реакции алкоголиза растительного масла многоатомным спиртом и частичную этерификацию гидроксильных групп свободными кислотами; на второй — осуществляют взаимодействие полученных продуктов с фталевым ангидридом и поликонденсацию:
СН—ОС01Г + IЮСН2—С—СН2С)11 + и со он <—>—
СН2—ОСОЯ"’ СН2ОН
Масло
СН2—ОСОЙ’ СНа—ОСОЙ
TOC o "1-5" h z I I
СН—ОН +НОСН2—С—СН2—0С01Г + Н20 (2.56)
СН2—ОСОК’" СН2ОН
СН2—ОСОЙ’ СН2—ОСОЙ со
Сн—он + носн2—с—сн2—осо1г + ;о
![]()
|
ПоликонденсацияЦ |
![]() СН—ОСО Г 7) + носн2—с—сн2—осоя"
СН—ОСО Г 7) + носн2—с—сн2—осоя"
I
Сн2—оаж,"^:/ сн2оос соон
Олигомер
Для контроля реакции алкоголиза растительных масел, при которой концентрация функциональных’ групп не изменяется, используют растворимость неполных эфиров полиатомных спиртов в этаноле. Иногда эту реакцию контролируют по электропроводности.
Процессы этерификации и полиэтерификации контролируются по изменению концентрации свободных карбоксильных групп в реакционной массе, которая оценивается кислотным числом. Полиэтерификация помимо кислотного числа контролируется также по изменению вязкости реакционной массы, так
Как именно этот показатель наиболее полно отражает увеличение молекулярной массы олигомера в процессе синтеза.
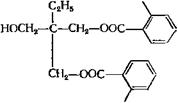
Рассмотренные выше методы синтеза алкидов используются только в случае применения в качестве модификаторов растительных масел или карбоновых кислот. Применение других, пока еще менее распространенных модификаторов, например глицидиловых эфиров ВИКК (сс-оксиды), вносит свои существенные особенности в процесс: модификация происходит за счет взаимодействия по карбоксильным группам неполных кислых эфиров полиатомного спирта и фталевого ангидрида, образующихся на разных стадиях поликонденсации, с а-оксид — ным циклом:
![]() СООН
СООН
+ сн2—сн—сн,—о :ои ————— >-
![]() СООСН2— СН—СН2—OCOR I
СООСН2— СН—СН2—OCOR I
ОН (2.57)
Реакция идет при температуре порядка 150 °С; т. е. в более мягких условиях, чем этерификация и поликонденсация. Смягчение условий синтеза обусловливает уменьшение доли реакций межцепного обмена и способствует получению продуктов более регулярной структуры. Схему синтеза алкида, модифицированного глицидиловым эфиром ВИКК, можно представить следующим образом.
|
СООН |
![]()
|
СООН |
![]()
 На первой стадии происходит взаимодействие полиатомного спирта с фталевым ангидридом, приводящее к образованию неполных кислых эфиров, этерификация свободных карбоксильных групп глицидиловым эфиром и гомополиконденсация образующегося продукта:
На первой стадии происходит взаимодействие полиатомного спирта с фталевым ангидридом, приводящее к образованию неполных кислых эфиров, этерификация свободных карбоксильных групп глицидиловым эфиром и гомополиконденсация образующегося продукта:
С2Н8 СО
HOCH*— С—СНаОН+ 20^
CHjjOH со ^
|
Процесс на этой стадии ведут при постепенном повышении температуры от 150 до 210°С. На второй стадии полученный олигомер дополнительно обрабатывают при 150°С фталевым ангидридом и глицидиловым эфиром, при этом образуется продукт следующей структуры: с2н5 —OCH. CCH. OOC — |
|
Н— |
|
—он |
|
COOCH2CHOHCH2OCOR продукт I) Гомопол нконд е не ация |
|
Продукт I C2HS |
|
Н— |
|
—о—сн2—с—сн2—оос |
|
—ОН+(2я—1)НаО (2.60) |
|
Со— |
|
Сн2—оос |
|
Соон С2Н5 I НОСН2—с—сн2—оос |
|
Соон |
|
“О Сн2—оос—" |
|
|
 |
|
|
|
 |
|
|
|
 |
|
|
|
|
|
|
|
|
|
|
Алкиды представляют собой олигомеры сложной разнозвенной структуры с Мп от 1200 до 3000—5000. Они имеют исключительно широкое молекулярно-массовое распределение: степень полидисперсности может достигать даже 100. Такие структурные характеристики алкидов обусловлены специфическими условиями их синтеза, представляющего собой систему большого числа последовательно-параллельных равновесных реакций, осложненных целым рядом побочных процессов, и в первую очередь — реакциями межцепного обмена, причем доля большинства побочных процессов возрастает с увеличением температуры синтеза. В то же время процесс синтеза алкидов подчиняется всем основным закономерностям, характерным для реакции поликонденсации. Так, средняя величина молекулярной массы алкида определяется соотношением и характером исходных веществ (рецептура алкида), которые в конечном счете определяют среднюю функциональность системы, а также степенью завершения реакции (р). Особенно большое значение имеет количество введенных модификаторов, поскольку в большинстве случаев они представляют собой монокарбоновые кислоты (или их производные) (/==1) и фактически играют роль обрывателей материальной цепи. Проследить соблюдение этих закономерностей можно на примере модифицированных талловым маслом пентафталевых олигомеров, синтезированных жирнокислотным методом в две стадии при 240°С. В табл. 2.5 приведены данные об изменении молекулярно-массовых характеристик алкида на основе пентаэритрита, фталевого ангидрида и жирных кислот таллового масла в зависимости от доли кислот-модификаторов (Ь), избытка гидроксильных групп относительно карбоксильных (Ц) и степени завершенности реакции (р).
Как видно из данных таблицы, молекулярная масса алкида увеличивается с уменьшением доли кислот-модификаторов
|
Таблица 2.5
|
|
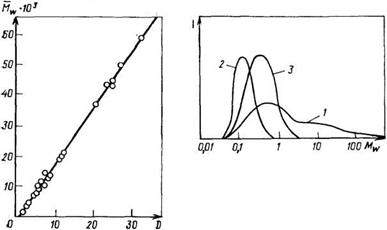
Рис. 2.9. Молекулярно-массовое распределение алкидного олигомера, полученного глицеридным способом (1) и с использованием специальных приемов при синтезе (2, 3): 2 — Мш = 1500; 3—МК=3500 |
Рис. 2.8. Зависимость степени полидисперсности £> от молекулярной массы Мт
(Ь), приближением загрузочной рецептуры к эквивалентному соотношению карбоксильных и гидроксильных групп (уменьшение /?) и с увеличением степени завершенности реакции (р).
Следует отметить, что с увеличением средней молекулярной массы алкидов степень их полидисперсности (й) возрастает (см. также рис. 2.8), причем эта закономерность является общей для алкидов с разными модификаторами (талловое, льняное, соевое масло, канифоль и др.), синтезированных любыми из трех применяемых в промышленности способами.
С использованием специальных приемов синтеза можно добиться получения алкидов с узким ММР, не содержащих высокомолекулярных фракций. Такие приемы, как правило, сводятся к использованию специальных видов сырья (например, глицидиловых эфиров) или катализаторов высокой активности, что позволяет в значительной мере понизить температуру синтеза и в то же время получить алкид с четко выраженной заданной структурой.
На рис. 2.9 приведены типичные кривые ММР для алкидов, модифицированных жирными кислотами, синтезированных традиционным способом (кривая 1) и с использованием специальных приемов (кривые 2 и 3). Однако в промышленности такие приемы пока еще мало используются.
Молекулярно-массовое распределение алкидов в свою очередь оказывает большое влияние на вязкость их растворов, которая, как правило, определяется относительной долей высокомолекулярной фракции. Поэтому растворы алкидов с узким ММР имеют более низкую вязкость.
Функциональный состав алкида, характеризующий относительное содержание различных функциональных групп, также определяется рецептурой алкида и степенью завершения реакции в момент ее прекращения. Алкиды обычно получают при некотором избытке спиртовых компонентов [ОН/СООН от 1,2 до 1,3—1,4 (экв)], что обусловливается ограничениями по молекулярной массе и кислотному числу олигомеров. Если взять спирт в избытке, появляется принципиальная возможность получения алкида с кислотным числом, близким к нулю, однако в зависимости от назначения синтезируемого продукта процесс останавливают на различных стадиях его завершения (кислотные числа олигомеров от 1—2 до 60—80 мг КОН/г). Содержание гидроксильных групп колеблется от 100 до 200 мг КОН/г, т. е. в молекуле любого алкида всегда имеется значительно большее количество гидроксильных групп по сравнению с карбоксильными.
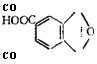
Взаимное расположение групп СООН и ОН в молекуле алкида определяется характером исходных веществ. Так, например, введение в состав основных кислотных компонентов
|
СО СО |
|
Позволяет по- |
![]() Тримеллитового ангидрида
Тримеллитового ангидрида
Лучать продукты с регулярно расположенными вдоль полимерной цепи карбоксильными группами.
Предельно достижимая степень поликонденсации алкидного олигомера (т. е. точка его гелеобразования) предопределяется закономерностями трехмерной поликонденсации: доведение
Процесса до высоких степеней завершения реакции (>90%) возможно только при средней функциональности системы, близкой к двум (обычно 2,08—2,09), что достигается применением наряду с полифункциональными компонентами (/=3—4) одноосновных кислот-модификаторов, выступающих с рассматриваемых позиций в роли обрывателей цепи. Типичная структура фрагмента цепи алкида показана на рис. 2.10 на примере глифталя, модифицированного непредельными жирными кислотами.
Кислоты-модификаторы с объемными углеводородными радикалами придают алкидам (в отличие от немодифицирован — ных олигоэфиров) способность растворяться в неполярных углеводородах (уайт-спирите, ксилоле и др.).
В структуре алкидного олигомера могут содержаться двойные связи, вводимые с остатками непредельных жирных кислот растительных масел. Количество двойных связей в молекуле
Рис. 2.10. Фрагмент цепи глифталевого олигоэфира, модифицированного непредельными жирными кислотами
Алкида определяет их способность к «высыханию» в пленке. По способности к высыханию различают высыхающие а невысыхающие алкиды. Хорошо отверждаются олигомеры, в молекулах которых содержится не менее 6—7 двойных связей. Это означает, что, если для модификации олигоэфира использовать высыхающее масло (например, льняное)г то в молекулу достаточно ввести 2—3 жирнокислотных остатка. При модификации полувысыхающими маслами (подсолнечным, хлопковым) необходимо ввести не менее 6 жирнокислотных остатков.
Число жирнокислотных остатков в молекуле алкида может варьироваться за счет изменения их количества в одном элементарном звене (т. е. «жирности» алкида), а также за счет изменения степени его поликонденсации, что необходимо учитывать при подборе компонентов алкидов и их соотношения. Так, в частности, использование пентаэритрита (/=4) вместо глицерина (/=3) делает возможным получать хорошо высыхающие алкиды не только на полувысыхакмцих, ио и на невысыхающих маслах. Эти представления легли в основу теории о влиянии атомности спиртов на способность алкидов к «высыханию».
Алкиды используются в составе органорастворимых и водоразбавляемых лакокрасочных материалов. В традиционных органорастворимых материалах используют модифицированные олигоэфиры с Мэт=3000—4000. Величины их кислотных и гидроксильных чисел составляют соответственно от 1—2 до 30 и 100—120 мг КОН/г. Содержание основного вещества в таких лакокрасочных материалах составляет в большинстве случаев 40—60% (масс.).
|
|
|
1д г)[Па-с] |
|
Ц. Па-с |
|
С |
|
50 Сос*.С,% |
|
100 |
|
0 2 4 |
|
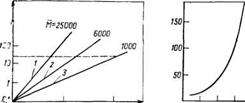
Рис. 2.П. Зависимость вязкости растворов алкидов различной молекулярной массы Л/ц от содержания основного вещества Сосн.®: У—¥=25000; 2 — ЛГ=6000; 3 — Д[=1000 |
Рис. 2.12. Зависимость вязкости растворов алкидного олигомера т] от молекулярной массы Ма
Особые требования предъявляются к структуре алкидов, используемых для получения материалов с высоким содержани — ■ем основного вещества [^70% масс.)].
Уменьшение относительной доли растворителя при заданной величине вязкости раствора можно добиться путем снижения молекулярной массы олигоэфира (рис. 2.11). Из приведенных на этом рисунке данных видно, что заданная величина вязкости растворов (на рисунке показана пунктиром) для олигомеров с молекулярными массами Мравными 1000, 6000, 25000 достигается соответственно при содержании основного вещества около 100, 60 и 35% (масс.). Таким образом, одним из критериев оценки возможности использования алкидного олигомера в материалах с малым количеством органических растворителей является молекулярная масса олигомера.
Зависимость вязкости раствора алкида от его молекулярной массы (рис. 2.12) имеет экспоненциальный характер; причем особенно резкое нарастание вязкости наблюдается при молекулярной массе >2000. Поэтому в материалах с высоким содержанием основного вещества применяют алкиды с молекулярной массой порядка 1000—2000. Очевидна также целесообразность стремления к получению олигомеров с относительно узким ММР, поскольку у алкидов с широким ММР высокомолекулярные фракции обусловливают высокую вязкость растворов.
Таким образом, для получения алкидных лакокрасочных материалов с высоким содержанием основного вещества предпочтительно использование низкомолекулярных олигомеров с относительно узким ММР. Нижний предел величины молекулярной массы определяется пленкообразующими свойствами.
Дополнительным приемом снижения вязкости растворов алкидных олигомеров является подавление ассоциации молекул олигомера за счет взаимодействия полярных групп (преимущественно гидроксильных и сложноэфирных) с образованием водородных связей. Это достигается введением в состав раствора электродонорных растворителей (например, кетонов):
Н
|
(2.62) |
![]() [олигомер]—ОН-••
[олигомер]—ОН-•• ![]() [олигомер]
[олигомер]
|
|
[олигомер]—ОН— 0=С С=0— НО—[олигомер]
И А
Водоразбавляемые алкиды по своей структуре принципиально не отличаются от органорастворимых. Для них характерны низкая молекулярная масса (1200—1300) и повышенное содержание гидрофильных (гидроксильных и карбоксильных) групп: кислотные числа 50—80, гидроксильные — 150—200 мг КОН/г. Водоразбавляемость алкидов определяется не только количеством этих групп, но и равномерностью их распределения в макромолекуле, которое достигается, например, при использовании производного трехосновной кислоты — тримеллитового ангидрида. В этом случае получаются алкид — ные олигомеры, содержащие карбоксильные группы не только на концах макромолекулы, но и вдоль полимерной цепи:
Ж он ж
Но—г—т—г—т—г—т—соон,
I I I СООН СООН соон
Где Г — остаток глицерина; Т — остаток тримеллитового ангидрида; Ж — остаток жирной кислоты (модификатора).
Перевод в солевую форму карбоксильных групп олигомеров основаниями (аммиаком или аминами) дает возможность разбавлять их водой. При синтезе водоразбавляемых алкидных олигомеров может использоваться то же исходное сырье, что и при синтезе органорастворимых алкидов (масла или их жирные кислоты, синтетические жирные кислоты, глицерин, пентаэритрит, фталевый ангидрид и т. п.). Кроме того, для их получения применяются тримеллитовый ангидрид и двухатомные спирты.
Состав исходных компонентов определяется в первую очередь функциональностью основного кислотного компонента
(фталевый или тримеллитовый ангидрид). В сочетании с фта — левым ангидридом необходимо использовать полиатомные спирты (глицерин, пентаэритрит). При получении олигомеров с триметиллитовым ангидридом в качестве спиртов используют глицерин, гликоли и их смеси. Спиртовые компоненты всегда берутся в значительном избытке. При введении большого количества жирнокислотных остатков в состав водоразбавляемых олигомеров ухудшается их гидрофильность. Поэтому с применением растительных масел выпускают только тощие и средние водоразбавляемые алкиды.
Улучшению водоразбавляемости способствует также и применение полиэтиленгликолей, обладающих высокой гидрофиль — ностью. Специфические показатели готового продукта обусловливают особые требования, предъявляемые к составлению рецептур водоразбавляемых алкидов.
Расчет рецептуры алкидов представляет собой сложную задачу. При ее решении необходимо учитывать в первую очередь возможность проведения ■синтеза до высокой степени завершения реакции без гелеобразования. Задача осложняется тем, что обычно реакционная система при синтезе алкида состоит из смеси до 5—6 компонентов различной функциональности (от 1 до 4).
Традиционный метод расчета рецептуры алкидов базируется на уравнении Карозерса, причем основным критерием при выборе рецептуры алкида служит степень завершенности реакции р в момент гелеобразования:
Р=2// — 2УУт//Д^о, (2.63)
Где А’о — общее число молекул в исходной смеси; Мт — число молекул в реакционной массе к данному моменту времени; f — средняя функциональность системы.
К моменту гелеобразования вторым членом уравнения (2.63) можно — пренебречь, поскольку Ыт < М>- Поэтому степень завершенности реакции при гелеобразовании рг выражается уравнением
Рг=2Я. (2.64)
Заменяя / отношением общего числа эквивалентов функциональных групп е0 К числу молекул N0 в ИСХОДНОЙ смеси, МОЖНО представить Рг следующим образом:
Рг=2М,/е0. (2.65)
Поскольку синтез алкидов всегда ведут при некотором избытке спиртовых компонентов, к моменту полного завершения полиэтерификации все карбоксильные группы считаются прореагировавшими, т. е. общее число прореагировавших эквивалентов функциональных групп к этому времени составит 2ее (где ек — число карбоксильных эквивалентов в исходной реакционной смеси). Поэтому для реальных условий синтеза алкидов
Рг=2ЛГ0/2ек=ЛГ0/ек. (2.66)
Для предотвращения возможности гелеобразования алкида в процессе его синтеза при составлении рецептур задаются величиной Лг0/ек>I. Эта величина получила название алкидной константы и обозначается через К*-
Къ=Ы0/е к. (2.67)
І=/ i=> fzv 1 + г1У £
(UZ) • ^J *=х
Ч*вК
S
: (xoir
-эия xIчнdиж woxaiiA з) ивхнаїгваияяє нннчігизяодсівя иээа ом (этави а вэох — эГпвжйэЖю ‘BHHcIatinifj иоіаьА з) аохнэноикоя xnaoidnua хээа аоінаг-ваиамє иэинэгаоихооэ кзізвжв(1ічв if uuXdj хннчігизносіїґил н о х я g є и
•aoxdHUS хиниохвохонэд оігзиь — 5 ОBxdnua dawon — ц оBidnus чхэониохв
— X iBidHUD OJOHWOIBOJOHW аохнзігваиаяє XHHqifHOHodVHj оігзиь — *g am
І=ч і=/ і=л
(ог-z) ‘**3**9 К + ff3!V ’К + n3nv
S d d
:зігЛш1оф ou вне-шкхіегї чхнд хэжои д вээви kbпtiqq •нхоігзия ионаоизохХаїґ и-І нохнаїгваиаме ввиавігаїґяа ‘мїґоа вззви — !zH їнхоїгзия ионаонзохЛаїґ da нон — / їхотин хічнаонзохАвїґ оігоиь
— Ц ‘юігзия хннаонзохЛаІґ аохнзігваиаяє хннчі/измодйвм оизиь—hy іяхоїгзия ионаонзоонїґо иіги вігзви иохнаїгваиамє кенакігаїгна ‘ічі/оа вээви — »fj івззвиі ввіпдо — !if33ew явхэоэ а хи’гпкіГоха_ зігзиь wox а ‘xou-эия хянаонзоонїґо ou-эиь — d івігави иіги ічхоїгоия HOHdHK ио-; вээви квнхнакваиамє — ‘.хотаим хниаонзоонїґо аохнаїгваиаяє xHHqim3HogdBH оіґзиь— ‘у :% ‘чхоонгїиж— Q al/j
І=/ 1=7
FzHfzv ^-nHnv £-4,
(69’S) ‘001————— 5————————— t=0
*i3?V Ј d
Гигевииэшонхооэ HufmnoiДffaira K3x3B*Bdiqa BdawoJHifO qx30Hdn)j^
‘ЭЖИН ННЭ1Г
-aexaffadu xiqdoxoH bitV винэжвdIqa анннаШдодо ‘вхнвхзном ивнтгияігв и uuДdj xmiqirHaHodl/iu яохндєи :«ошнвхнаяа» я чхэоидоэоиэ xaKiravaduo хоігзия хин — dH« XHHqiratraduaH mmaiiswHdu и(іи BBdoxoM ‘«чхзонёиж» лжіхзивсіви ззнвсіве зічизваві/вє ннажоїтон аоїґинігв dXxuatiad Biased iqwwedjodu Ляоноо g
10‘О— HBuoduiroifHxawHdx ‘HBxemuawHdx
00‘0 xndxHdeBXHau ‘niidonnr:.i ‘чі.-omiiii’j
[0‘0 їГисІїґшнв ииаэь-вхф
50*0 otobw aoaodox3BH aoHHEaodiiicdtriuajr
Ј0‘0— чгофинв>|
[0‘0— віогаин квниоєнад
I.’33BW
0 OJOHOL-L-Cl ‘OJOeaOD ‘OJOHKH4IT ИХОГЭИЯ CMьdil)]/
:ажин nnaпraaiidu -!,уу ічхнаиїщффєом onimoaecluoii auMoahudmmg
В1НЭНОПКОМ OJ-.I KL-f хнантшффєом иічньоа — Btluou — !<7V tadAxuatiad ионнвг a хічизАечітоизи ‘аохнэноиком огонь — и ai/j
=f
(89 ‘ S) ‘!Wl4+i,= E^
Аі-.{к<1оф ou чхвхиьээвё он
-жоп B4di43 ojont/охэи 10 ихэомиэиаве a °y пниыимв кинаьвнє оічіт-вмнхно
Р+0+5
^ М«
Кя= Р <=1 0 , (2.72)
(=1 /=1
Где 2-М,- — общее число молей.
В случае простых рецептур алкидов, включающих небольшое число компонентов, их расчет может быть легко осуществлен аналитически с использованием уравнений (2.69), (2.71) и (2.72). Сложные рецептуры рассчиты
Ваются с использованием вычислительных машин. Для составления программы расчета приведенные выше выражения преобразовываются в следующую алгебраическую систему:
TOC o "1-5" h z р О
2Ми + 2 Ли=[5]1: (2.73)
^=l /=1
2 ЛчО/Ри-Ы + Я А*(ЧРщ/-Ка) + 2 = (2.74)
1-1 /=1 А=1
Р о 5
2 Аи Ри — Ни) + 2 А*1 (Г2Г-Л2Л + 2 — А1пЕ1п (1-У)/0„=0;
(-1 1=1 к= 1
(2.75)
2 А^-А2ТЕ2Т/ВТ = 0; (2.76) = (2.77)
1=1 к= 1
5
2 № — ВхиЕхи/Ви, (2.78)
К=1
Где ^2/ — функциональность /’-ой многоосновной кислоты; Р** — функциональность /г-атомного спирта; п—1, 2, …, р, 1/ — число не вступивших в реакцию компонентов; £>„ — массовая доля жирной кислоты; Т= 2, 3, …, С?;
— массовая доля миогоосиовной кислоты; и= 3. 4, …. 5; — массовая
Доля многоатомного спирта.
Уравнением (2.71) произвольно задается сумма кислотных эквивалентов; уравнение (2.72) получено несложным преобразованием выражения (2.70) в показывает связь алкидной константы со средней функциональностью реакционной смеси; уравнение (2.73) получено преобразованием уравнения (2.77).
Уравнения (2.74)—(2.76) служат для расчета соотношений между входящими в рецептуру реагентами. Уравнением (2.74) задается соотношение между входящими в рецептуру многоосновными кислотами, а уравнением (2.78)—соотношение между многоатомными спиртами. Уравнение (2.77) получено из уравнения (2.73), если знаменатель последнего равен 1.
Так, например, при подсчете рецептуры алкида из жирных кислот дегидратированного касторового масла, бензойной и изофталевой кислот, пентаэритрита и этиленгликоля, задаваясь алкидной константой Ка=1,06*, ж ирг
ностью С=40; избытком гидроксильных групп Я= 1,2 и У=0, получаем следующую рецептуру для алкида*:
Жирные кислоты дегидратированного касторово — 0,225/37,26
|
0,065/4,66 0,71/34,80 0,74/14,86 0,46/8,42 |
![]() Го масла
Го масла
Бензойная кислота Пзофталевая кислота Пентаэритрит Этиленгликоль
• В числителе —в экв., в знаменателе — в % (масс.).
При этом уточненные параметры алкида равны: /Са = 1,06; 6=49; /?= 1,2.
Рассмотренный выше метод расчета, несмотря на свою большую практическую ценность, является в достаточной мере приближенным, поскольку в нем используются эмпирические поправочные коэффициенты (А&{). Получаемые этим методом результаты служат вполне надежной исходной основой для расчета новых рецептур.
2.2.4.3. Процессы пленкообразования лакокрасочных материалов на основе алкидных олигомеров
Процессы пленкообразования алкидов в покрытиях могут происходить как за счет их дальнейшей поликонденсации, так и вследствие окислительной полимеризации остатков ненасыщенных жирных кислот-модификаторов. Вклад того или иного механизма определяется химическим составом исходных продуктов, а также условиями отверждения олигоэфиров.
Окислительная полимеризация относительно легко протекает уже при комнатной температуре и может быть в еще большей степени ускорена при добавлении сиккативов (о механизме окислительной полимеризации, сиккативах и принципах их ускоряющего действия см. подробно в разд. 8.1.4.1 и 8.1.5). Для отверждения за счет поликонденсации необходимы высокие температуры («150°С).
Способность к «высыханию» в условиях комнатной температуры является преимуществом алкидов, модифицированных растительными маслами. Вместе с тем при введении непредельных жирных кислот в макромолекулу алкидов ухудшается светостойкость за счет процессов окислительной деструкции.
При использовании алкидов в сочетании с олигомерами других типов (чаще всего, карбамидо — и меламиноформальдегид — ными) в процессах отверждения принимают участие функциональные группы олигомеров обоих типов. Как правило, это материалы горячего отверждения. Подробнее о химической природе процессов отверждения и условиях их протекания (температура, катализаторы) см. в гл. 3.
Отверждение водоразбавляемых алкидных олигомеров в покрытиях возможно за счет реакции окислительной полимеризации (в том случае, когда олигомер получен с применением масел) и за счет дальнейшей поликонденсации по —ОН и —СООН-группам при температурах порядка 150—180°С. При этом вначале происходит термическое разложение аммонийных солей, а затем уже поликонденсация. Следует отметить, что при отверждении водоразбавляемых олигоэфиров за счет только окислительной полимеризации покрытия не обладают достаточной водостойкостью, так как в них остается большое количество гидрофильных гидроксильных и карбоксильных групп. Поэтому водоразбавляемые алкиды отверждают обычно в жестком режиме (до 180 °С), обеспечивающем протекание процесса поликонденсации.
 4 сентября, 2013
4 сентября, 2013  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 