Производство сажи основано на процессах неполного сгорания или термического распада органических веществ. Горение и саже — образование изучались в большом числе работ, но до сих пор полностью не исследованы, так как образование сажи — сложное явление, состоящее из ряда параллельно идущих процессов: термического распада углеводородов, сгорания их частиц и т. п.
По современным воззрениям, при сгорании углеводородов в зоне горения под влиянием высокой температуры происходит последовательное отщепление водорода от частиц углеводородов, в результате чего выделяется углерод. Схему такого процесса для простейшего углеводорода —- метана — можно представить в следующем виде:
СН4 —► СН3 + Н2 СН2 + СН4 —► С2Н6
С2Н6 —> С2Н4 + Н2 С2Н4 —* С2Н2+На С2Н2 —► С2 4- Н2
Первым этапом этого процесса является распадение молекулы метана на водород и радикал метилен. При столкновении метилена с молекулой метана образуется под влиянием высокой температуры этан. Последовательное отщепление от этана молекул водорода приводит сначала к образованию этилена, а затем и ацетилена. Ацетилен под воздействием высокой температуры распадается на молекулу водорода и радикал Са. В результате столкновений радикалов Са образуются элементарные шестигранники
плоской сажевой решетки; 3—5 параллельно расположенных плоских решеток образуют, как было указано выше, кристаллит, являющийся элементом, из которого построена сажевая частица.
 По другим воззрениям, элементарные шестигранники сажевой решетки образуются в результате дегидрирования многоядерных ароматических соединений, образовавшихся в зоне горения в результате полимеризации ацетилена под влиянием высокой температуры.
По другим воззрениям, элементарные шестигранники сажевой решетки образуются в результате дегидрирования многоядерных ароматических соединений, образовавшихся в зоне горения в результате полимеризации ацетилена под влиянием высокой температуры.
Основным процессом производства сажи является сжигание органических природных газов или таких жидких и-—реже — твердых органических веществ, которые при нагревании испаряются или разлагаются с выделением газообразных продуктов. При сжигании этих веществ образуется пламя, которое может быть несветящимся или светящимся. Несветящееся пламя образуется при сгорании веществ, в молекуле которых содержится относительно большое количество кислорода и небольшое количество углерода. В этом случае количество кислорода в зоне горения оказывается достаточным для окисления всего или почти всего углерода. Такие вещества для производства сажи непригодны. Светящееся пламя образуется при сгорании веществ, в молекуле которых содержится относительно много углерода и мало кислорода или кислород отсутствует совсем.
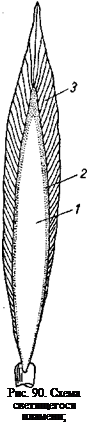
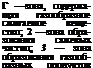 На рис. 90 показана схема светящегося пламени. В нем можно ясно различить три зоны. Во внутренней темной зоне 1 сжигаемое вещество испаряется или переходит в газообразное состояние. Температура в этой зоне невелика. В средней зоне 2 образовавшиеся пары под воздействием развивающейся в результате горения высокой температуры, доходящей до 1350°, подвергаются термическому распаду с выделением свободного углерода. Выделившиеся частицы углерода раскаляются и делают пламя светящимся. При попадании в наружную зону 3 раскаленные частицы углерода встречаются с диффундирующими в эту зону молекулами кислорода и окисляются до СОг; в наружной зоне создается высокая температура. Вследствие сгорания в наружной зоне раскаленных частиц углерода она не светится. Вели раскаленные частицы углерода вывести из средней зоны и быстро охладить или если ограничить приток кислорода к пламени так, чтобы частицы углерода в наружной зоне не окислялись, то углерод выделяется в виде сажи.
На рис. 90 показана схема светящегося пламени. В нем можно ясно различить три зоны. Во внутренней темной зоне 1 сжигаемое вещество испаряется или переходит в газообразное состояние. Температура в этой зоне невелика. В средней зоне 2 образовавшиеся пары под воздействием развивающейся в результате горения высокой температуры, доходящей до 1350°, подвергаются термическому распаду с выделением свободного углерода. Выделившиеся частицы углерода раскаляются и делают пламя светящимся. При попадании в наружную зону 3 раскаленные частицы углерода встречаются с диффундирующими в эту зону молекулами кислорода и окисляются до СОг; в наружной зоне создается высокая температура. Вследствие сгорания в наружной зоне раскаленных частиц углерода она не светится. Вели раскаленные частицы углерода вывести из средней зоны и быстро охладить или если ограничить приток кислорода к пламени так, чтобы частицы углерода в наружной зоне не окислялись, то углерод выделяется в виде сажи.
При свободном доступе воздуха к наружной зоне водород и углерод, образовавшиеся в средней зоне, окисляются. В первую очередь окисляется водород:
Н2 + О -—► Н20 -(- 68,5 шал
Для сгорания 1 кг водорода нужно 8 кг кислорода, а если принять, что в воздухе содержится 25% кислорода и что 1 ж3 воздуха весит 1,293 кг, то нужно 8 : 25 X 100 = 32 кг, или 25,5 ж3 воздуха (при 0° и 760 мм рт. ст.).
Сгорание углерода происходит при достаточном количестве кислорода по реакции
С + 02 —> С02 %■ 96,7 ккал а при недостатке кислорода по реакции:
С + 9,5 Оа —> СО + 29 ккал
Для полного сгорания 1 кг углерода нужно 32 : 12 = 2,75 кг кислорода, что составляет 11 кг, или 8,5 ж3, .воздуха (при 0° и 760 мм рт. ст.). Для сжигания углерода до СО нужно вдвое меньше воздуха, т. е. на 1 кг углерода — 4,25 ж3 воздуха. При еще меньшем количестве воздуха сгорает только часть углерода, а часть выделяется в виде частиц сажи, уносимых из пламени продуктами горения.
Вследствие применения для производства сажи различных видов жидкого и газообразного сырья, а также вследствие предъявления к каждому виду сажи других требований — единого технологического процесса получения различных видов сажи не существует. Среди большого числа технологических процессов, применяемых для производства различных видов сажи, многие не совпадают друг с другом в существенных деталях. Поэтому ниже приводятся только технологические схемы производства наиболее употребительных видов сажи.
 23 августа, 2015
23 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 