Основные хроматы цинка ZnCr04 [14] nZn(OH)2 были впервые изучены Грегером в 1911 г. [31] и лишь в 1938 г. предложены Риски — ным [25, 27, 28] в качестве пигментов. Эти соединения бывают различной основности и могут быть разделены на две группы: низко* и высокоосновные; примерное значение п для первых <3, а для вторых >3.
Основные хроматы цинка обычно получаются обработкой окиси цинка раствором хромового ангидрида, но при этом одновременно могут образоваться моно — и бихроматы цинка ZnCr04 и ZnCr207.
Бихромат цинка легко растворяется в воде, монохромат растворяется частично и легко разлагается водою. Основные хроматы цинка в воде не растворяются, причем низкоосиовные разлагаются, а высокоосновные устойчивы к действию воды.
Состав хроматов цинка зависит преимущественно от количества хромового ангидрида, которое берется для обработки окиси цинка. При высокой его концентрации и большом избытке в растворе остается значительное количество бихромата цинка, а в осадок выделяется мопохромат цинка. При снижении концентрации хромового ангидрида содержание хромата цинка в растворе уменьшается, осадок при этом состоит из хромата цинка низкой основности. При низкой концентрации хромового ангидрида образуется высокоосновной хромат цинка, раствор при этом почти свободен от растворимых солей.
Грегер установил, что монохромат цинка выделяется в виде гидратированного соединения ZnCr04 • Н20 * и что в ряду основных хроматов цинка существуют соединения определенного химического состава, а именно:
l. SZnO ■ СгОз ■ 0,5HSO 3ZnO ■ Cr03 • 2НгО
2ZnO ■ Cr03 — 1,5Н20 4ZnO. Cr03 • 3H20
Файнкнехт и Гюги-Кармес [33] в недавно проведенной работе приписывают основным хроматам цинка несколько иной состав, а именно:
2ZnO ■ СгОз • НаО 3,5ZnO — Сг03 * 2,5Н30 3-4ZnO-CrOa-3—4НаО
Высокоосновной хромат цинка, по их мнению, может быть как трех-, так и четырехосновным. Оба эти хромата построены совершенно одинаково, переход трехосновного хромата в четырехосновной достигается заменой части ионов Сг04~ на ОН“.
Более поздняя (в 1956 г.) и обстоятельно проведенная работа Вудворда, Аллена и Андерсена [34] подтверждает данные Грегера, уточняя лишь содержание воды в хроматах, а именно:
ZnO • Сг03 — 2НаО l,5ZnO • Сг03 * ЗН20 22пО • Сг03 ■ Н20
Высокоосновной хромат цинка, по мнению этих авторов, является не самостоятельным химическим соединением, а твердым раствором или смесью твердых растворов переменного состава с отношением
ZnO : Сг03: И20 от 4,7: 1,0:3,7 до 3,4: 1,0: 2,6
Рискни [25—28] установил, что высокоосновные хроматы цинка могут быть получены обработкой окиси цинка не только хромовым ангидридом, но и смесью хромпика и кислоты, например:
4ZnO ■+ 0,5К2Сг2О7 + НС1 — f 2,5НаО —► 4ZnO ■ Сг03 • 3H20 -f КС1
При этом могут быть получены соединения различной основности, но не менее, чем у трехосновного хромата 4Zn0‘Cr03* • ЗН20, так как они разлагаются водою. Как было показано выше, при разложении водою двойного хромата цинка и калия любого состава также получается трехосновной хромат 4ZnO * Сг03 ■ ЗН20.
Трехосновные хроматы, полученные различными методами — обработкой окиси цинка хромовым ангидридом или смесью бихромата и кислоты и разложением двойного хромата цинка и калия,— дают одинаковые рентгенограммы. Эти факты дают основание приписать высокоосновному хромату цинка состав 4ZnO * •СгО — ЗН20.
Двойные соединения основного хромата цинка с хроматом щелочного металла (преимущественно калия) вначале получали взаимодействием водного раствора какой-либо соли цинка с монохроматом калия. Так, например, если к раствору ZnSO* или ZnCI2 добавить К2СЮ4, то при этом образуется не нейтральный хромат цинка, как это можно было предположить,
ZnS04 + К2Сг04 —» ZnCr04 + K2S04
а сложное химическое соединение. Это соединение изучалось рядом исследователей, из которых каждый приписывал ему другой состав. Наиболее правильными являются данные, согласно которым это соединение имеет состав 4ZnO * 4СЮ3 — К20 * ЗН20.
При наличии в растворе избытка К2СЮ4 образующееся соединение способно адсорбировать некоторое количество этой соли.
При длительном нахождении в маточном растворе адсорбированный КаСг04 снова переходит в раствор.
Процесс образования соединения основного хромата цинка с хроматом калия при сливании с раствором ZnS04 или ZnCb с монохроматом калия или натрия, по данным Рискина [25], может быть представлен следующим образом. Цинк под действием хромата калия осаждается из раствора в виде гидрата окиси цинка или основной соли цинка состава 4Zn(OH)2 *ZnS04 (об основных солях цинка см. ниже), а хромат калия переходит в бихромат. Своеобразие этой реакции обусловлено щелочным характером монохромата калия и низким pH (pH = 5,2), при котором происходит осаждение Zn(OH)2:
4ZnS04 + 8K2Cr04 + 4Н20 —> 4Zn (ОН)2 — f 4K2Cr207 + 4K2S04
Гидрат окиси цинка или основная соль цинка реагируют затем с бихроматом с образованием соединения основного хромата цинка с хроматом калия:
4Zn(0H)2 + 4K2Cr207 + 4H20 {или 4Zn (ОН)2 + 4К2Сг04 + 4Н2Сг04{ —>
—> 4ZnO — 4Сг03 • К20 . ЗН20 +■ ЗК2Сг04 + Н2Сг04 + 4НгО
Образование при этих реакциях крона предельного состава 4ZnO *4СгОз * КгО * ЗН20 обусловлено тем, что при этом бихромат всегда имеется в избытке по отношению к гидроокиси или основной соли цинка, что, как будет показано ниже, приводит к получению крона предельного состава.
В производственных условиях, как уже было указано, цинковый крон приготовляют, обрабатывая окись цинка кислотой и бихроматом.
Рецептура, применявшаяся до недавнего времени для производства цинковых кронов, была основана не на стехиометрических расчетах, а на практических данных. Часто пользовались старой рецептурой, по которой 100 вес. ч. цинковых белил обрабатывали сначала 48 вес. ч. серной кислоты, а затем — 100 вес. ч. бихромата. Исследовательские работы последних лет внесли ясность в процесс получения цинковых кронов из белил. Процесс этот состоит из двух стадий: обработки окиси цинка кислотой и взаимодействия образовавшейся основной соли цинка с бихроматом.
Процессы, происходящие при обработке окиси цинка кислотой, могут быть представлены следующим образом [25]: при размешивании с серной или соляной кислотой, взятыми в количестве меньше эквимолекулярного, часть цинка переходит в раствор в виде сульфата или хлорида, а часть остается в осадке. Осадок, независимо от количества взятой кислоты, представляет собою основную соль состава 4Zn(OH)2 • ZnS04 или 4£п(ОН)^пС!2 • Н20 в зависимости от того, какой кислотой была обработана окись цинка. Распределение цинка между осадком и раствором зависит исключительно от количества кислоты, которой обрабатывается
окись цинка: чем больше кислоты взято для обработки окиси цинка, тем больше ее переходит в раствор. Взаимодействие окиси цинка с серной кислотой может быть представлено следующими уравнениями:
5ZnO + H2S04 % 3H20 —► 4Zn (ОН)2 — ZnS04 6ZnO + 2H2S04 4- 2Н20 —► 4Zn (OH)2 • ZnS04 + ZnS04 7ZnO — f 3H2S04 + H20 —* 4Zn (OH)2 ■ ZnS04 % 2ZnS04 и т. д.
В результате первой реакции, в которой окись цинка обрабатывается 24% кислоты, весь цинк остается в виде основной соли в осадке. Во втором уравнении, где количество кислоты возрастает до 30%, в раствор переходит 17% цинка. В третьей реакции в раствор переходит около 30% цинка и т. д. Если количество серной кислоты, взятой для обработки окиси цинка, меньше 24%, то при этом лишь часть цинка переходит в основную соль, остальное же количество окиси цинка остается в неизменном или гидратированном виде.
Таким же образом протекает процесс при обработке окиси цинка соляной кислотой:
5ZnO + 2НС1 + 4Н20 —► 4Zn <ОН)2 ■ ZnCl2 • Н20
Вместо кислоты окись цинка можно обрабатывать растворимыми солями цинка. В этом случае, так же как и при обработке соляной кислотой, образуются основные соли цинка указанного выше состава:
4ZnO ~f ZnCi2 + 5Н20 —> 4Zn (ОН)2 • ZnCi2 ■ НаО
Основные соли цинка не растворяются в воде и почти не разлагаются холодной водой. Горячей же водой, особенно при длительной повторной обработке, они разлагаются на окись цинка и соответствующую среднюю водорастворимую соль ZnS04 или ZnCl2. Основные соли цинка (сульфаты и хлориды) значительно легче вступают в реакцию с бихроматом, чем окись цинка.
Вторая стадия процесса заключается в получении цинкового крона в результате взаимодействия основных солей цинка с бихроматом. По данным Рискина [25, 27], количество добавляемого бихромата может колебаться в довольно широких пределах — от 45 до 180 вес. ч. К2Сг20? на 100 вес. ч. окиси цинка. В соответствии с этим цинковые крона получаются состава от высокоосновного хромата 4ZnO — СЮ3 • ЗН20 до двойного хромата предельного состава 4ZnO-4Сг03 • К20 *ЗН20. Кроме этих двух кронов, можно получить целый ряд цинковых кронов промежуточного состава (см. стр. 357).
Процессы, происходящие при взаимодействии окиси цинка, обработанной кислотой, с бихроматом, весьма сложны.
Водный раствор бихромата можно рассматривать как смесь хромовой кислоты с монохроматом:
К2СггОг + НгО —> КгСг04 + Н20гО4
Количество свободной хромовой кислоты можно увеличить, добавляя к раствору хромпика кислоту:
2К2Сг2Ог + H2S04 4- 2Н20 —> К2Сг04 4 3H2CrO, 4 K2S04
При взаимодействии смеси хромовой кислоты и монохромата калия с окисью цинка образуются цинковые крона, состав которых соответствует указанной выше общей формуле и зависит от соотношения между отдельными ингредиентами смеси {окиси цинка, хромовая кислота, монохромат калия). Для примера ниже приведены реакции образования цинковых кронов различного состава 4ZnO 4- ЗН2СЮ4 4 К2СЮ4 —> 3ZnCr04 • К2Сг04 ■ Zn <ОН)а • 2Н20
[или 4ZnO • 4Сг03 * К20 * 3H2Oj (1)
4ZnO 4- 2,4Н2Сг04 4- 0,8К2СгО4 + 0,6Н2О —>■ 4ZnO • 3,2СгОф • 0,8К2О • ЗН20 {2)
и, наконец:
4ZnO + Н2Сг04 4 2Н20 4ZnO • СгОэ • ЗН20 (3)
Из этих уравнений видно, что между количеством хромовой кислоты и монохромата калия должно существовать определенное отношение в зависимости от состава получаемого крона.
Увеличение количества только одного из реагентов — хромовой кислоты или монохромата калия — существенного влияния на состав получаемых соединений не оказывает.
Точно так же увеличение обоих реагентов выше количества, указанного в реакции [25], не оказывает влияния на состав крона, так как при этом не удается получить крон, содержащий Сг03 и КгО больше, чем в соединении 4ZnO • 4Сг03 • К2О *3140. Суммарно уравнение полученного цинкового крона из окиси цинка, кислоты и хромпика может быть представлено уравнением:
4ZnO 4 — тК2Сг207 4 уНС1 —► цинковый крон различного состава
Особый интерес представляет то обстоятельство, что, изменяя соотношения между реагентами, можно получить трехосновной цинковый крон из бихромата калия
8ZnO 4 К2Сг207 4 2НСІ 4 5Н20 —> 2 [4ZnO — СЮ3 ■ ЗНйО] 4 2КС1
т. е. несмотря на наличие в исходном реагирующем растворе калия, получать цинковый крон, не содержащий калия [25, 27]. Приведенные выше реакции нужно рассматривать как схему.
Калий в цинковом кроне может быть заменен натрием или аммонием. Натриевые цинковые крона удалось приготовить всего лишь недавно, когда Сапгир и Рассудова [35], Бушон и Фокс [36] установили, что их следует получать из сильно концентрированных растворов. Этим способ производства натриевых цинковых кронов
отличается от способа производства калиевых, которые можно получать даже из сильно разведенных растворов.
Образование цинкового крона из бихромата натрия в концентрированной среде, как показало исследование Рискина [25], протекает так же, как и калиевого. При этом, в зависимости от количества бихромата, добавленного к окиси цинка, получаются соединения состава от 4ZnO ■ СгОз * ЗН2О до 4ZnO ■ 4СгОз • Na20 * — ЗН20 {рис. і 18).
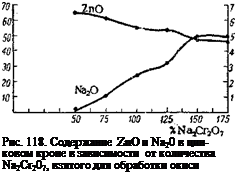 В разбавленных растворах лишь часть бихромата вступает в реакцию, образуя цинковый крон. Остальная часть остается в маточном растворе и теряется при промывке пигмента. Так, например, реакция получения цинкового натриевого крона предельного состава 4ZnO*
В разбавленных растворах лишь часть бихромата вступает в реакцию, образуя цинковый крон. Остальная часть остается в маточном растворе и теряется при промывке пигмента. Так, например, реакция получения цинкового натриевого крона предельного состава 4ZnO*
* 4Сг03-Na20-ЗН20 протекает в концентрированной среде по уравнению
4ZnO-f ЗН2СЮ4 + Ка2СЮ4 .—*
.—► 4ZnO • 4Сг03 • Na20 ■ ЗН20
а в сильно разбавленной среде по уравнению:
4ZnO + ЗН2Сг04 + Na2Cr04 — f + 2Н30 4ZnO • Сг03 • ЗН20 +
+ 2Н2Сг04 +Na2Cr04
Таким образом, в первом случае вся хромовая кислота и хромат натрия реагируют с окисью цинка и образуют крон соответствующего состава, а во втором случае в растворе остается весь монохромат натрия и значительное количество хромовой кислоты. Осадок при этом представляет собою основной хромат цинка состава 4ZnO — СгОз * ЗН2О. При осаждении цинкового крона в условиях средней концентрации раствора образуется крон промежуточного состава.
Если при получении цинкового крона пользоваться смесью би — хроматов натрия и калия, то в состав крона войдет калий, а не натрий, т. е. группа К2О как более активная и образующая менее растворимые соединения; натрий же в виде хлористой соли остается в растворе и удаляется при промывке пигмента. Таким образом, реакция будет протекать по следующему уравнению:
4ZnO + 2НС1 + Na2Cr2Or + К2Сг207 + 2НаО —*
—j. 4ZnO ■ 4Сг03 • К20 ■ ЗН20 + 2NaCl
К таким же результатам приходят, если цинковый крон из бихромата натрия получают в присутствии калиевых солей: КС1, K2SO4 и др. При этом также образуется калиевый цинковый крон,
а натрий остается в маточном растворе в виде сульфатов или хлоридов [26].
По своим свойствам натриевые цинковые крона вполне аналогичны калиевым, за исключением лишь значительно большей растворимости в воде. В особенности это относится к холодной воде (10—20°),, в которой калиевые цинковые крона растворяются незначительно. Так, при размешивании навески калиевого крона с 10-кратным количеством воды (18—20°) в раствор переходит лишь 1,2—1,4% цинкового крона. Натриевые крона в этих условиях растворяются в количестве 9—10%, т. е. их растворимость в 7—8 раз больше.
 26 августа, 2015
26 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 