К химической коррозии относятся, как было указано выше, такие процессы, которые протекают в результате реакции между металлом и органическими химически активными веществами — неэлектролитами или между металлом и газом. Если в сосуд, наполненный парами иода или раствором иода в органическом растворителе, например хлороформе, поместить серебряную или медную пластинку, то поверхность пластинки окрасится, и эта окраска будет постепенно меняться. Поверхность серебряной пластинки в парах иода окрашивается в едва заметный зеленоватый цвет, который постепенно переходит в красно-бурый. Появление окраски на поверхности металла указывает на начало процесса коррозии, на образование тонкой пленки, состоящей из продукта взаимодействия металла и химического реагента. В приведенном примере химическим реагентом является иод, и образующаяся пленка состоит из йодистого серебра. Изменение окраски происходит вследствие увеличения толщины пленки.
Механизм образования пленки можно представить себе следующим о. бразом: молекулы химического реагента (в приведенном примере — иода), адсорбируясь на поверхности металла, распадаются на атомы, которые реагируют с атомами металла, образуя йодистый металл. На поверхности металла возникает мономолекулярная пленка йодистого металла. Если бы эта пленка была совершенно плотной, то атомы иода не могли бы через нее диффундировать к поверхности металла и процесс коррозии на этом и закончился бы. Практически образовавшаяся пленка недостаточно плотна, и атомы иода могут проникать сквозь ее поры и трещины к поверхности металла, в результате чего образуются новые слои молекул йодистого металла.
Наряду с этим атомы металла и реагента могут растворяться в веществе образовавшейся пленки с возникновением твердого раствора. Растворившиеся атомы диффундируют в пленке: атомы металла направляются к поверхности пленки, а атомы реагента (иода) — к поверхности металла {рис. 1). Встречаясь в толще пленки, они соединяются с образованием продуктов коррозий. Область, в которой происходят встреча атомов металла и реагента и их взаимодействие, называется реакционной зоной,
Положение реакционной зоны в толще пленки зависит от скорости диффузии атомов металла и реагента. Если скорость диффузии атомов реагента больше скорости диффузии атомов металла, то встреча их происходит в пленке ближе к поверхности металла, где и находится в этом случае реакционная зона; если же скорость диффузии атомов металла больше скорости диффузии атомов
|
|
реагента, то встреча атомов происходит ближе к поверхности пленки и соответственно ближе к поверхности пленки располагается и реакционная зона. На рис. 2 показана схема окисления металла. Атомы металла двигаются в пленке навстречу атомам кислорода со скоростью, большей, чем скорость движения атомов кислорода, поэтому реакционная зона заметно смещена к поверхности пленки.
Происходящая в реакционной зоне встреча атомов металла с атомами реагента сопровождается образованием продуктов коррозии, вследствие чего толщина коррозионной пленки непрерывно увеличивается. Увеличение толщины коррозионной пленки затрудняет дальнейшую диффузию атомов металла и реагента и поэтому происходит самоторможение процесса коррозии, а при достаточной толщине пленки процесс может и совсем приостановиться.
Особый вид химической коррозии представляет собой газовая коррозия, возникающая в результате действия на металл газов при высокой температуре. Большое распространение и практическое значение имеют процессы газовой коррозии, происходящие вследствие окисления поверхности металла кислородом воздуха.
Процесс газовой коррозии, обусловленный действием кислорода на поверхность металла, представляет собой обратимую реакцию, протекающую по схеме:
2М 02 ± 2МО
Направление этой реакции зависит от парциального давления кислорода и давления диссоциации образовавшегося окисла. Если парциальное давление кислорода больше давления диссоциации окисла, то реакция пойдет слева направо, и процесс коррозии может идти с образованием на поверхности металла слоя окисла. Если же давление диссоциации окисла больше парциального давления кислорода, то реакция идет справа налево, и окисная пленка не только не образуется, но даже уже образовавшаяся разлагается на металл и кислород.
Так как величина давления диссоциации окисла изменяется с температурой, то и направление реакции окисления металла также изменяется с температурой. Для иллюстрации этого положения в табл. 1 приведены величины давления диссоциации окислов некоторых металлов при различных температурах (в атм),
|
ТАБЛИЦА 1
|
Из этой таблицы следует, что при температурах 400° К и выше серебро окисляться не может, так как при 400° давление диссоциации окиси серебра 0,49 агж, т. е. больше парциального давления кислорода в воздухе (0,2 атм). Такое же соотношение наблюдается и у других благородных металлов. Для большинства же металлов величина давления диссоциации при температуре до 1000° К так мала, что реакция окисления металла кислородом воздуха идет слева направо и поверхность металла покрывается пленкой окисла.
Характер образующейся окисной пленки сильно влияет на скорость газовой коррозий. Плотная, сплошная пленка окисла затрудняет дальнейшую диффузию кислорода к поверхности металла и вызывает самоторможение процесса коррозии. В случае образования пленки несплошной или рыхлой процесс коррозии протекает беспрепятственно, с большой скоростью и вызывает серьезное разрушение металла.
Сплошная коррозионная пленка может возникнуть только в том случае, если молекулярный объем пленки, образовавшейся из ме* талла и кислорода, больше, чем атомный объем металла, израсходованного на образование пленки. Если этого условия нет, то сплошная пленка не возникает, так как материала образовавшейся пленки будет недостаточно, чтобы покрыть всю поверхность металла.
Если принять, что W — молекулярный вес окисла, D — плотность окисла, w — атомный вес металла, d — плотность металла, то
— молекулярный объем окисла и ~— атомный объем металла. В случае, если — g — > — j- или g^ >1, пленка может быть сплош-
ной; если же — g- < или g^<l — сплошная пленка образоваться
не может, так как ее не хватает, чтобы покрыть всю прокорроди — ровавшую поверхность металла.
Отношение для некоторых широко применяемых металлов приведено в табл. 2 [9].
|
ТАБЛИЦА 2
|
Из табл. 2 видно, что для металлов К, Na, Са, Ва и Mg отношение g^<l, и поэтому образующаяся на этих металлах окисная пленка не может быть сплошной и не может вызвать серьезного торможения процесса коррозии. Эти металлы корродируют с большой скоростью. Для остальных металлов, приведенных
в табл, 2, отношение lt и поэтому на них может образо
ваться сплошная плотная пленка. Эти металлы корродируют значительно медленнее щелочных и щелочноземельных металлов.
Впервые предположение о существовании защитной окисной пленки на поверхности металла, находящегося на воздухе, было высказано Фарадеем еще в 1836 г. Такое предположение было им выдвинуто для объяснения явления пассивирования железа при действии на него концентрированной азотной кислоты.
Всеобщее признание идеи Фарадея получили только в первой четверти XX в. в результате работ акад. Кистяковского, создавшего фильмовую теорию коррозии металлов. Кистяковский так формулирует основные положения созданной им теории [5]:
«а) В основе фильмовой теории лежит гипотеза, что поверхности металлов в воздухе, содержащем влагу, покрыты пленкой (фильмом). Строение этой пленки различно для различных металлов, начиная от молекулярного абсорбционного слоя и кончая слоем окислов для легко окисляющихся металлов.
б) Коррозия происходит по преимуществу за счет местных (локальных) гальванических токов между участками аморфной пленки или другими загрязнениями на поверхности металла и самим металлом.
в) Ржавление железа начинается в местах, где какие-либо условия нарушили сплошность фильмов окислов. Начальная стадия сводится к образованию очагов ржавления. В дальнейшем распространение ржавления в зависимости от подачи кислорода и двуокиси углерода совершается различными путями. Оно направляется или по преимуществу в толщу металла, что приводит к случаям точечного разъедания металла (pitting-явлениям), или распространяется по поверхности, что отвечает случаям выедания металла и случаям более равномерной коррозии вдоль поверхности.
г) Специфическое действие электролитов при коррозии объясняется не только тем, что они, повышая электропроводность, способствуют усилению локальных токов, но и тем, что они разрушают пленку окислов. Ионы хлора являются особо опасными. По — видимому, вступая в комплексные соединения с окислами железа, они разрушают пленку, увеличивая в ней поры и тем переводя железо в субактивное состояние».
В настоящее время фильмовая теория Кистяковского пользуется всеобщим признанием, а наличие на поверхности металлов защитных окисных пленок доказано экспериментально.
Акимов делит эти пленки по толщине на три группы:
1 Толстые видимые, легко обнаруживаемые пленки; их толщина более 5000 А. *
♦lA « 0,1 m ч = 0,0001 и-
2. Пленки средней толщины. Они обнаруживаются на поверхности металла по цветам побежалости. Толщина этих пленок от
400 до 5000 А.
3. Тонкие невидимые пленки. Их наличие на поверхности металла можно доказать только косвенными методами. Толщина
этих пленок меньше 400 А.
Существование указанных трех групп пленок в настоящее время подтверждается экспериментально.
Толстые пленки могут быть сняты с металла механическими средствами и исследованы обычными методами.
Реальность пленок средней толщины доказывается наличием на поверхности металла цветов побежалости, которые, как известно, появляются в результате интерференции света при прохождении его через тонкие слои среды.
Более убедительно наличие на поверхности металла пленок средней толщины может быть доказано разработанными Эвансом [10] методами изоляции пленок,’т. е. снятием их с поверхности металла. Для изоляции пленки на поверхности образца металла наносят несколько царапин, после чего образец сразу погружают в насыщенный раствор иода в 10% растворе йодистого калия. В таком растворе иода железо растворяется без выделения газообразных продуктов, которые могли бы разрушить пленку, а окисная пленка не растворяется. Через 24 часа раствор иода, проникнув через царапины к поверхности железа, полностью растворяет его. После удаления раствора йодистого железа и промывки не — растворившегося остатка дистиллированной водой на дне стакана можно обнаружить свободную пленку в виде очень тонких, нежных хлопьев. При исследовании этих хлопьев в капле воды под микроскопом видно, что на поверхности пленки отпечатываются все неровности и отдельные царапины поверхности металла.
Другой метод изоляции пленки, предложенный также Эвансом, заключается в анодном растворении железа. Окисная защитная пленка при этом остается в свободном состоянии. Подробно этот метод описан у Эванса [10].
Реальность существования тонких невидимых пленок может быть подтверждена также методом их изоляции. Изолированные тонкие пленки более прозрачны, чем пленки средней толщины. Существование на поверхности металла тонких пленок может быть доказано, кроме того, и другими методами.
 17 августа, 2015
17 августа, 2015  admin
admin 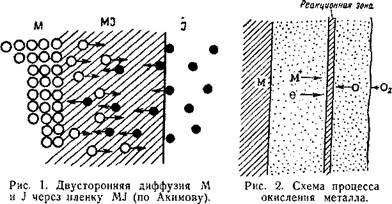
 Опубликовано в рубрике
Опубликовано в рубрике 