Из приведенного обзора интегрального цветного анодирования станет понятным, что оно в большой части было эмпирическим творчеством и очень не достаточно данных появилось в письменной форме за рамками коммерческой и патентной литературы, или технических изданий с сильным коммерческим привкусом. Разработки по нраву были исследовательскими и отмечались территориальными притязаниями, и небесполезно было бы поразмыслить, хотя, может быть, реальная книжка и не полностью подходящее место для этого, о множественных усилиях по всему миру по исследованию практически одних и тех же заморочек, с нахождением тех же решений, отвлекаясь от территориального подхода. Фундаментальные исследования устройств окрашивания были при всем этом еще наименее приятными.
Еще в 1944 году Fischer и Budiloff изучили предпосылки формирования цвета при анодировании щавелевой кислотой, и они заключили, что основной золотой цвет возникал благодаря коллоидному углероду в пленке. Они признавали значимость щавелевокислого аниона в пленке и проявили, что цветные пленки могут выполняться даже с применением сверхчистого алюминия. Kape разглядел весь ряд органических электролитов и получил возможность сконструировать требования, которым должен отвечать фактически приемлемый электролит для интегрального анодирования, также удачно предсказал применимые кислотные консистенции. Tajima, Baba and Muramaki установили, что никакие видимые пленки не формируются в одноосновных кислотах (муравьиной, уксусной либо бензойной), тогда как в двухосновных (малоновая и янтарная) формируется барьерный либо полу-барьерный оксидный слой.
Многие создатели признавали, что в интегральном цветном анодировании задействованы несколько процессов и что необходимыми факторами являлось включение интерметаллических частиц из сплава, который подвергался анодированию, также включение активных в смысле цвета ионов таких металлов, как Cr, Cu либо Mn, которые могут находиться в жестком растворе в дюралевой решетке. Все же, ни один из этих устройств не разъяснял окрашивания, которое происходит со сверхчистым алюминием. Endtinger and Zoller исключили органические углеродные соединения, так как с применением всей имеющейся сейчас наилучшей аналитической техники они не могут быть обнаружены в обычных интегрально окрашенных пленках. Это было доказано Sautter’ом, который, как и Raub et al. установил, что обычные интегрально окрашенные пленки содержали практически столько же сульфата, сколько пленки, приобретенные в серной кислоте (10-15%), и при всем этом никаких признаков присутствия органической кислоты. Таким макаром, номинальный состав интегральных покрытий был сходен с составом обыденных сернокислотных пленок, но только с очень разными цветовыми эффектами.
Edtinger and Sautter считали, что включение тонких частиц алюминия может быть ответственным за формирование цвета и может действовать как мелкодисперсный пигмент, роль углерода (рассмотренная) в работе Fischer’а and Budiloff’а. Равным образом Woodman приписал цвет в пленках, выращенных в щавелевой кислоте, рассеянию света параллельной текстурой пор, но ведь многие другие интегральные пленки имеют подобные параллельные поры и все таки дают совсем другой цвет. Последовало много других исследовательских работ, включая выполненные Tagai et al. по электролитам на базе сульфосалициловой кислоты, Takako and Baba по щавелево- и малонокислотным пленкам, Takahashi et al. по целому ряду пленок, и Shimura по щавелево- и малеиновокислотным покрытиям. Было изготовлено много разных выводов, но работа Takahashi показывает на механизмы, которые сейчас числятся признанными.
Свободный алюминий рождается в барьерном слое и критериями, благоприятствующими его формированию, являются высочайшая скорость окисления при низкой скорости стимулированного полем растворения оксида. Таким макаром, высочайшие плотности тока анодирования, высочайшие напряжения и электролиты слабенького воздействия будут содействовать получению цвета. Не считая того, естественно, включение интерметаллических частиц из анодируемого сплава представляет собой принципиальный фактор в развитии цвета.
Предстоящая работа по выяснению механизма формирования железного алюминия была проделана и описана Wefers’ом и Wallace’м.
«Условия, преобладающие при росте тусклого покрытия, представлены в высшей части рисунка. Температура и концентрация при всем этом довольно высочайшие, чтоб поддерживать высшую степень растворения. Потому барьерный слой остается узким и напряженность поля высочайшей. Значимый градиент концентрации не развивается вследствие резвой взаимодиффузии положительных и отрицательно заряженных ионов через узкий барьерный слой. Более того, отрицательный объёмный заряд на интерфейсе (переходе) жесткое тело/раствор, который представлял бы активационный барьер для инжекции анионов в тело, компенсируется ионами S6+, занимающими большая часть катионных вакансий. Не считая того, протоны, высвобожденные реакцией ионов HSO4- и OH- c Al, повсевременно мигрируют через раздел жесткое вещество/жидкое вещество, содействуя таким макаром компенсации хоть какого лишнего отрицательного заряда. Ионы алюминия, попадающие в электролит, связываются органической кислотой смешанного электролита и отчасти ионами HSO4-. Пока концентрация серной кислоты довольно высока, либо плотность тока сохраняется низкой, скопление ионов алюминия, происходящее вследствие растворения оксида, не будет оказывать существенного воздействия на рН электролита в порах.
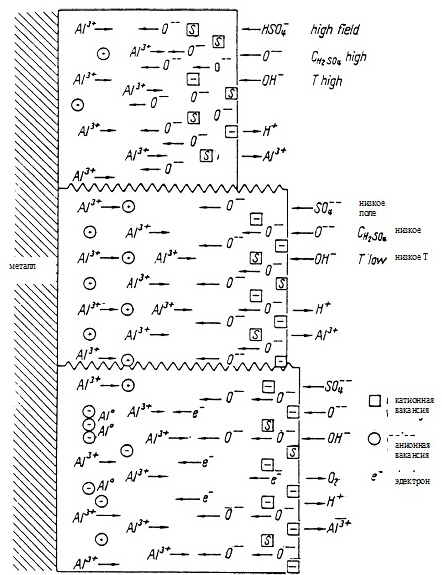
Ситуация изменяется, когда концентрация свободной серной кислоты снижается. Поступательно растущая часть ионов HSO4- будет связываться Al3+. Так как протоны в растворе владеют в 5-10 раз более высочайшей подвижностью, чем ионы сульфата, рН поблизости перехода оксид/электролит увеличивается и ионы SO4 2- становятся преобладающим видом. Возрастание рН имеет несколько последствий: растворение оксида миниатюризируется и толщина барьерного слоя увеличивается. Низкая концентрация имеющегося сульфата буде оставлять много (отрицательных) катионных вакансий незанятыми. Более того, каждый ион SO4 2-, переместившийся в жесткое вещество добавляет два отрицательных заряда заместо 1-го, поставляемого ионом HSO4-. Как следствие, развивается сильный отрицательный пространственный заряд, который, в купе с растущей шириной барьера, понижает напряженность поля и, как следует, степень переноса ионов. Ионы алюминия и анионные вакансии скапливаются поблизости перехода металл/оксид, стимулируя рост положительного пространственного заряда. Предстоящее возрастание поляризации заряда приводит к уровню ионов кислорода на переходе электролит/оксид, который освободит электроны в направлении положительной области. Электроны захватываются анионными вакансиями и междоузельными ионами Al3+. Последние восстанавливаются до железного алюминия.
 30 апреля, 2014
30 апреля, 2014  Pokraskin
Pokraskin  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: 