Необходимость теоретического анализа ДЭС в фосфолипидных дисперсиях на основе нелокальной электростатики возникла в связи с обнаружением в таких системах структурных (гидратных) сил [418—420]. Здесь эти силы будут рассмотрены несколько подробнее.
Интерес к особым свойствам граничных слоев воды имеет давнюю историю [444]. Результаты многочисленных исследований свидетельствуют о том, что свойства этих слоев существенно отличаются от свойств объемной воды [42, 43, 415, 421, 422]. Наиболее простое описание этих различий можно выполнить с помощью представления о «связанной воде» [1, 64, 445]. Для фосфолипидных бислоев это означает, что одна молекула, например, лецитина «связывает» 20 молекул воды, из которых 2—3 связаны «сильно», а остальные представляют собой «промежуточный» тип слабо связанной воды [446]. Очевидно, что в рамках такого упрощенного описания довольно трудно выяснить физико-химическую природу воздействия поверхности на структуру граничных слоев воды или электролита. В работах Б. В. Дерягина [42, 43, 415] сделан переход к более детальному описанию граничных слоев: было высказано предположение о существовании специфического взаимодействия, существенно отличающегося от классических (электростатического и вандер — ваальсового) и возникающего в процессе сближения частиц или поверхностей в зоне перекрытия граничных слоев.
Хотя предположение Б. В. Дерягина о структурных силах было впервые высказано еще в 30-е годы, длительное время возможность их реального существования подвергалась сомнению. Однако в последнее десятилетие проблема структурных сил привлекла внимание широкого круга исследователей. Ведутся экспериментальные исследования этих сил, активно разрабатываются теории структурных сил, проводятся конференции, посвященные этому взаимодействию [447—449].
В биофизике интерес к проблеме структурных сил возник после открытия В. Парседжианом и сотр. [418—420] значитель-
|
С2-ЗНМ) |
|
H,HM |
|
J" |
Электролит
Рис. 9.4. Зависимость силы взаимодействия бислоев липидов (Р) от расстояния (Л) между иими:
Р — в Н/см2
Рис. 9.5. К расчету сил структурного отталкивания бислоев липидов
Ных сил отталкивания, действующих на малых расстояниях (<4 нм) между фосфолипидными бислоями. Эти силы столь велики, что для удержания двух бислоев на расстоянии 0,7 нм нужно приложить внешнее давление в 108 Па. Исследования показали, что эти силы обладают следующими необычными свойствами [418—420].
1. При изменении толщины водной прослойки в интервале 0,5—2,5 нм расклинивающее давление (т. е. удельная сила отталкивания) Р аппроксимируется экспоненциальной зависимостью (рис. 9.4):
Р = р0ехр (—-Л/Ао), (9.30)
Где А0«0,25-5-0,3 нм; Р0=5-104-^5-105 Н/см2.
Разброс данных соответствует различным фосфолипидам. Заметим, что даже для наиболее сильно заряженных липидных бислоев обычное значение электростатического отталкивания на два порядка меньше Ро.
2. Параметры H0 и Ро практически не зависят от величины поверхностного заряда.
3. Повышение концентрации электролита до значений, отвечающих дебаевской длине экранирования нм, слабо влияет на величины Ho и Ро.
Было высказано предположение, что происхождение структурных сил в фосфолипидных дисперсиях связано с работой по удалению молекул воды из области полярных головок [418]. Поэтому в биофизике эти силы получили название «гидратационных».
Для физиков проблема структурных сил привлекательна тем, что эти силы являются, по-видимому, наиболее яркой демонстрацией пространственной дисперсии диэлектрического отклика в водном электролите. Д. Грюен и С. Марчелья [450] впервые показали, что гидратационные силы в фосфолипидных системах могут быть представлены как результат влияния пространственной неоднородности электрических полей на взаимодействие сближающихся фосфолипидных бислоев. В работах [451, 452] непосредственно использовали аппарат нелокальной электростатики для описания природы гидратационных сил. Отметим, что были предложены и другие теории гидратационных сил [453, 454]. Однако подход, основанный на нелокальной электростатике, представляется физически более достоверным, поскольку он позволяет представить эти силы как результат электростатического взаимодействия сближающихся фосфолипидных бислоев. Это, в свою очередь, позволяет независимо исследовать влияние электролита и параметров поверхности на величину гидратационных сил. Опишем кратко развитый нами подход, следуя [438].
Систему двух фосфолипидных бислоев, находящихся в водном электролите, в общем случае можно представить следующим образом (рис. 9.5) В точках 2=0 и z = h находятся границы раздела липид/электролит, в точках z — L и z = h—L находятся плоскости, равномерно покрытые электрическими зарядами с поверхностной плотностью о и электрическими диполями с поверхностной плотностью нормальной составляющей ц. В полупространствах z<0 и z>L находится диэлектрик (электрическое поде в котором отсутствует); в слое 0<2<Л находится водный электролит с дебаевской длиной экранирования у,-1. Распределение электрического потенциала в электролите определяется уравнением:
H
<Р"+-|- [жг-ЮФЧІМІ-Р^Ф^ о
= "^г(СТ_’^_5г)[6(г~і) + B(z~h + L)H (9.31)
Регулярная часть решения (9.31) имеет вид (при L-+ + 0):
Ф (Z) =фю( ехр (— qxz) — ехр [ — </! (А — г) ] }+
+ф2»(ехр (— q&) — ехр[ — q2(h — Г) ]}, (9.32)
4я0і Г сто2 о г» 1 Гда [и—^-^-]; (9.33)
Г о<?12 ТІ 1 Q (h) =YI?2I/«I — Т*?Уа2; % (А) = 1 — ехр (— qth);
?i2=S-2+(P — 1)х2; о-2);
Т,= (?г —а)-‘ + (?і —а) ехр (—qth). (9.35)
При сближении мембран между ними возникает взаимодействие, определяемое свободной энергией F рассматриваемой системы:
(9.36)
Удельная сила этого взаимодействия P(h) или структурная
Составляющая расклинивающего давления тонкой водной прослойки равна
P(H)=—DF/Dh. (9.37)
Выражение (9.36) для системы двух одинаковых мембран можно привести (с точностью до членов, не зависящих от Л) к более простому виду:
F=—IE(L) + O<P(L). (9.38)
Подставляя (9.32) —(9.35) в (9.38), можно получить выражение для свободной энергии системы и структурных сил в явном виде. Выражение для P(h) будет довольно громоздким [438], поэтому здесь мы рассмотрим лишь два предельные случая.
Для нейтральных мембран (о = 0) в чистой воде (и = 0) удельная сила взаимодействия равна
|
P(H). |
|
(9.39) |
8яр.2г1 ехр( — Ft/Gp)
E00ioMl + riexp(-ft/Eo)]2
Где Т1=(Р"’-1) /№’/»+ 1) =3 0,6. При Л>1о это выражение сводится к виду
8jxli2
Лехр( — А/Єо),
|
(9.40) Зависимости |
Что соответствует экспериментально полученной (9.15) структурных сил с параметрами
|
В разбавленном электролите |
H0 = Lo‘, Ро = 8я(х2ті/Єоо^2о.
Для заряженных мембран (<*<)>>х) получим:
8ixjir| / р. 2сг
|
ХА ~2~ |
|
2яа2 |
|
—V 1о) |
|
(9.41) |
|
Sh" |
|
P(H) |
|
Ехр |
То + Р1’2
Заметим, что последний член в (9.41) формально расходится при что связано с рассмотрением мембран как бесконечно толстых. Последнее справедливо, как следует из [455], лишь при х>2(єт/є0Лб). Здесь 6 = 5 нм —толщина мембраны и ет = 2 — ее диэлектрическая проницаемость. Фактически это
У
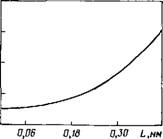
Рис. 9.6. Зависимость параметра f от степе — ни гидратации L
В
Условие накладывает не слишком большие ограничения из-за боль — 4 ШОЙ величины Єо6/Єт«200 нм. При больших H главный вклад в г (9.41) дает второй член, соответст — 1 вующий классической теории Гуи — Чепмена.
Для анализа степени гидратации поверхности (описываемой параметром L) необходимо найти решение, аналогичное (9.32) при произвольном L. В результате, ограничиваясь случаем нейтральной мембраны в чистой воде, получаем для P(h) следующее выражение:
(9.42)
При изменении L от 0 до go параметр ^ меняется от 1 до 3,6 (рис. 9.6) (go = <*-‘),
Таким образом, электростатическое взаимодействие гидрофильных поверхностей на малых расстояниях в водном электролите имеет явно выраженный экспоненциальный характер, причем основной вклад в это взаимодействие вносят поверхностные диполи, а не поверхностные заряды. Легко показать, что ди- польное слагаемое на порядок больше зарядового слагаемого даже для максимально заряженных липидов. Следовательно, такое электростатическое взаимодействие будет значительным и в случае нейтральных гидрофильных поверхностей, так как оно почти не зависит от величины поверхностного заряда. Столь необычный, на первый взгляд, результат является следствием нелокальной поляризуемости среды, благодаря которой поверхностные диполи (в противоположность классической электростатике) создают электрическое поле. Естественно предположить, что именно это взаимодействие измеряется в экспериментах как «гидратационные» силы.
Сравним полученные выражения с экспериментальными данными. Как уже было отмечено выше, точное значение параметра go, определяющего дисперсию диэлектрической проницаемости e(q), в настоящее время неизвестно. Сравнивая (9.40) с экспериментальной зависимостью (9.30), можно оценить |0= = А«0,3 нм.
|
|
Полная величина дипольного момента головки молекулы фосфолипида £? = 30Ч-40 Д [456]. Точная величина нормальной компоненты неизвестна, однако представляется реалистичной
оценка d±7a 10-=-15 Д, что приводит к значению i = d±/So~ ж2-10~3 СГС (so = 0,5-^0,7 нм2 — площадь, приходящаяся в бислое на одну молекулу липида). Тогда оценка предэкспонен- циального фактора Ро в (9.26) дает значения в интервале 105ч-106 Н/см2, что несколько выше экспериментального интервала значений РО. Такое завышение Р0, по-видимому, связано с использованием линейного по электрическому полю приближения. Фактически в непосредственной окрестности мембраны должны заметно проявляться нелинейные эффекты, уменьшающие величину электрического поля и, соответственно, значение РО. Но и с учетом этих эффектов зависимость Р{К) при о сохранит экспоненциальный вид.
Как видим, теоретические оценки вполне согласуются с экспериментальными данными, что подтверждает предположение о природе структурных сил как результате диполь-дипольного электростатического взаимодействия сближающихся бислоев в нелокально поляризующемся электролите.
Предложенная теория позволяет объяснить некоторые необычные свойства структурных сил, в частности, их уменьшение при переходе липидного бислоя из «жидкой» фазы в «твердую» [419], несмотря на то, что при этом возрастает поверхностная плотность диполей. В процессе такого фазового перехода вода вытесняется из области полярных головок, что означает снижение степени гидратации, описываемой параметром L, и, следовательно, фактора входящего в Р0 [см. (9.42)[4]]. Аналогичным образом можно объяснить также снижение гидратационных сил у тех фосфолипидов, у которых площадь на одну молекулу s0 меньше [458].
Описанная теория основывается на диэлектрическом приближении ядра К(г, г’) [см. (9.19)] и простейшей «однополосной» аппроксимации функции диэлектрического отклика (9.15). Возникает вопрос: насколько критичны эти упрощающие допущения для обоснования нелокальной электростатической природы структурных сил? А. А. Корнышев [459] получил для них общее выражение, свободное от каких-либо упрощающих предположений, и показал, что нелокальная электростатическая природа этих сил сохраняется в рамках любого приближения ядра
Kir, Г’). Однако использование других приближений приводит к новым эффектам. В частности, в рамках чисто зеркальной модели [т. е. см. (9.20)] при определенных условиях возможно полное исчезновение гидратационных сил [442]. Для такой модели взаимодействие двух одинаковых мембран в чистой во- де описывается вместо (9.40) следующим выражением [442]:
Р(А) s= [exp(L/|0) ~ ехр( — L/lo) V ехр( — А/|0). (9.43)
Принципиальное отличие (9.43) от (9.40) состоит в наличии множителя, содержащего разность экспонент. Следовательно, для зеркальной модели уменьшение степени гидратации (т. е. параметра L) приводит к более сильному спаду структурных сил, чем в рамках диэлектрического приближения (9.40). При этом в случае дегидратированной поверхности (£ = 0) «гидра — тационные» силы полностью исчезают.
Выражение (9.43) позволяет высказать предположения о возможном механизме преодоления сил структурного отталкивания в биологических системах в процессе слияния мембран. Известно, что слияние мембран происходит лишь в том случае, когда в растворе, омывающем мембраны, в достаточном количестве присутствуют ионы Са2+ [430]. Одна из особенностей взаимодействия этих ионов с фосфолипидными бислоями заключается в том, что ионы Са2+ могут легко связываться с полярными головками фосфолипидных молекул и способны соединять две такие молекулы, образуя между ними «кальциевые Мостики» [430]. Следовательно, адсорбция ионов Са2+ на поверхности бислоя приводит к стабилизации, «цементированию» его структуры. Другая особенность связана с тем, что ионы Са2+, проникая в область полярных головок бислоя, вытесняют оттуда молекулы воды, т. е. дегидратируют поверхности бислоя [460].
Используя эти данные, можно предположить следующую картину преодоления гидратационного барьера. В. отсутствие ионов Са2+ поверхности сближающихся бислоев являются довольно рыхлыми и нелокальная электростатика находящегося между ними электролита соответствует диэлектрическому приближению (9.19). Как следует из (9.26), в этом случае между бислоями действуют значительные силы отталкивания. Добавление в электролит ионов Са2+ приводит к двум эффектам. Во — первых, благодаря образованию «кальциевых мостиков» структура бислоя приобретает жесткость и теперь более адекватной становится модель «зеркального отражения», т. е. взаимодействие бислоев теперь описывается выражением (9.43). Во-вторых, ионы Са2+ дегидратируют поверхности сближающихся бислоев, что, как видно из (9.43), приводит к полному исчезновению «гидратационных» сил[5].
В заключение отметим, что, несмотря на определенные успехи теории структурных сил, ряд вопросов остается открытым. Например, в экспериментах установлено, что радиус спадения h0 структурных сил несколько меняется при переходе от одного фосфолипида к другому [419]. Не совсем ясно, каким образом состояние поверхности может влиять на такой, казалось бы, присущий исключительно водному электролиту параметр, как H0. В этом же ряду стоят вопросы о значительном отличии h0 В случае коллоидных систем, а также о существовании осцилляции структурных сил в коллоидах [462] и об отсутствии таковых в фосфолипидных дисперсиях.
 24 октября, 2012
24 октября, 2012  admin
admin 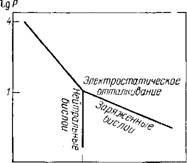
 Опубликовано в рубрике
Опубликовано в рубрике 