Н. И. Гамаюнов, В. М. Кошкин
(Калининский политехнический институт)
Для исследования структуры и диэлектрических свойств сорбированной воды применяются различные физические и физико-химические методы, в частности диэлектрический метод. Сущность его заключается в измерении макроскопических характеристик поляризации диэлектрика во внешнем электрическом поле. В постоянном электрическом поле поляризация диэлектрика характеризуется статической диэлектрической проницаемостью es, в переменном — комплексной диэлектрической проницаемостью є = є’—ie". Установление связи между экспериментально определяемыми характеристиками є5, є’,є" и молекулярными параметрами диэлектрика является основной задачей теории диэлектрической поляризации [639, 640].
При исследовании смесей сорбент — сорбат диэлектрический метод наиболее эффективен при использовании полярных сор- батов, в частности воды. В этом случае метод заключается в основном в получении и анализе диэлектрических изотерм сорбции, выражающих зависимость диэлектрических характеристик от величины сорбции а и частотно-температурных зависимостей е’ и є" [641—645].
Несмотря на широкий круг используемых в различных работах материалов — сорбентов, значительно отличающихся по структуре и физико-химическим свойствам, можно отметить общие, наиболее типичные явления, обнаруживаемые при сорбции воды. Так, диэлектрические изотермы в зависимости от наклона Йг /da, как правило, можно разделить на несколько участков. Каждому соответствует определенный, характерный для данного интервала влажности материала процесс поляризации. Очевидно, что поляризация и диэлектрическая проницаемость
Рис. 15.1. Основные типы диэлект — с’/ рических изотерм сорбции воды.
Пояснения см. в тексте
Системы, их изменение по мере увлажнения материала зависят от механизма связывания воды с поверхностью.
Одной из наиболее распространенных моделей, используемых при объяснении диэлектрических свойств адсорбированной на поверхности воды, является слоистая модель [429, 646]. Согласно этой модели, всю пленку воды условно можно представить в виде трех слоев. Первый слой содержит молекулы воды, непосредственно связанные с поверхностью, третьим, наиболее удаленным, слоем является нормальная вода. Эти слои разделены вторым, промежуточным слоем. В работе [646] дополнительно выделяется слой, соответствующий первоначальной адсорбции молекул, нейтрализующих аномальные поля дефектов. Очевидно, что каждый слой неоднороден по своим диэлектрическим свойствам. В наибольшей мере такая неоднородность проявляется в области малых величин сорбции. Для этой области увлажнения рассмотренная выше трех(или четырех)слойная модель теряет смысл. В этом случае использование слоистой модели предполагает введение еще более «тонких» слоев, содержащих значительно меньше сорбированных молекул. Изменение подвижности и ориентационной поляризации молекул по мере увеличения сорбированных слоев определяет характер диэлектрической изотермы.
|
|
На рис. 15.1 показаны различные виды изотерм (кривые 1—4). Одной из наиболее типичных является S-образная (рис. 15.1, кривая 2) диэлектрическая изотерма, полученная для ряда органических и неорганических сорбентов. Эта изотерма состоит из трех участков А, В, С. Согласно слоистой модели, молекулы первого слоя (участок А) обладают сравнительно малой ориентационной способностью в электрическом поле вследствие их сорбции на наиболее активных центрах. Такими центрами являются функциональные группы, способные образовывать водородные связи, дефекты структуры кристалла, координационно ненасыщенные атомы [647]. Молекулы второго слоя более подвижны и дают больший вклад в ориентационную поляризацию сорбата, что выражается в более высоких значениях dz‘/da (участок В). Однако при достаточно больших величинах сорбции с развитием сетки водородных связей происходит «цементация» сорбата, его структура становится более жесткой,
что затрудняет ориентацию диполей в электрическом поле. В результате наклон d&’/da уменьшается (участок С). Интервалы сорбции, соответствующие участкам А и В, зависят от структуры и свойств сорбента. Например, при сорбции воды на a-Fe203 участку А соответствует образование первого физически адсорбированного монослоя, участку В — второго, участку С — третьего слоя [648]. В общем случае, однако, интервал влажности каждого участка не обязательно должен быть кратен величине мономолекулярной сорбции.
Слоистая модель сорбции имеет ограниченное применение. Она, по-видимому, приемлема для некоторых ненабухающих минералов. Для многих сорбентов сорбцию следует рассматривать как процесс растворения одного вещества в другом [84, 649]. Использование в этом случае сорбционных данных, рассчитанных, как правило, по методу БЭТ, представляет интерес с целью учета различных сорбционных свойств материалов при сравнении и анализе полученных для них диэлектрических изотерм. Наблюдаемое для таких материалов [648, 650—656] совпадение величины моносорбции, определенной по БЭТ, с величиной критической гидратации ао (см. рис. 15.1), по-видимому, не следует интерпретировать с помощью слоистой модели. Это совпадение свидетельствует лишь о том, что с изменением характера сорбции изменяются и диэлектрические свойства системы сорбент — сорбат. Предполагается, однако, что при а<а0 Сорбция происходит непосредственно на активных центрах сорбента, а при а>а0 — на ранее сорбированных молекулах воды [651, 652, 655].
В работе [657] изменение наклона D&’/da на участках А и В Объясняют на основании гипотезы о бидисперсной структуре пор. В соответствии с этой гипотезой, изотерма 3 (см. рис. 15.1) делится на три участка. На первом участке сорбции происходит заполнение пор первого вида, а на третьем — пор второго вида. На втором, промежуточном участке происходит заполнение пор обоих видов. Такой механизм сорбции возможен, но следует признать маловероятным применимость предложенной гипотезы к более широкому кругу сорбентов, так как необходимо учитывать распределение и вид активных центров внутри пор и характер взаимодействия молекул с ними.
Далеко не все диэлектрические изотермы, полученные для исследуемых сорбентов, имеют S-образную форму. В некоторых случаях наблюдается отсутствие участка А или С. Интерпретация таких изотерм аналогична рассмотренному выше объяснению соответствующих участков S-образной изотермы. Причинами отсутствия этих участков могут быть не только определенные сорбционные свойства исследуемых материалов, но и сложности эксперимента, возникающие при измерениях в области малых или, наоборот, высоких влагосодержаний материалов. В последнем случае сложности в определении диэлектрических характеристик связаны с ростом электропроводности сорбента при его увлажнении. Необходимо иметь в виду, что при больших влаго — содержаниях материала уменьшение йг’/da связано с увеличением объемной доли свободной воды. С точки зрения трехслойной модели поляризация всей пленки определяется практически поляризацией третьего слоя, и дальнейшее увеличение толщины пленки практически не влияет на ее диэлектрическую проницаемость [658].
Важную роль при снятии диэлектрических изотерм играет точность диэлектрических измерений. Так, повышение точности измерения приращения электроемкости конденсатора АС по мере увлажнения находящегося в нем образца позволило провести более детальный, чем это делалось ранее, анализ диэлектрических изотерм сорбции воды на белках [659]. Полученные зависимости АС(а) имеют вид ломаных линий (рис. 15.1, кривая 4), причем первая точка излома находится в области заполнения активных центров сорбента молекулами воды. Основываясь на данных ЯМР, можно предположить, что первому участку диэлектрической изотермы соответствует сорбция молекул на двух активных центрах с помощью двух водородных связей, второму, с большим наклоном А С/а, — сорбция молекул с помощью одной Н-связи и третьему участку, с еще большим значением А С/а, — сорбция молекул воды на ранее сорбированных молекулах.
По данным работы [655], диэлектрическая изотерма сорбции воды на торфе также является ломаной линией. На основе калориметрических сорбционных опытов было высказано предположение, что первым двум участкам изотермы отвечает различная энергия связи молекул с центрами сорбции, а третьему, с наибольшей производной de‘/da, — образование в процессе сорбции водородных связей между сорбированными молекулами. Существенно, что при критической величине сорбции а0 Обнаруживается резкое увеличение коэффициента диэлектрических потерь г", обусловленное, по-видимому, значительным возрастанием электропроводности материала вследствие образования цепочек из сорбированных молекул и функциональных групп сорбента — карбоксильных (СООН), гидроксильных (ОН) и других полярных групп. При этом предполагалась возможность эстафетного механизма переноса протона вдоль цепочек, что обусловливает значительное возрастание є’ и &". Наличие протонной проводимости и протонной поляризации позволяет объяснить не только большие величины de‘/da, но и частотную зависимость критической гидратации а0, обнаруженную для ряда сорбентов [646, 648]. Здесь необходимо отметить, что при измерении диэлектрических характеристик применяются слабые электрические поля, которые не могут повлиять на процесс сорбции воды на гидрофильных материалах. Поэтому частотная зависимость величины а0 свидетельствует о различных механизмах процесса поляризации в электрических полях разной частоты.
Основываясь на современных исследованиях Н-связи, можно сделать предположение, что процесс поляризации существенно зависит от перемещения и положения протона Н-мостика в электрическом поле. Так, в работах [206, 660] при рассмотрении влияния среды на структурную форму комплекса с водородной связью (КВС) отмечается зависимость этой формы от диэлектрической проницаемости среды. При исследовании водородной связи О—H—N обнаружено, что с повышением диэлектрической проницаемости раствора происходит переход КВС из молекулярной формы в ионную с последующей диссоциацией комплекса при более высоких значениях г’ раствора [660, 661]. Существенно, что перенос протона вдоль Н-связи в КВС, как установлено в работе [662], вызывается реорганизацией среды. Хотя влияние среды на связь О—Н—0 мало изучено, высокая подвижность протонов в структуре льда все же дает основание предполагать, что в образуемых при определенных величинах сорбции КВС возможна миграция протона Н-связи.
На рис. 15.2 приведены потенциальные кривые протона Н — мостика при отсутствии (сплошные кривые) и наличии (пунктирные кривые) электрического поля в направлении координаты г. Перенос протона может иметь место при наличии как двух, так и одного потенциального минимума для протона. В первом случае реорганизация среды может вызвать изменение глубины и сдвиг обоих минимумов, во втором — единственного минимума. В обоих случаях образование ионной пары с более высоким дипольным моментом определяется скоростью реорганизации среды. По этой причине, как отмечал Н. Д. Соколов [206], едва ли правомерно предположение о туннельном переносе протона между двумя ямами, как это нередко постулируется для таких систем.
Механизм реорганизации диэлектрической среды, обусловливающей перенос протона в КВС, в настоящее время во многом не выяснен. Можно предположить, что важную роль в переносе протона играет реактивное поле, возникающее вследствие поляризации диполем окружающей его среды. В свою очередь, реактивное поле воздействует на диполь, благодаря которому оно возникло [639].
Энергия реактивного взаимодействия одного моля полярных молекул жидкости с окружающей изотропной средой удовлетворяет уравнению [663]:
4 (8,-1) (800+2) р», ER—T*NA—————- ^^————————— — . (15.1)
Где ЛГд — число Авогадро; — дипольный момент молекулы в вакууме; vм — объем, занимаемый одной молекулой в изотропной среде; — высокочастотный предел 8′.
Роль реактивного поля не всегда учитывается, хотя, как показано М. И. Шахпароновым, его вклад в энергию межмолекулярного взаимодействия может быть значительным. Так, для воды соотношение (15.1) дает ER =—18 кДж/моль, что составляет около 40% всей потенциальной энергии межмолекулярного взаимодействия в воде [664]. Существенно, что ER зависит не только от статической диэлектрической проницаемости Es, принимающей большие значения для полярных жидкостей, но и от Єоо. Поэтому вклад реактивного поля в энергию межмолекулярного взаимодействия может быть значительным и для слабополярных жидкостей.
В системе сорбент — сорбированная вода реактивное поле по мере увлажнения сорбента растет, что обусловливает увеличение дипольного момента комплекса даже в том случае, когда дополнительно сорбированные молекулы непосредственно не взаимодействуют с комплексом. При этом изменение г’ может происходить не только за счет роста Es, но и за счет увеличения Єоо. В наибольшей мере это должно проявиться тогда, когда приращения Де5 и Дєоо в результате увлажнения материала отличаются незначительно. В этом случае увеличение г’ системы обусловлено протонной поляризацией в большей степени, чем ориентационной. Можно предположить, что при включении слабого электрического поля при измерении диэлектрических характеристик системы сорбент — сорбат происходит ориентация диполей, которая способствует переносу протона вдоль Н-связи. Последнее вызывает переход КВС из молекулярной в ионную форму. Вероятность такого перехода в системе сорбент — сорбат зависит от диэлектрической проницаемости среды, окружающей КВС; она резко увеличивается при определенной для данной системы критической величине а0.
В свою очередь, диэлектрическая проницаемость є’ системы возрастает с уменьшением частоты электрического поля и ростом влажности материала. Поэтому на диэлектрических изотермах сорбции, снятых при высоких частотах электрического поля, критическая величина а0 достигается при более высоких влаго — содержаниях материала по сравнению с изотермами, снятыми на малых частотах. Минимальное значение а0 соответствует измерениям в постоянном электрическом поле. Как отмечается в работе [646], этому значению а0, согласно слоистой модели сорбции, отвечает завершение заполнения монослоя.
Необходимо отметить, что увеличение протонной поляризации за счет роста в процессе сорбции длины цепочек из сорбированных молекул и функциональных групп сорбента может иметь место в том случае, если образование таких цепочек повышает вероятность или расстояние перескока протона Н-мостика при включении электрического поля. При этом у сорбентов с частотной зависимостью а0 особую роль в переносе протонов играют окружающие КВС молекулы и полярные функциональные группы. Ориентация их дипольных моментов, изменение положения отдельных ионов может существенно влиять на характеристики водородной связи и динамику движения протона Н-мостика [665].
Таким образом, анализ диэлектрических изотерм сорбции воды на гидрофильных материалах в области малых величин сорбции показывает, что наблюдаемые для различных материалов зависимости є’ = /(а) могут быть объяснены с помощью двух основных видов поляризации: ориентационной, обусловленной ориентацией сорбированных молекул и полярных групп сорбата, и протонной, связанной с изменением положения протона Н-мостика. При этом характер зависимости E‘ = F(A) определяется изменением подвижности сорбированных молекул и протонов в процессе сорбции.
Следует, однако, отметить, что интерпретация диэлектрических изотерм носит в настоящее время качественный характер, и прямых доказательств существования или преобладания определенных видов поляризации диэлектрический метод не дает. В связи с этим встает вопрос об учете поляризации, обусловленной отщеплением (диссоциацией) ионов от функциональных групп или с поверхности кристаллической решетки по мере поглощения полярных групп молекул и их перемещением в ассо — циатах или пленках сорбированной жидкости под действием электрического поля. Скопление ионов на границе раздела различных фаз или компонентов смеси при включении электрического поля приводит к поляризации Максвелла — Вагнера [666, 667], которая уменьшается с ростом частоты электрического поля. Поэтому при измерениях диэлектрических характеристик на высоких частотах роль этого эффекта незначительна. Другим способом снижения максвелл-вагнеровской поляризации является проведение опытов при низких температурах [668].
В настоящее время трудно определить влажность материала, начиная с которой величина этой поляризации соизмерима с другими видами поляризации. Проведенные в работе [669] исследования процессов релаксационной поляризации увлажненных кристаллов, отличающихся высокой растворимостью, дают основание полагать, что роль растворенных ионов в поляризации смеси сорбент — сорбат в области малых величин сорбции незначительна. Несмотря на сравнительно большую величину є’, в работе [648] высказано предположение об отсутствии ионной поляризации, если образуется не менее трех слоев адсорбата.
Исследования «нерастворяющего объема» [1, 670] свидетельствуют о возрастании роли ионов в поляризации смеси сорбент — сорбат при больших влагосодержаниях материала. Однако эти исследования не позволяют пока судить об ионной поляризации материала при малых влагосодержаниях.
В работе [84] рассмотрено влияние количества поглощенных торфом катионов (G) на его диэлектрическую проницаемость. Обнаружено, что величина г’ увлажненного торфа (№=20%) при первоначальных добавках А1 и Na практически не меняется, а при поглощении ионов Са уменьшается. Такое уменьшение, по-видимому, связано с понижением подвижности сорбированных молекул из-за структурных изменений сорбента. Полученные при сравнительно невысоких частотах (600 кГц) результаты дают основание считать, что миграция ионов в электрическом поле не существенна при количестве поглощенных торфом катионов в пределах 0,2 мг/экв на 1 г сухого вещества. В дальнейшем, с увеличением G, наблюдается «волнообразное» изменение г’, что является результатом противодействия двух факторов: роста подвижности ионов и их роли как пептизаторов или коагуляторов. Важным вопросом исследования диэлектрических свойств системы сорбент — сорбированная вода является, как отмечалось выше, установление связи между экспериментально определяемыми макроскопическими характеристиками єs, Г’, г" и молекулярными параметрами сорбента и сорбата. Основой для установления этой связи может служить теория Онзагера — Кирквуда — Фрелиха (ОКФ), в соответствии с которой смесь сорбент — сорбат можно представить как систему различных ячеек сорбента и сорбата. Для такой системы, основываясь на общих теоремах Фрелиха Г6391, получено соотношение [671]:
(es — I) (2es+ 1) 4Л (Хч — Чг, — ^
—в —=¥ ■ <15-2>
S /=і /=і J
Где 8S — статическая диэлектрическая проницаемость смеси; N,-, Nf — соответственно концентрации молекул сорбата и ячеек сорбента j—Го типа;
Р.; — дипольный момент молекулы сорбата /-го типа, находящейся в определенной конфигурации; р— дипольный момент ячейки сорбата /-го типа,
Находящейся в определенной конфигурации; М — средний дипольный момент сферы, содержащей все типы ячеек сорбента и сорбата, при нахождении сорбированной молекулы /-го типа в определенной конфигурации;
Мр — средний дипольный момент сферы при нахождении ячейки сорбента /-го типа в определенной конфигурации.
Расчет величины <ц, МУ включает рассмотрение различных конфигураций /-й молекулы, т. е. различных возможных смещений ее зарядов, и определение для каждой конфигурации
Дипольного момента М. Расчет Мр выполняется для различных конфигураций /-й ячейки сорбента.
Точное определение величины es системы сорбент — сорбат с помощью соотношения (15.2) затруднительно, поскольку неизвестна конкретная структура исследуемого вещества и характер взаимодействия между его частицами. Поэтому соотношение (15.2) следует рассматривать как исходное для получения различных приближенных формул с определенными границами применения. В частности, если изменение поляризации сорбента в процессе сорбции незначительно по сравнению с величиной поляризации сорбата, то можно положить, что
(esl— 1) (2esl+ 1) 4я +
51 /=і где 8si — статическая диэлектрическая проницаемость сухого сорбента.
С учетом (15.2) имеем:
(8S-1) (2б5+1) = (esl-l) (2ea+l) e+^V^fr, (,5.4)
8S BS1 R1 ^
Где Q=N‘/N0‘, No‘ — концентрация ячеек сорбента при отсутствии сорбата. Для ненабухающих материалов 0=1.
По методике, описанной Г. Фрелихом [639], можно выделить вклад, обусловленный теми смещениями электронов относительно ядер, собственные частоты которых лежат в оптическом диапазоне. В этом случае имеем:
(Es — (2Es + »2) _ (Esl — N) (2Esl + ЯМ
8s 8s1
4л У
/=і
Где га, га, — показатели преломления смеси и сорбента, соответственно. 250
Входящие в формулу (15.5), в отличие от (15.2), дипольные
Моменты цг и М не учитывают колебания электронов оптического диапазона. Собственные частоты колебаний ядер находятся в инфракрасной области. Поскольку при смещении ядер
Изменяется взаимодействие электронов с ядрами, величины р,/
И М, строго говоря, содержат также члены, обусловленные электронным смещением. Учитывая соответствующий этим смещениям вклад, получим:
(Є5 — Єоо) (2F—S -Ь Єоо) ^ (6S1 — Єоо) (2Esl + Єоох)
Єя Єсі
4я V
KT
І=І
Величины р,/ и М в этом соотношении обусловлены ориентацией диполей. В том случае, когда смещение протонов происходит под влиянием окружающих КВС частиц (молекул и
Дипольных групп сорбента), дипольные моменты jut/ и М содержат также члены, описывающие протонную поляризацию.
Формула (15.6) более удобна для практического использования при диэлектрических исследованиях, так как значения Єоо и Єооі можно определить экспериментально с помощью диэлектрических характеристик є’ и є" [672].
Для определения величины <р,/Л1>, входящей в уравнение (15.4), необходимо проделать следующие операции: 1) для фиксированного смещения зарядов (кроме электронов) молекулы воды, определяющих ее дипольный момент р,/, найти среднее значение дипольного момента всей среды; 2) учитывая различные возможные смещения зарядов сорбированной моле-
Кулы, рассчитать среднюю величину <р,/Л1>. Ввиду сложности подобных расчетов в теории диэлектриков используется приближенный метод Кирквуда. Согласно этому методу, учитывается только короткодействующее взаимодействие между ближайшими соседними молекулами, и дипольный момент М определяется как векторная сумма дипольного момента моле-
Кулы ц и среднего значения суммы моментов ближайших соседей для фиксированного р,. Для жидкости с учетом эквивалентности всех молекул и направлений их дипольных моментов теория Кирквуда позволяет получить следующее выражение:
<|Ш>=ц2(1+г<со8/>), (15.7)
Где z — число ближайших соседей данной молекулы, <cos /> — среднее зиа-
чеиие косинуса угла между направлениями диполей двух соседних молекул.
Недостатком метода Кирквуда, отмеченным Я. И. Френкелем, является то обстоятельство, что нельзя совместить представление о вращении молекулы с ее жесткой связью с соседями. Поэтому при рассмотрении ориентации диполей в электрическом поле необходимо учитывать их заторможенность. Очевидно, что эта заторможенность существенно влияет на поляризацию сорбированных молекул, взаимодействующих с молекулами твердого сорбента, подвижность которых значительно меньше подвижности окружающих диполь молекул жидкости.
|
(15.8) |
|
Где гпц — эффективный дипольный момент ближайшей к молекуле /-й частицы (молекулы сорбата или дипольной группы сорбента); fa — угол Между [х/ и т, г, г — число ближайших частиц, образовавших Н-связь с данной молекулой воды. (Наличие более слабого ван-дер-ваальсова взаимодействия молекулы с другими соседними частицами учитывается, как отмечалось выше, тем, что вводится угол заторможенности р.) |
|
(15.9) |
При отсутствии взаимодействия между сорбированными молекулами среди окружающих молекулу частиц можно выделить функциональную группу сорбента, с которой она образует Н — связь. Это взаимодействие определяет положение молекулы в структуре сорбента. Взаимодействие молекулы с другими близлежащими частицами сорбента, наряду с Н-связью, определяет ориентационную свободу или заторможенность сорбированной молекулы. Эту заторможенность можно учесть на основе модели J1. Н. Курбатова [641], согласно которой дипольный момент сорбированной молекулы может ориентироваться в пределах некоторого телесного угла. При отсутствии внешнего электрического поля все направления внутри этого угла равновероятны. Очевидно, что такая модель упрощает реальное взаимодействие и движение молекул, однако она позволяет оценить ориентационную поляризацию молекул с учетом их заторможенности. Вклад таких молекул в поляризацию системы равен вкладу свободных, незаторможенных молекул, эффективный дипольный момент которых определяется соотношением
Цэф=Цо[1 — cos4(P/2)],
Где [Хо — дипольный момент молекулы, находящейся в системе сорбент —
Сорбат; р — максимальный угол отклонения [х0 от оси конуса, образованного телесным углом.
Рассматривая молекулы сорбата как свободные с дипольним моментом ц/ = цэф, в приближении Кирквуда получим:
При расчетах по формуле (15.9) необходимо учитывать связь дипольного момента ц» молекулы, находящейся в вакууме, с дипольным моментом цо молекулы, находящейся в среде с оптическим показателем преломления п [639]:
П* + 2 1*о = —— Н’О-
При вычислениях Јs для различных величин сорбции необходимо учитывать изменение поляризации ранее сорбированных молекул.
|
(15.10) |
Соотношение (15.9) получено для ориентационной поляризации сорбата. Учет протонной поляризации, обусловленной переносом протона Н-мостика, является более сложной задачей. Ее решение выходит за рамки вопросов, решаемых теорией ОКФ. Если, однако, предположить, что перенос протона Н-мостика происходит в результате ориентации окружающих частиц, то соответствующее этому моменту увеличение дипольного момента молекулы на основе классической статистики дает [673]:
|
Где q — заряд протона; I — расстояние переноса протона; AU — разница между энергиями U2 и Uі, соответствующими молекулярной и ионной формам; Е — напряженность электрического поля. |
|
(15.11) |
Хотя оценить величины AU и I, зависящие от взаимодействия КВС с окружающими частицами, в настоящее время не представляется возможным, полученные соотношения полезны при анализе диэлектрических изотерм сорбции, так как они связывают экспериментально определяемые диэлектрические характеристики с молекулярными параметрами р,, fl, f, AU, I, г. Сравнительно большое количество параметров затрудняет их оценку с помощью соотношений (15.6) — (15.11). Поэтому при применении этих соотношений необходимо делать определенные допущения и выбирать разумные интервалы изменений рассматриваемых параметров. Такая попытка предпринята & работе [674] для оценки протонной поляризации молекул воды, моносорбированных на а-Рег03.
Важным вопросом исследования диэлектрических свойств, системы сорбент—сорбат является изучение частотно-температурных зависимостей ее диэлектрических характеристик. Подробное рассмотрение этого вопроса выходит за рамки данного раздела. Отметим лишь, что одной из актуальных задач этих исследований является расшифровка диэлектрических спектров, рассматриваемых в плоскости є’ и г". Получаемые при этом диаграммы описываются различными эмпирическими соотношениями, подробно рассмотренными в работах [672, 675].
Необходимо отметить, что при интерпретации диэлектрических данных и проведении различных расчетов нужна дополнительная информация о системе сорбент — сорбированная вода, получаемая с помощью других физико-химических методов (ЯМР, ИК-спектроскопия и т. д.). Это может существенно повысить эффективность исследования диэлектрических свойств увлажненных материалов. В то же время высокая чувствительность диэлектрического метода дает возможность более детально исследовать сорбцию воды на различных материалах. Дальнейшее развитие диэлектрического метода зависит от установления более тесной и определенной его связи с другими физико-химическими методами, а также решения таких актуальных вопросов теории диэлектриков, как расшифровка диэлектрических спектров, расчет различных видов поляризации и диэлектрических характеристик системы сорбент — сорбированная вода.
 24 октября, 2012
24 октября, 2012  admin
admin 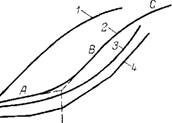
 Опубликовано в рубрике
Опубликовано в рубрике 