Принято считать, что типичные лиофобные системы агрегативно устойчивы благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в систему сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита Сб, после увеличения которой скорость коагуляции остается постоянной (когда фактор устойчивости W= 1, или потенциальный барьер Д£ = 0).
Зависимость скорости коагуляции от концентрации электролита показана на рис. VI. 18. Из этого f рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
|
|
|
Коагу- |
|
Рис. VI.18. Зависимость скорости ляции от коицеитрации электролита |
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного слоя сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита. Сжатие двойного электрического слоя происходит как за счет уменьшения электрического потенциала в результате специфической адсорбции ионов введенного электролита на поверхности частиц, так и из-за ограничения диффузии противоионов в раствор в связи с увеличением ионной силы раствора. По преобладанию того или иного механизма процесса коагуляции различают нейтрализационную и концентрационную коагуляцию. Области преимущественного действия механизмов коагуляции можно оценить с помощью теории ДЛФО.
По теории ДЛФО при концентрации электролита, равной порогу быстрой коагуляции, потенциальная кривая дисперсной системы находится в области отрицательных значений координат, только ее максимум, отвечающий нулевому потенциальному барьеру, лежит на оси абсцисс (см. рис. VI.17, пунктирная кривая 4). Точке касания потенциальной кривой оси абсцисс соответствуют два условия: равенства нулю суммарной энергии взаимодействия частиц н ее производной по расстоянию между частицами:
И = 0 и dU/dk — 0
Необходимо отметить, что эти условия отвечают некоторому критическому потенциалу двойного электрического слоя, а не изоэлектрической точке, как считали раньше. Для многих золей критический потенциал, остающийся на частицах к моменту коагуляции, находится в пределах 25—40 мВ.
Порогу быстрой коагуляции отвечает следующее соотношение между энергиями отталкивания и притяжения частиц в области малых потенциалов (VI.109):
—XKDhKn А*
Где /і„р и хкр отвечают критическим значениям при условии 11= 0 и DU/Dh—0.
Производная по H равна
—к h 2 А*
2е0єхкр<рV ‘Ф КР(-*кр) е= — 12lt/l3Kp (VI. 113)
Разделив (VI.112) на (VI. 113), получим:
/ікр = 2/хкр (VI.114)
Принимая во внимание, что коагуляция происходит в результате уменьшения потенциала (нейтралнзационная) и сжатия диффузной части двойного электрического слоя (концентрационная), можно считать, что при введении электролита изменяются только потенциал диффузного слоя ф8 и величина, обратная толщине его хКр. Подставляя соотношение (VI.114) в (VI.112), найдем:
Ф2о/Хкр—В—const
Илн в общем виде
Ф2о/Хкр S3 (VI. 115)
Таким образом, при малых потенциалах порог быстрой коагуляции отвечает определенному соотношению между потенциалом н толщиной диффузной части двойного электрического слоя. Значения константы В, характерного для данной системы, можно достигнуть, изменяя тот или другой параметр двойного слоя с помощью электролитов. Если указанное соотношение больше коистанты В, то система агрегативно устойчива, если меньше — происходит коагуляция. Условие устойчивости и коагуляции (VI. 115) было эмпирически установлено Эйлерсом и Корфом в 1940 г., а затем теоретически обосновано Б. В. Де — рягиным.
Чтобы получить зависимость порога быстрой коагуляции Сб от заряда противоиона Z в области малых потенциалов, подставим выражение для ккр (11.119) в соотношение (VI.115). Так как
К кр = FWce/leoeRT)
То после некоторых преобразований получим:
Е0еДГф*б „ Ф46 /Vi Iifi
С б =- ВГрггг ‘ — К (VI. 116)
В области больших потенциалов энергия взаимодействия между частицами практически ие зависит от значения потенциала фе (VI.110). Поэтому соотношение, полученное путем преобразований, подобных выполненным выше, показывает, что условие устойчивости и коагуляции определяется толщиной диффузной части слоя и критической концентрацией электролита (порогом быстрой коагуляции) :
Сб/>с3кр=Const (VI.117)
Подставляя в соотношение (VI.117) значение величины
Х (11.119), получим зависимость порога коагуляции от заряда противоиона г:
C6Z6 = COnst ИЛИ C6 = COnst/Ze (VI.118)
Сопоставляя соотношения (VI.116) и (VI.118), можно сделать вывод, что в соответствии с теорией ДЛФО нейтрализа — ционная коагуляция более характерна для систем с частицами, обладающими малым электрическим потенциалом. Особенно сказывается на коагуляции в таких системах специфическая адсорбция ионов добавляемого электролита, имеющих заряд, одинаковый по знаку с зарядом противоионов двойного электрического слоя. Эти ионы, находясь в адсорбционном слое, резко снижают потенциал фв (VI.116) —происходит нейтрализация фо-потенциала уже в адсорбционном слое. Так как при специфической адсорбции ионов возможна перезарядка поверхности частиц, то для нейтрализационной коагуляции характерна область агрегативной неустойчивости между минимальной и максимальной концентрацией электролита. При введении электролита в количестве, превышающем некоторое максимальное значение, дисперсная система может перейти во вторую область устойчивости, в которой частицы будут иметь заряд, противоположный заряду частиц в первой области устойчивости.
Специфичность адсорбции повышается с увеличением заряда адсорбируемого иона, поэтому вклад нейтрализационпой коагуляции растет при переходе к электролитам с многовалентными ионами. Действие специфической адсорбции на устойчивость и коагуляцию дисперсных систем можно представить как образование на поверхности частиц менее растворимого илй менее диссоциированного соединения. В результате" этого уменьшается взаимодействие частиц со средой и как следствие—увеличивается поверхностное натяжение, что приводит к потере агрегативной устойчивости дисперсной системы. . Как было указано выше, концентрационная коагуляция обусловлена сжатием двойного электрического слоя в результате увеличения ионной силы раствора. Этот вид коагуляции осуществляется при добавлении индифферентных электролитов, не способных к специфической адсорбции на поверхности коагулирующих частиц. Хотя при концентрационной коагуляции увеличивается количество противоионов в адсорбционном слое, однако эффект снижения потенциала в нем не является решающим. Преобладающее влияние ионной силы дисперсионной среды характерно для систем с высокозаряженными частицами.
Из соотношений (VI.116) и (VI.118) следует, что коагулирующее действие электролитов сильно зависит от заряда противоионов, и тем сильнее, чем больше потенциал поверхности частиц. Этот вывод полностью совпадает с многочисленными экспериментальными данными, и количественные соотношения удовлетворительно подтверждают эмпирически установленные правила. При малых потенциалах на поверхности частиц порог коагуляции обратно пропорционален квадрату заряда противо — иона, вместе с тем он зависит и от потенциала. Это находится в соответствии с указанным выше эмпирическим соотношением Эйлерса и Корфа. При высоких потенциалах порог быстрой ‘коагуляции по теории ДЛФО не зависит от потенциала и обратно пропорционален заряду противоиона в шестой степени [см. уравнение (VI.118)], что хорошо обосновывает известное эмпирическое правило Шульце — Гарди. Значения порогов коагуляции, вызываемой электролитами с зарядами противоионов 1, 2 и 3, в соответствии с уравнением (VI.118) относятся как 1 : С/а’6: : <7з>в=1 : 1/64: 1/729
По правилу Шульце—Гарди значения порогов коагуляции для тех же противоионов находятся в соотношении
1 : 1/20: 1/500
Несколько меньшая экспериментальная зависимость порога коагуляции от заряда иона, чем z6, объясняется, по-видимому, увеличением роли специфической адсорбции с ростом заряда ионов. Таким образом, даже упрощенные варианты теории ДЛФО позволяют приближенно, но качественно правильно описать основные экспериментальные закономерности коагуляции электролитами.
Приближенность соотношений теории ДЛФО заключается еще в том, что в них не учтена природа противоионов с одинаковым зарядом. Например, пороги коагуляции уменьшаются в ряду противоионов — катионов Li+>Na+>K+>Rb+>Cs+ и противоионов — анионов С1->Вг_>ЫОз~>1-. Приведенные лиотропные ряды характеризуют сродство ионов к растворителю. Таким образом, чем ионы более лиофобны, тем большим коагулирующим действием они обладают. Этот факт можно объяснить увеличением специфической адсорбции ионов этих рядов. Следует также учитывать вклад в коагулирующее действие противоионов, находящихся в диффузной части двойного электрического слоя. Чем гидрофильнее противоион, тем большее взаимодействие частиц со средой он обеспечивает и тем более устойчива система. Еще большее влияние на устойчивость (или коагуляцию) оказывают органические ионы, которые, обладая большой поверхностной активностью, могут нейтрализовать заряд в адсорбционном слое.
Коагулирующее действие смесей электролитов часто бывает неаддитивным. Иногда для начала коагуляции требуется смеси электролитов в большем количестве, чем одного из них. Такое явление называют антагонистическим действием электролитов. Если же смесь электролитов действует эффективнее одного электролита, то проявляется синергетическое действие электролитов. Очень сильное влияние на устойчивость и коагуляцию дисперсных систем оказывают электролиты, вступающие в химическое взаимодействие с противоионами мицелл или стабилизирующим электролитом.
Рассмотренные выше количественные закономерности коагуляции электролитами относятся в основном к порогу быстрой коагуляции, для которой потенциальный барьер равен нулю или фактор устойчивости (коэффициент стабильности) равен единице. Проведенный Н. А. Фуксом анализ соотношений для медленной коагуляции с учетом только электростатического отталкивания показал, что фактор устойчивости в первом приближении определяется уравнением
(VI-119>
Сравнение этого уравнения с определением фактора устойчивости (VI.22) показывает, что стерический множитель Р в (VI.22) связан с величиной к, обратной толщине диффузного слоя, и радиусом частиц г соотношением
Анализ соотношений для медленной коагуляции предсказывает линейную зависимость (в логарифмических координатах) фактора устойчивости W от концентрации электролита с, что подтверждается экспериментально.
Заканчивая рассмотрение теории ДЛФО, следует отметить, что термодинамическая теория агрегативной устойчивости и кинетическая (физическая) теория ДЛФО хорошо согласуются, дополняя одна другую, и подтверждаются опытом.
 2 ноября, 2012
2 ноября, 2012  admin
admin 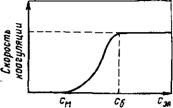
 Опубликовано в рубрике
Опубликовано в рубрике 