|
|
Общим термодинамическим уравнением адсорбции является фундаментальное адсорбционное уравнение Гиббса (11.63), связывающее изменения поверхностного натяжения и химиче
ских потенциалов компонентов системы. В данном разделе представлено рассмотрение распределения вещества между объемом и поверхностным слоем с термодинамических позиций путем перехода от химических потенциалов (адсорбционного потенциала) к термодинамическим активностям. Очевидно, такое рассмотрение справедливо как для систем с газовой (паровой) фазой, так и для растворов, и оно не связано с изменением поверхностного натяжения.
Закономерности адсорбции, описанные ниже, легко получить, если поверхностный слой представить как отдельную фазу, в которой активности адсорбата в отдельных участках адсорбционного поля автоматически выравниваются, как это происходит на границе раздела жидкость — газ или жидкость — жидкость. Поверхность твердых тел, как правило, неоднородна геометрически (шероховатость, наличие дефектов) и химически, и чтобы получить простейшие закономерности адсорбции, необходимо предположить, что поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое. Итак, если поверхностный слой представить как отдельную фазу, то можно рассматривать процесс перераспределения вещества как выравнивание химических_потенциалов распределяемого вещества в адсорбционном слое р. и в объеме М — до ц =
Используя определение термодинамической активности H = In а и = + In а
Получим при условии равновесия
Aja =s exp ^ —- — Кг <ш-8>
Где и — химический потенциал распределяемого вещества в адсорбционном слое и в объеме в стандартных состояниях соответственно; а и а — Активности распределяемого вещества в адсорбционном слое и объеме соответственно; К г — константа распределения, называемая константой Генри; она ие зависит от концентрации.
Для неэлектролитов (в том числе для газов, паров) а = с*{ И тогда
Ау —
A~Kvc<Th или D=>Alc=>KrVh (III.9)
Где А — величина адсорбции — концентрация адсорбата в адсорбционном слое или количество вещества в адсорбционном слое, приходящееся иа единицу поверхности (на единицу массы адсорбента); с — концентрация в объеме; 7 и 7 — коэффициент активности адсорбата в адсорбционном слое и объеме соответственно; D —■ коэффициент распределения.
Уравнения (III.8) и (III.9) в общем виде отражают изотерму адсорбции при любых концентрациях. Однако коэффициен-
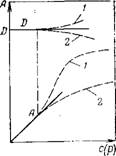
Рис. Ill.3. Изотерма адсорбции Генри:
/и 2 — соответственно положительные и отрицательные отКлонения от закона Генри
Ты активности, как и величина адсорбции, зависят от концентрации, а вид зависимости чаще всего неизвестен. (Поведение электролитов будет рассмотрено при описании адсорбции из растворов.)
Так как для бесконечно разбавленных растворов (при малом давлении газов, паров) коэффициенты активности равны единице, то на основании уравнения (III.9) можно сформулировать следующую закономерность: при разбавлении системы (уменьшение давления) коэффициент распределения стремится к постоянному значению, равному константе распределения Генри. В этом и состоит закон Генри. Относительно величины адсорбции А этот закон запишется так:
А = Кгс, A = K‘tp (111.10*
Где р—давление газа илн пара, которое связано с концентрацией согласно уравнению Клапейрона — Менделеева для идеального газа p = cRT. т. е. К,- — K‘yRT
|
|
Уравнения (III.10) представляют собой изотермы адсорбции вещества при малых концентрациях. В соответствии с ними закон Генри можно сформулировать так: величина адсорбции при малых давлениях газа (концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации). Эта зависимость показана на рис. III.3. При адсорбции на твердых адсорбентах область действия этого закона мала из-за неоднородности поверхности. Но даже на однородной поверхности с увеличением концентрации вещества или давления пара обнаруживается отклонение от линейной зависимости. Это связано с тем, что, например, при положительной адсорбции концентрация вещества в поверхностном слое растет быстрее, чем увеличение ее в объеме, соответственно коэффициенты активности адсорбата на поверхности адсорбента раньше начинают отклоняться от единицы. При малых концентрациях распределяемого вещества отклонения от закона Генри обусловлены, главным образом, соотношением между взаимодействиями молекул друг с другом и с поверхностью адсорбента. Если больше когезионное взаимодействие адсорбата, то отклонение от закона Генри отрицательное — коэффициенты активности меньше единицы (положительное отклонение от закона Рауля), и коэффициент распределения D увеличивается (кривая / на рис. III.3); если же сильнее взаимодействие адсорбат — адсорбент, то отклонение от закона Генри положительное (отри-
нательное отклонение от закона Рауля) и коэффициент распределения уменьшается (кривая 2).
При дальнейшем увеличении концентрации адсорбата или давления его пара свободная поверхность адсорбента уменьшается, что влечет за собой снижение его реакционной способности, выражающееся в росте коэффициентов активности адсорбата на поверхности адсорбента (кривые на рис. III.3 загибаются к оси абсцисс).
Коэффициенты активности адсорбата в поверхностном слое могут быть определены из экспериментальной изотермы адсорбции. Константу Генри получают экстраполяцией коэффициента распределения на нулевую концентрацию. Если известны коэффициенты активности распределяемого вещества в объеме, то по уравнению (III.9) легко определить коэффициенты активности компонента в адсорбционном слое. Обратная задача, т. е. получение изотермы адсорбции, требует знания закономерностей изменения коэффициентов активности из независимых экспериментов. Решение этой задачи — сложное и трудоемкое.
В соответствии с правилом фаз Гиббса (11.169), равновесные параметры гетерогенных систем зависят от дисперсности (или удельной поверхности). Для адсорбционных систем эга зависимость выражается в уменьшении концентрации вещества в объеме с увеличением удельной поверхности адсорбента. Если в такой системе содержание распределяемого вещества постоянно, то
Ams>N + cV=B
Где т—масса адсорбента; а>д—удельная поверхность адсорбента; V— объем фазы, из которой извлекается вещество; В — постоянное количество вещества в системе.
С учетом уравнения (III.10) концентрация вещества в объемной фазе равна
Из соотношения (111.11) следует, что с увеличением удельной поверхности (дисперсности) при постоянном количестве адсорбата в системе концентрация его в объеме уменьшается и тем сильнее, чем больше константа Генри и меньше объем фазы.
 2 ноября, 2012
2 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 