Если двойной электрический слой представить как плоский конденсатор, тогда его интегральную емкость необходимо принять постоянной и равной
C=Qs/IР (11.104)
Теоретическая электрокапилляриая
В уравнении (11.104) емкость относится к единице площади поверхности, так как берется плотность заряда Qs■ Так как по предположению емкость двойного электрического слоя не зависит от потенциала, то, подставляя в уравнение Липпмана выражение Qs из (11.104), получим: Da/D(F= — Ccf; Da = — C(Fd(F
|
|
|
Рис. II.1 кривая |
Интегрируя ЭТО уравНЄНИЄ В пределах ОТ О ДО Омане (максимальное значение о) и от ф до ф(0) (заряд равен нулю — точка нулевого заряда), найдем:
Макс <Г(0)
Da t= — С | q:d(f
О
СТмакс — CT=C[(f2/2 — (f2(0)/2l
Если принять за начало отсчета потенциал в точке нулевого — заряда, т. е. ф (0), то
А=0„акс — СЛф2/2 (11.106)
Уравнения (11.105) и (11.106) называют уравнениями электрокапиллярной кривой. Из них следует, что поверхностное натяжение при условии постоянства емкости двойного электрического слоя изменяется в соответствии с уравнением параболы (рис. 11.11). Вершина параболы отвечает максимальному поверхностному натяжению Омане. Парабола симметрична, что по физическому смыслу означает равное сродство катионов и анионов, выступающих в роли противоионов, к поверхности, имеющей соответственно отрицательный и положительный потенциал. Уменьшение положительного потенциала, как и отрицательного, ведет к увеличению поверхностного натяжения. Однако в реальных системах емкость двойного электрического слоя несколько изменяется с изменением потенциала, и поэтому экспериментальные электрокапиллярные кривые обычно не являются симметричными.
Вершина параболы соответствует точке нулевого заряда. В этой точке поверхностное натяжение не зависит от потенциала, так как производная Da/Dy равна нулю, т. е. поверхностный слой имеет нулевой заряд, что означает отсутствие двойного электрического слоя. Потенциал же поверхности в этой точке не равен нулю. Например, можно подобрать такой раствор, в котором химический потенциал иона металла будет равен химическому потенциалу этого иона на опу
щенном в раствор электроде (металлической пластине) из того же металла. В этом случае перераспределение ионов между электродом и раствором не будет и двойной электрический слой не возникает. Такой раствор называется нулевым раствором, а электрический потенциал на электроде — потенциалом нулевого заряда. Разность потенциалов двух электродов в нулевом растворе равна внешней контактной разности потенциалов электродов, которая, в свою очередь, определяется разностью работ выхода электронов для этих металлов. Так, при контакте двух разных металлов электроны с поверхности одного из них переходят на поверхность другого до установления равновесия и постоянной разности потенциалов, равной разности между их потенциалами нулевых зарядов.
Уравнения электрокапиллярной кривой названо так потому, что выражаемые ими зависимости экспериментально проверялись Липпманом с помощью прибора, называемого капиллярным электрометром. При исследовании зависимости поверхностного натяжения от потенциала двойного электрического слоя в качестве одной из фаз наиболее удобно применять металлическую ртуть, поверхностное натяжение которой легко измерить, например, капиллярным методом, и в то же время удобно изменять электрический потенциал на межфазной границе ртуть — раствор с помощью внешнего источника тока. Кроме того, ртуть является почти идеально поляризуемым электродом, т. е. таким электродом, на котором не протекают электродные реакции при прохождении тока, и поэтому изменение заряда электрода вызывает только изменение его потенциала. Это обусловлено тем, что благородные металлы почти совсем не отдают своих ионов в раствор. Из-за малого содержания нх в растворе невозможна и обратная реакция (восстановление).
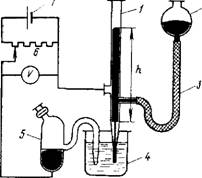
Принцип действия капиллярного электрометра и его устройство иллюстрирует рис. 11.12. Капиллярная трубка 1 с ртутью, соединенная с одним полюсом источника тока 7, опущена в сосуд с электролитом 4, который через каломельный электрод 5 соединен с другим полюсом источника тока. При контакте ртути с раствором электролита, например сульфата натрия, добавляемого для увеличения электропроводности раствора,
Рис. 11.12. Схема капиллярного электрометра:
|
|
1 — капиллярная трубка с ртутью: 2—сосуд с ртутью: 3 — резиновый шланг; 4 — Стакаи с раствором электролита: 5 — сосуд с каломельным электродом: 6 — реостат; 7 — источник тока (аккумулятор)
|
Рис. 11.14. Влияние адсорбции иеиоио — генных ПАВ на электрокапиллярную кривую: / — раствор NajS04′. 2 — раствор Na2SO< с добавкой пролионовой кислоты; 3 — расгвор Na2SO(, насыщенный масляной кислотой |
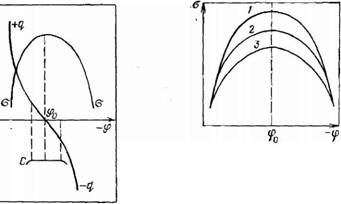
Рис. 11.13. Зависимость поверхностного натяжения ртути, заряда и емкости двойного электрического слоя от электрического потенциала на границе с водным раствором сульфата натрия. Электрокапиллярная кривая экспериментальная, остальные зависимости — расчетные
Возникает электрический потенциал на межфазной поверхности. С помощью внешнего источника тока изменяют электрический потенциал, что вызывает изменение поверхностного натяжения на границе ртуть — раствор и соответственно высоты столба ртути h в капилляре. Поднимая или опуская сосуд 2 со ртутью, совмещают нижний мениск ртути с риской на капилляре, отмечают верхний уровень ртути и по полученной высоте h определяют поверхностное натяжение. Регистрируя таким образом зависимость поверхностного натяжения от электрического потенциала, получают электрокапиллярную кривую.
На рис. 11.13 показаны зависимости поверхностного натяжения о, заряда Q и емкости С двойного электрического слоя от электрического потенциала. По экспериментальной кривой •о=/(ф), например, с помощью графического дифференцирования можно рассчитать зависимость плотности заряда Qs от потенциала ф (11.97). Второе дифференцирование экспериментальной электрокапиллярной кривой позволяет получить зависимость емкости двойного электрического слоя от потенциала (11.99).
Экспериментальные электрокапиллярные кривые почти полностью повторяют ход теоретической кривой. Таким образом было подтверждено уравнение Липпмана. Однако изменение емкости двойного электрического слоя с изменением потенциала в реальных системах нарушает симметричность ветвей параболы электрокапиллярной кривой. Основное влияние оказывает природа ионов, образующих двойной электрический слой.
При положительном потенциале электрода (левая ветвь кривой) слой противоионов в растворе образуют анионы, а при отрицательном потенциале электрода (правая ветвь кривой) слой противоионов составляют катионы.
Как правило, анионы в меньшей степени гидратируются и сильнее поляризуются в электрическом поле, поэтому они будут ближе находиться к поверхности электрода и толщина двойного электрического слоя будет меньше, чем при наличии катионов. Так как емкость двойного электрического слоя больше при меньшей его толщине б (расстояние между обкладками конденсатора)
С=^Лго = е«/б = Єое7б — (11.107)
Где фо — электрический потенциал двойного электрического слоя; еа — абсолютная диэлектрическая проницаемость; г — относительная диэлектрическая проницаемость; е0 — электрическая постоянная, равная 8,854-Ю-‘2 Ф/м
То при увеличении положительного потенциала (левая ветвь кривой) поверхностное натяжение на границе ртуть — раствор будет более резко снижаться, чем при увеличении отрицательного потенциала. Именно поэтому на рис. 11.13 правая ветвь параболы менее крутая, чем левая.
С увеличением потенциала поляризация анионов увеличивается, а б уменьшается, что еще сильнее сказывается на асимметрии электрокапиллярной кривой. При больших потенциалах могут поляризоваться и катионы. В результате линейная зависимость <7 от ф, соответствующая теоретической электрокапиллярной кривой, в реальных системах наблюдается обычно в области, близкой к точке нулевого заряда, а вдали от нее линейность зависимости нарушается.
При наличии в растворе ПАВ форма электрокапиллярной кривой может существенно изменяться, так как адсорбция ПАВ вызывает дополнительное изменение поверхностного натяжения (кроме действия электрического потенциала). Влияние ПАВ на электрокапиллярную кривую зависит от природы этих веществ и их концентрации. Адсорбция на межфазной поверхности зависит также от электрического потенциала, который в соответствии с уравнением Липпмана определяет поверхностное натяжение.
|
65 |
Если ПАВ не проявляет заметные ионогенные свойства, то оно лучше адсорбируется на слабо заряженной поверхности, т. е. вблизи точки нулевого заряда, где больше поверхностное натяжение. Это связано с тем, что именно при этих условиях уменьшение энергии Гиббса поверхностного слоя в результате адсорбции наибольшее. Экспериментальные данные полностью подтверждают этот вывод (рис. 11.14). Максимум электрокапиллярной кривой в присутствии ПАВ снижается, становится менее четким, но не сдвигается по оси потенциала. Такая зако-
5 Фролов Ю. Г.
Иомерность позволяет использовать метод, основанный на адсорбции неионогенных ПАВ, для нахождения точки нулевого заряда.
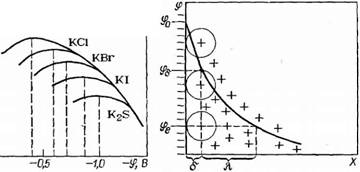
Ионогенные вещества, ионы которых значительно различаются по поверхностной активности, могут сдвигать точку нулевого заряда в ту или иную сторону по оси потенциала. Так, анионы ОН-, S042~, С032~, НР042- не являются поверхностно — активными в системе вода — ртуть (они сильно гидратированы ■и к ртути не проявляют специфического сродства) и поэтому слабо влияют на положение точки нулевого заряда. Ионы С1~, Br~, CNS~, F S2~ являются в данной системе поверхностно — активными, причем их активность в этом ряду возрастает, и они сдвигают точку нулевого заряда ртутного электрода в область более отрицательных значений электрического потенциала (рис. 11.15). Механизм такого действия состоит в следующем. В результате адсорбции отрицательных ионов на поверхности электрода даже тогда, когда он заряжен отрицательно, электрод становится более положительным относительно слоя адсорбированных ионов. Чем больше сродство анионов к электроду, тем этот эффект проявляется сильнее и тем больший отрицательный потенциал нужно подать на электрод, чтобы предотвратить адсорбцию (получить точку нулевого заряда).
Таким образом, поверхностно-активные анионы, адсорбиру — ясь, не только снижают поверхностное межфазное натяжение, но и обусловливают более отрицательное значение потенциала точки нулевого заряда. Обратная зависимость наблюдается для
|
Рис. 11.15. Смещение точки нулевого заряда электрокапиллярной кривой при адсорбции анионов ОН-, С1~, Вг~, I-, S2- |
|
U20- КОН То ^ 370 — £ 345- |
Рис. 11.16. Двойной электрический слой и изменение в нем потенциала.
Фо. Фв. Чу—электрический потенциал соответственно двойного электрического слоя, диффузного слоя и диффузного слоя на расстоянии, равном А, б — толщина адсорбционного слоя, X — толщина диффузного слоя
Поверхностно-активных катионов (Th4f, А13+ и др.), т. е. поверхностно-активные катионы сдвигают точку нулевого заряда в сторону положительных значений электрического потенциала.
 2 ноября, 2012
2 ноября, 2012  admin
admin 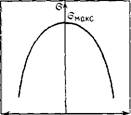
 Опубликовано в рубрике
Опубликовано в рубрике 