|
Рис. VI.5. Мицеллы сферические (а), дискообразные (б) и цилиндрические (в) |
|
6 8 |
При концентрациях ПАВ в водном растворе, несколько превышающих ККМ, согласно представлениям Гартли образуются сферические мицеллы (см. рис. VI.5). Эти мицеллы обычно называют мицеллами Гартли. Внутренняя часть миЦелл Гартли состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл равен удвоенной длине молекул ПАВ. Число молекул в мицелле быстро растет в пределах узкого интервала
концентраций, а при дальнейшем увеличении концентрации практически не изменяется, а увеличивается число мицелл. Сферические мицеллы могут содержать от 20 до 100 молекул и более. Например, по результатам измерения светорассеяния, мицелла додецилсульфата натрия состоит в среднем из 73 молекул. Число ассоциации увеличивается при добавлении в раствор ПАВ электролитов. Размер мицелл ионогенных ПАВ постепенно уменьшается с повышением температуры, размер же мицелл неионогенных ПАВ возрастает с температурой.
При увеличении концентрации ПАВ мицеллярная система проходит ряд равновесных состояний, различающихся по числам ассоциации, размерам и форме мицелл. При достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что способствует их деформации. Мицеллы стремятся принять цилиндрическую, дискообразную, палочкообразную, пластинчатую форму (см. рис. VI.5). Существование пластинчатых мицелл доказано Мак-Беном. При концентрациях примерно в 10—50 раз больше ККМ мицеллярная структура многих ПАВ резко изменяется. Молекулы принимают цепочечную ориентацию и вместе с молекулами растворителя способны образовывать жидкокристаллическую структуру. Последней стадией агрегации при дальнейшем удалении воды из системы является образование гелеобразной структуры и твердого кристаллического ПАВ.
В растворах коллоидных ПАВ количество вещества в мицеллярной форме во много раз может превышать его количество в молекулярном состоянии. Так как эти формы находятся в равновесии, то возможно достижение большого содержания ПАВ в растворителях при равновесных условиях, несмотря на их небольшую истинную растворимость (ККМ лежит в пределах Ю-5—Ю-2 моль/л). Этот факт имеет существенное значение для широкого использования ПАВ в различных промышленных областях.
Мицеллы ионогенных ПАВ обычно заряжены, электрический заряд зависит от кислотно-основных свойств функциональной группы ПАВ и от условий среды (рН, наличие электролитов, температуры и др.). Наличие заряда на мицеллах проявляется, например, в их электрофоретической подвижности.
Мицеллообразование в неводных средах, как правило, является результатом действия сил притяжения между. полярными группами ПАВ и взаимодействия углеводородных радикалов с молекулами растворителя. Образующиеся мицеллы обращенного вида содержат внутри негидратированные или гидратиро- ваиные полярные группы, окруженные слоем из углеводородных радикалов. Число ассоциации (от 3 до 40) значительно меньше, чем для водных растворов ПАВ. Как правило, оно растет с увеличением углеводородного радикала до определенного предела.
Вследствие низкой диэлектрической проницаемости неполярных растворителей ионогенные ПАВ в них практически не диссоциируют. Когезионные силы между молекулами ПАВ в мицеллах обусловлены, главным образом, диполь-дипольным взаимодействием между ионными парами и возможными водородными связями. Мицеллообразованию в неводных средах может способствовать наличие воды, связывающей полярные группы. Она оказывается внутри мицеллы. Избыточное количество воды, растворенной в среде, может привести к обращению структуры мицеллы.
Явление растворения веществ в мицеллах ПАВ называется Солюбилизацией. В водных мицеллярных системах солюбилизи — руются вещества, нерастворимые в воде, например, бензол, органические красители, жиры. Это обусловлено тем, что ядро мицеллы проявляет свойства неполярной жидкости. В органических мицеллярных растворах, в которых внутренняя часть, мицелл состоит из полярных групп, солюбилизируются полярные молекулы воды, причем количество связанной воды может быть значительным. Вещество, солюбилизированное раствором ПАВ, называют солюбилизатом, а ПАВ — солюбилизатором.. Количественно солюбилизацию (солюбилизирующую способность) характеризуют значением мольной солюбилизации Sm — Количеством молей солюбилизата, отнесенного к 1 моль мицел — лярного ПАВ.
Способ включения молекул солюбилизата в мицеллы в водных растворах зависит от природы вещества. Неполярные углеводороды, внедряясь в мицеллы, располагаются в углеводородных ядрах мицелл. Полярные органические вещества (спирты, амины, кислоты) встраиваются в мицеллу между молекулами ПАВ так, чтобы их полярные группы были обращены к воде, а липофильные части молекул ориентированы параллельно углеводородным радикалам ПАВ. Возможен и третий способ включения солюбилизата в мицеллы, особенно характерный для неионогенных ПАВ. Молекулы солюбилизата, например фенола, не проникают внутрь мицелл, а закрепляются на их поверхности, располагаясь между беспорядочно изогнутыми полиокси — этиленовыми цепями.
При солюбилизации неполярных углеводородов в ядрах мицелл углеводородные цепи раздвигаются, в результате размер мицелл увеличивается. Способность коллоидных ПАВ солюби — лизировать углеводороды возрастает с ростом концентрации ПАВ. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата.
Солюбилизация — самопроизвольный и обратимый процесс; данной концентрации ПАВ и температуре соответствует вполне определенное насыщение раствора солюбилизатом. В результате солюбилизации получаются устойчивые дисперсные системы, подобные самопроизвольно образующимся ультрамикрогетеро — генным эмульсиям.
Явление солюбилизации находит широкое применение в различных процессах, связанных с применением ПАВ, например, в эмульсионной полимеризации, при изготовлении эмульсионных смазочных жидкостей, получении фармацевтических препаратов, пищевых продуктов. Солюбилизации — важнейший фактор моющего действия ПАВ. Это явление играет большую роль в жизнедеятельности живых организмов, являясь одним из звеньев процесса обмена веществ.
 2 ноября, 2012
2 ноября, 2012  admin
admin 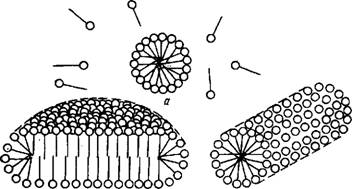
 Опубликовано в рубрике
Опубликовано в рубрике 