Критическая концентрация мицеллообразования — важнейшая характеристика растворов ПАВ. Она зависит прежде всего от строения углеводородного радикала в молекуле ПАВ и характера полярной группы, наличия в растворе электролитов и неэлектролитов, температуры и других факторов.
Длина углеводородного радикала оказывает решающее влияние на процесс мицеллообразования в водных средах. Понижение энергии Гиббса системы в результате мицеллообразования тем больше, чем длиннее углеводородная цепь. Исследования показывают, что образование предмицеллярных ассоциа — тов наблюдается в поверхностно-активных электролитах с наличием в углеводородной цепи более четырех атомов углерода. Однако в таких соединениях слабо выражено различие между гидрофильной и гидрофобной частями (высокое значение ГЛБ). В связи с этим энергия ассоциирования недостаточна, чтобы удержать молекулы от беспорядочного теплового движения и тем самым создать условия для мицеллообразования. Как правило, способность к мицеллообразованию свойственна молекулам ПАВ с длиной углеводородного радикала более 8—10 атомов углерода.
Уравнение, устанавливающее связь между ККМ « длиной углеводородного радикала, может быть выведено из рассмотрения мицеллообразования как процесса образования новой фазы. При равновесии химические потенциалы ПАВ в растворе цр и в мицелле равны цр = |д, м, и можно записать:
Ц0р+ЯПпККМ=ц0м+ДГ1пам (VI.51)
Считая мицеллу фазой чистого ПАВ, можно принять era активность в мицелле равной единице. Тогда получим:
RT In ККМ=ц°м — Ц°Р (VI.52V
Левая часть уравнения (VI.52) представляет собой энергию переноса вещества из раствора в чистое состояние, т. е. энергию растворения. Известно, что энергия растворения органических соединений в воде уменьшается линейно с увеличением длины углеводородного радикала. Следовательно
/?ЛпККМ=а — Ьп (VI.53)
Где а — постоянная, характеризующая энергию растворения функциональных групп (полярных частей молекул); Ь — постоянная, характеризующая энергию растворения, приходящуюся на одну группу СН2; п — число групп СН2.
Для органической среды имеем:
RT In K. KM=a+6rt (VI.54)
Т. е. при увеличении длины углеводородного радикала повышается растворимость ПАВ и возрастает ККМ. Разветвленность, непредельность и циклизация углеводородного радикала уменьшают склонность к мицеллообразованию и увеличивают ККМ.
Характер полярной группы играет существенную роль при мицеллообразовании в водных и неводных средах. Ее влияние па ККМ отражает параметр а в уравнениях (VI.53) и (VI.54). Роль гидрофильных групп в водных растворах ПАВ заключается в том, чтобы удерживать образующиеся ассоциаты в воде и регулировать их размер. Сферическая форма ионных мицелл устанавливается, если энергия ассоциирования углеводородных цепей достаточно большая и превышает энергию электростатического отталкивания между ионными группами. Гидратация противоионов, окружающих мицеллу, способствует отталкиванию, а менее гидратированные ионы легче адсорбируются на поверхности мицелл. В связи с этим наблюдается уменьшение ККМ и увеличение мицеллярной массы для катионных ПАВ в ряду С1-<В-<1- и анионных ПАВ в ряду Na+<K+<Cs+. Наличие ионных концевых групп обеспечивает хорошую растворимость ПАВ в воде, поэтому для перехода ионогенных молекул в мицеллу требуется значительно больше энергии, чем для образования мицелл из неионогенных молекул. В связи с этим ККМ для ионогенных ПАВ значительно выше, чем для неионогенных, при одинаковой гидрофобности молекулы. Величина lg ККМ неионогенных ПАВ с полиоксиэтиленовой цепью растет с увеличением длины цепи по линейному закону.
Введение электролитов в водные растворы неионогенных ПАВ слабо влияет на ККМ и размер мицеллы. Для ионогенных ПАВ это влияние существенно. Сравнение свойств ионогенных и неионогенных ПАВ, имеющих одинаковые углеводородные цепи, показывает, что мицеллярная масса ионогенных ПАВ намного меньше, чем для неионогенных, причем с ростом концентрации электролита мицеллярная масса ионогенных ПАВ растет, а неионогенных ПАВ изменяется мало. Влияние электролитов
На ККМ описывается общим уравнением (для — ионогенных: ПАВ):
In ККМ=а’ — Ъ‘п — Knc (VI.55)
Где а’ к У — постоянные, имеющие тот же физический смысл, что и в уравнении (VI.53); K — константа; с — концентрация индифферентного электролита.
В отсутствие индифферентного электролита с = ККМ, и уравнение (VI.55) переходит в (VI.53); при n = const получается зависимость ККМ только от концентрации электролита.
Введение неэлектролитов (органических растворителей) в водные растворы ПАВ также приводит к изменению ККМ. При наличии солюбилизации устойчивость мицелл повышается, т. е. уменьшается ККМ. Если молекулы растворителя не входят внутрь мицелл, то они, как правило, увеличивают ККМ или за счет повышения растворяющей способности среды, или в результате уменьшения ее диэлектрической проницаемости и увеличения силы отталкивания между органическими ионами ионогенных ПАВ. В то же время с уменьшением диэлектрической проницаемости растворителя снижается диссоциация ионогенных ПАВ, что увеличивает способность ПАВ к образованию мицелл.
Для регулирования свойств ПАВ применяют их смеси, в которых проявляются синергетические или антагонистические эффекты, т.„ е. такие смеси могут иметь значительно более высокую или менее высокую мицеллообразующую, солюбилизи — рующую способности и др.
Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения а, мутности т, эквивалентной электропроводности К, осмотического давления я, показателя преломления п). На кривой зависимости свойство — состав в области ККМ обычно появляется излом (рис. VI.6). Одна из ветвей кривых (при более низких концентрациях) на рис. VI.6 описывает свойства системы в молекулярном состоянии, а другая — в коллоидном. Абсциссу точки излома условно считают соответствующей переходу молекул в мицеллы, т. е. критической концент-
|
|
Рис. VI.6. Зависимость мутности т, эквивалентной электропроводности X, поверхностного натяжения а, показателя преломления п осмотического давления я раствора додецил — сульфата натрия в воде от его коицентра — С, %(масс.) ции
|
|
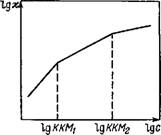
Рнс. VI.7. Зависимость удельиой электропроводности раствора ионогенного ПАВ от его концентрации
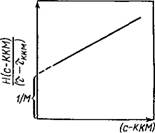
Рис. VI.8. Графическое определение мицеллярной массы ПАВ по мутности, раствора
Рацией мицеллообразования. Ниже приводится краткое описание некоторых методов определения ККМ.
Кондуктометрический метод применяется для определения ККМ ионогенных ПАВ. Зависимость эквивалентной электропроводности от концентрации ПАВ отличается от аналогичной зависимости для растворов простых электролитов. В области до ККМ, водные растворы ПАВ обнаруживают отклонение от уравнения Онзагера (линейное уменьшение эквивалентной электропроводности в зависимости от с1′) в той же степени, которая характерна для средних по силе электролитов. Однако уже при малых концентрациях («10~3 моль/л) на кривой концентрационной зависимости эквивалентной электропроводности наблюдается излом. При этих концентрациях начинают формироваться ионные мицеллы, окруженные диффузным слоем противоионов. Подвижность ионов при этом снижается и эквивалентная электропроводность уменьшается с увеличением концентрации резче, чем до критической концентрации мицеллообразования. В точке ККМ наблюдается также уменьшение наклона подобной зависимости для удельной электропроводности.
Изменение удельной электропроводности позволяет определить ККМ2 — концентрацию, при которой происходит перекрывание двойных электрических слоев мицелл при сохранении их сферической формы Дрис. VI.7).
|
|
Другой метод определения ККМ основан на измерении поверхностного натяжения водных растворов ПАВ, которое резко уменьшается с ростом концентрации (см. рис. VI.6) вплоть до ККМ, а затем остается постоянным. Этот метод применим как для ионогенных, так и для неионогенных ПАВ, однако при наличии примесей точку излома на кривой о—с установить. трудно.
График зависимости показателя преломления от концентрации раствора ПАВ представляет собой ломаную линию из двух отрезков, пересекающихся в точке ККМ. По этой зависимости можно определить ККМ для ПАВ в водных и неводных средах.
Солюбилизация красителей и углеводородов в мицеллах позволяет определять ККМ ионогенных и неионогенных ПАВ как в водных, так и неводных растворах. При достижении в растворе ПАВ концентрации, соответствующей ККМ, растворимость углеводородов и красителей резко увеличивается. Наиболее удобно применять жирорастворимые красители, интенсивно окрашивающие раствор ПАВ при концентрациях его выше ККМ. Солюбилизацию измеряют методом, основанным на светорассеянии, или спектрофотометрически.
Измерение интенсивности светорассеяния при мицеллообра- зовании позволяет не только находить ККМ по резкому увеличению наклона концентрационной кривой, но и определять ми — целлярную массу и числа ассоциации. Согласно теории светорассеяния в разбавленных коллоидных системах, частицы которых имеют размер меньше 0,1 длины волны света, выполняется соотношение Дебая:
Ff(c-KKM) 1 Т-W — ЗЙЇГ — ККМ) (VI.56)
Где Н — оптическая константа Дебая (V.26); с — концентрация раствора ПАВ; т н Тккм —мутность раствора н мутность его прн ККМ соответственно; Мм—мнцеллярная масса; А — второй внрнальный коэффициент.
Строят зависимость Я(с—ККМ)/(т—тккм) =/(с—ККМ) (рис. VI.8), предварительно определив ККМ одним из методов. По отрезку, отсекаемому на оси ординат, рассчитывают мицел — лярную массу. Зная молекулярную массу ПАВ, находят число ассоциации т:
M=MK/M (VI.57)
Определяемые этим методом значения второго вириального коэффициента А позволяют оценить силу взаимодействия мицелл с растворителем.
 2 ноября, 2012
2 ноября, 2012  admin
admin 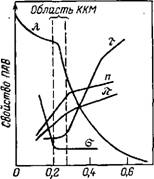
 Опубликовано в рубрике
Опубликовано в рубрике 