Теоретическая скорость коагуляции. Скорость быстрой коагуляции может быть подсчитана по уравнению Смолуховского как уменьшение числа частиц N по времени т:
dx 8ndNfi’ K ‘ ‘
i ic V0 и N — число частиц в единице объема суспензии, первоначальное и через промежуток примени т соответственно; d — диаметр частиц; D — коэффициент диффузии, D = /.// (6ndr|) (г) —вязкость среды; k — постоянная Больцмана; Т — абсолютная темпера-
1 V)>.l)
Подставляя значение коэффициента диффузии в уравнение для времени, за которое число частиц уменьшится вдвое, получим:
т1/2 = 3г,/ (4kTN). (3.30)
Для реального пигментированного лакокрасочного материала при комнатной температуре, когда #о = 8-10п частиц, т| = 1 -=-10 Па*с; /.’/ л4,1 • 10_2t Дж, уменьшение числа частиц вдвое произойдет за время oi 15 мин до 2,5 ч. Практически коагуляция протекает гораздо медленнее, і. ік как не каждое соударение приводит к слипанию частиц. Чтобы про — и КЗПТО слипание, частицы должны преодолеть некоторый энергетический бмрьер АЕ. Скорость медленной коагуляции w можно определить по ныражению:
ш = (1/р) exp (AE/kT), (3.31)
i;U’ p стерический коэффициент, учитывающий форму, размер и расположение частиц.
В полидисперсных системах коагуляция протекает быстрее, при этом мелкие частицы исчезают значительно скорее. Частицы, имеющие форму листков, коагулируют с такой же скоростью, как и сферические; иглообразные значительно быстрее.
Факторы агрегативной устойчивости дисперсных систем. В настоящее иремя не существует общей универсальной количественной теории агрегативной устойчивости, но определены факторы стабилизации дисперсных систем в соответствии с теориями: I) Дерягина — Ландау — Фервея — Овербека (теория ДЛФО) — равновесия сил притяжения и отталкивания частиц при наличии на их поверхности двойного электрического слоя; 2) П. А. Ребиндера — наличия структурно-механического барьера, создаваемого на частицах толстыми, прочными и упругими адсорбционносольватными слоями; 3) теория энтропийного и энтальпийного отталкивания частиц при перекрытии рыхлых адсорбционио-сольватных слоев с подвижными цепями и петлями полимеров.
Теория ДЛФО. Между частицами одновременно действуют ван-дер — иаальсовы силы притяжения и силы отталкивания, создаваемые при наложении двойных электрических слоев поверхности частиц. Потенциальную энергию дальнодействующих сил притяжения UA приближенно описывает уравнение:
UA=Ad (12/i), (3.32)
где А • постоянная Гамакера, определяющая дисперсионные взаимодействии, /1 = 10_19Ч — — f-10 п Дж, d —диаметр частиц, h — расстояние между поверхностями чипиц
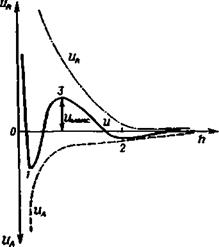
Рис. 3.17. Зависимость потенциальной энергии U от расстояния между поверхностями А 1 — первичный минимум и*ки i; 2 — вторичный минимум £/„,, г; 3 — энергетический барьер UMaKC-
 Неорганические пигменты, как правило, собственных электрических зарядов не имеют. Они их приобретают при адсорбции веществ, способных к диссоциации на ионы. Потенциальную энергию электрических сил отталкивания, действующих на расстоянии до 100 нм, обозначим UR.
Неорганические пигменты, как правило, собственных электрических зарядов не имеют. Они их приобретают при адсорбции веществ, способных к диссоциации на ионы. Потенциальную энергию электрических сил отталкивания, действующих на расстоянии до 100 нм, обозначим UR.
Полная потенциальная энергия взаимодействия между частицами равна:
UT = UA + U. (3.33)
Энергия отталкивания UR уменьшается с увеличением расстояния между частицами более медленно, чем энергия притяжения UA, Как видно из рис. 3.17, при самом малом расстоянии между частицами силы отталкивания, называемые силами Борна, резко возрастают. Частицы могут соединиться при сближении, если их потенциальная энергия UA превосходит значение с7макс на суммарной кривой, т. е. для взаимодействия необходима энергия активации. Единственным источником для преодоления этого энергетического барьера является тепловая энергия. Чем выше температура, тем больше частиц будут соединяться. Если UMaKC значительно больше тепловой энергии (£Л, ак<:> kT), дисперсия будет устойчивой.
Рзультирующая действия сил притяжения и отталкивания (кривая U на рис. 3.17) имеет два минимума — две потенциальные ямы. UMm при очень малом расстоянии между частицами определяет коагуляционное соединение частиц. £/„^2 проявляется при несколько большем расстоянии между центрами частиц. Если £/Мин2> kT, то частицы также соединяются, но это соединение может быть не непосредственным, а через прослойку окружающей среды, например адсорбированной жидкости, т. е. происходит флокуляция. Для редиспергирования коагуляционных контактов требуется затрата большого количества энергии; £^1 —иА. В этом случае образующиеся осадки могут быть практически необратимыми вследствие возникновения молекулярного взаимодействия между контактирующими поверхностями частиц. При флокуляции частицы хлопьевидного объемистого осадка связаны слабыми силами, и он легко редиспергируется при перемешивании.
На основе теории ДЛФО получены значения UA и UR в зависимости от размера частиц, поверхностных электрических потенциалов, диэлектрической проницаемости, ионной силы дисперсионной среды и постоянной Гамакера, характеризующей поляризуемость пигмента. При ряде допущений приближенно величина UR равна:
и R = er tf/R, (а34)
где е — димвктрическая проницаемость среды; г — радиус частиц; if—поверхностный потенциал двойного электрического слоя; вследствие трудности его измерения и качестве первого цИНлММИИм потенциала f принимают л-потенциал поверхности, R, ртчгоиние
между ШШИМ ЧЙСВц
Согласно теории ДЛФО, для придания дисперсиям достаточной устойчивости необходимо, чтобы энергия отталкивания была не менее 15 кТ.
Экспериментально доказано, что при г<0,5 мкм йе<5, как это имеет место в эмалях с неполярными органическими растворителями, стабилизация за счет электрического отталкивания практически не имеет места. Начиная с ел40 этот фактор становится заметным и для водных систем (е = 81) может вносить заметный вклад или даже быть определяющим фактором стабилизации при условии содержания в системе электролитов в количестве, не превышающем порога коагуляции. Поэтому пигменты, предназначаемые для водоразбавляемых красок, не должны содержать растворимых веществ, особенно ионов поливалентных металлов, свыше определенного жестко регламентированного количества.
Для неорганических пигментов, не имеющих собственного электрического заряда, в высококонцентрированных суспензиях, содержащих 8^ 101′ — 3* 1012 частиц/см3 в неполярных средах стабилизация за счет наложения двойных электрических слоев практически не имеет места.
Теория структурно-механического барьера. Представление о структурно-механическом барьере как о наиболее мощном и универсальном факторе, ослабляющем взаимодействие между частицами, особенно в высоконаполненных суспензиях в неполярных средах, растворах, не содержащих ионизируемых групп, и расплавах олигомеров и полимеров, ввел П. А. Ребиндер.
Адсорбционные слои на поверхности твердых частиц оказывают не только стерическое препятствие к сближению частиц до расстояния эффективного действия сил притяжения между частицами, но одновременно снижают запас поверхностной энергии, образуя новую поверхность раздела фаз с незначительной энергией взаимодействия 20—30 мДж, характерной для групп СНг и СН3. При большой толщине адсорбционносольватный слой, взаимодействуя с активными центрами твердой поверхности, полностью компенсирует ее силовое поле. Структурномеханический барьер эффективен, когда адсорбционный слой обладает высокой структурной вязкостью, упругостью и прочно связан с твердой поверхностью. Стабилизирующее действие возрастает по мере адсорбционного насыщения твердой поверхности и достигает максимума вблизи ее полного насыщения. В этом случае энергия столкновения двух частиц со сплошными адсорбционно-сольватными слоями условно может быть приравнена к эластичному удару сферических тел и определяется модулем упругости слоя.
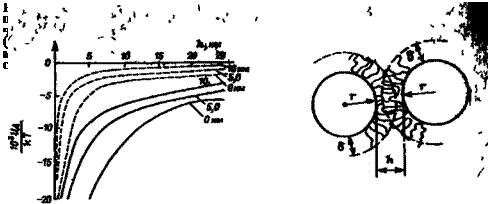
Расчеты энергии притяжения UA между частицами показывают, что с уменьшением размера частиц и расстояния между ними снижается и необходимая толщина адсорбционного слоя, препятствующего сближению частиц. Для частиц с г = 0,5 мкм она должна быть не менее 10 нм, для частиц с г = 0,1 мкм достаточно слоя толщиной 5 нм (рис. 3.18).
Энтропийное отталкивание. Механизм энтропийной стабилизации основан на том, что большие молекулы пленкообразователей, закрепленные одним концом или частью сегментов на поверхности пигмента, сохраняют подвижность своих углеводородных цепей, которые имеют возможность принимать любую пространственную конформацию, отвечающую минимальному энергетическому уровню. Сближение адсорбционных слоев двух частиц, а тем более их перекрывание снижает возможность реализации многих пространственных конформаций молекул, отвечающих минимуму энергии (рис. 3.19), т. е. приводит систему к снижению конформационной энтропии. В соответствии со вторым законом
термодинамики без подвода энергии извне такой процесс сближения не может осуществиться, что равносильно наличию определенного энергети-, ческого барьера, препятствующего сближению частиц с рыхлыми адсорбционно-сольватными оболочками
Энергия энтропийного отталкивания U может быть рассчитана по уравнению Хесселинка
Щ={2л/27) 2v2kT<h2>3/2(a2-) 9 (3 35)
где v — количество петель и хвостов цепей пленкообразователя приходящихся на единицу поверхности пигмента, <h2> 1/2 среднеквадратичное расстояние между концами цепей полимерного клубка, а — степень набухания полимерного клубка s — геометрическая функция для петель и хвостов полимера в зависимости от расстояния
Энталыгийное отталкивание При сближении частиц пигментов и перекрывании сольватных слоев (см рис 3 19) повышается концентрация молекул пленкообразователя в зоне перекрывания, что приводит к осмотическому переносу растворителя из объема дисперсионной среды в межчастичное пространство, повышению давления в этой области и расклинивающему действию, т е расталкиванию частиц Энергия отталкивания в этом случае определяется соотношением
£/{?=1,25лС2В£Г (б-Л/2)2 (3r+26+h/2), (3 36)
где С — концентрация пленкообразователя в адсорбционно сольватном слое, 6 — толщина адсорбционно сольватного слоя, h — расстояние между поверхностями частиц, В — коэффициент, определяющий взаимодействие между растворителями и пленкообразователем
В «хорошем» растворителе В — величина положительная, в «плохом» — отрицательная Следовательно, в хороших растворителях и" положительна и адсорбционные слои отталкивают друг друга, а в плохих — притягивают Однако избыток очень хорошего растворителя может вызвать десорбцию пленкообразователя и снижение величин С и б.
Энтропийное и энтальпийное отталкивание вероятно только при соблюдении условия Л<26 В случае /i>26 значения USR и £/£ будут нулевыми, т е в разбавленных суспензиях и для низкомолекулярных пленкообразователей и ПАВ этот фактор не имеет места. Для большинства органорастворимых и водорастворимых красочных систем, содержащих неиоиогчжные ПАВ, при высоком ОСП этот механизм стабилизации
|
К’ *’* ■ V |
|
*• J Iй* ; *4‘; ’ |
|
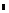 г J.
г J.
![]() Рис 3 20. Энергия взаимодействия частиц, с йД- сорбционно-сольватными слоями полимеров (молекулярная масса 6000, средняя длина молекул 5,4 нм, постоянная Гамакера Ю~20 Дж).
Рис 3 20. Энергия взаимодействия частиц, с йД- сорбционно-сольватными слоями полимеров (молекулярная масса 6000, средняя длина молекул 5,4 нм, постоянная Гамакера Ю~20 Дж).
|
|
|
|
|
|
|
![]()
 6 сентября, 2015
6 сентября, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 