Трихлорэтилен (ГОСТ 9976—62) СНС1 = СС12 <Ц20= 1,465; мол. вес. 131,399.
Физические свойства. Бесцветная жидкость с запахом, напоминающим запах хлороформа, ТПЛш —86,4° С 87,19° С; давление паров 58 мм рт. ст. (20°С); теплота парообразования 7,52 ккал/моль (ТКИП); теплоемкость при постоянном давлении Ср = 29,3 кал/моль (20°С); вязкость т] = 0,566 с-пуаз (25°С); дипольный момент ц, = 0,9.
Трихлорэтилен хорошо растворим в органических растворителях, плохо в воде. Так, например, в 100 г воды при температуре 25° С растворяется 0,11 г трихлорэтилена и, наоборот, при той же температуре в 100 г трихлорэтилена растворяется 0,032 г воды.
Трихлорэтилен образует азеотропные смеси с водой (5,4% воды), температура кипения такой смеси 73,6°С, а также с бензином, метиловым и этиловым спиртами, уксусной кислотой и др.
Химические свойства. Подобно хлороформу трихлорэтилен способен самопроизвольно окисляться (особенно при действии дневного света) с образованием окиси углерода (угарный газ), хлористого водорода и карбонилхлорида (фосген):
СНС1=СС12 + 02——— >■ СО + НС1 + СОС12
При температуре выше 110° С трихлорэтилен окисляется до хлорангидрида дихлоруксусной кислоты:
2СНС1=СС12 + 02——— 2СНС12=СОС1
Трихлорэтилен подвержен гидролизу, который проходит по следующим реакциям:
СНС1 = СС12 + НОН—— >■ НС1 + СН2С1 = СОС1
СНС1 = СС12 + НОН—— >- НС1 + СНС1 = СС1(ОП)
Гидролиз трихлорэтилена серной кислотой приводит к образованию монохлоруксусной кислоты:
H2so4
СНС1=СС12 + 2Н20 ———— >■ СН2С1-СООН + 2 НС1
С соляной кислотой трихлорэтилен не реагирует, но легко присоединяет хлор, образуя пентахлорэтан (пенталин):
СНС1=СС12 + С12——— >■ СНС12—СС13
Эта реакция сопровождается выделением тепла в количестве 44 ккал/г-моль. Трихлорэтилен реагирует с 90%-ной серной кислотой, а добавление к нему по каплям азотной кислоты приводит к образованию различных продуктов, среди которых хлорпикрин (трихлорнитрометан), СС1з—N02, который является очень ядовитым газом.
Трихлорэтилен устойчив к действию разбавленных щелочей и извести. При нагревании с крепкими щелочами переходит в гликолевую кислоту:
СНС1 = СС12 + 3 NaOH ——- СН2ОН—СООН + 3NaCl
При этом образуются также следы дихлорацетилена, СС1=СС1, который самопроизвольно воспламеняется,
Трихлорэтилен вступает также в ряд интересных реакций конденсации.
Так, например, при нагревании трихлорэтилена со смесью формальдегида и 80%-ной серной кислоты в присутствии спиртов образуются эфиры а-хлоракриловой кислоты:
H2so4
СНС1 = СС12 + н-с-н + ROH————— >-CH2=CClCOOR + 2 MCI
О
Молекулы трихлорэтилена могут вступать в реакцию взаимной конденсации, образуя гексахлорбутилен — полупродукт в производстве гексахлорбутадиена, применяющегося в качестве присадки к трансформаторным маслам:
Снс1=сс12 + снс1 = сс12————- >-сс12=сн-снс1—сс13
Гексахлорбутилен
Сс12=сн-снс1-сс13 t^oo-125" > сс1?=сн-сс1=сс12 + нс1
Пентахлорбутадиен
Сс12 = сн-сс1 = сс12 + с12————— >- сс13 — снс1—сс1=сс12
Гептохлордутилен
Сс13-снс1-сс1 = сс1о-т^о^сс12=сс1-сс1=сс12 + нс1
Гекс а хлор дут адиен
При нагревании в трубке трихлорэтилен образует гекса — хлорбензол:
С1 I
А
T С1-С С-С1 ЗСНС1=СС12 >- I II + 3HCI
А—с с—Ci С
I
С1
Способы получения. Существует много различных способов промышленного получения трихлорэтилена. Но основные способы состоят в дегидрохлорировании 1,1,2,2-тетрахлорэтана суспензией гидроокиси кальция или пиролизом [1] при температуре 400—600° С. Получающийся трихлорэтилен сравнительно мало загрязнен другими хлоруглеводородами.
Основным сырьем для получения трихлорэтилена служит ацетилен.
Процесс идет в две стадии:
СН = СН + 2 С12—— >~СНС12—СНС12
2СНС12—СН(Л2 + Са(ОН)2—— >-2СНС1 = СС1о + СаС12 + 2Н20
Технологический процесс получения трихлорэтилена заключается в следующем: при хорошем перемешивании в тетрахлор — этан при температуре 80° С вводят ацетилен, хлор и катализатор— хлорная сурьма (0,01%-ный раствор) или хлорное железо (см. схему на рис. 1). Хлор и ацетилен вводят в тетра — хлорэтан раздельно в объемном соотношении 2,05:2,00. Тетра — хлорэтан содержит примерно 0,1 вес. % хлорной сурьмы.
Хлор и ацетилен приводятся в тесное соприкосновение в смесителях 1, которые охлаждаются снаружи, чтобы избежать перегревов. Образовавшийся тетрахлорэтан отгоняется в колонне 2 от катализатора, который возвращается в смесители 1. После этого тетрахлорэтан поступает в обогреваемую колонну3 для дегидрохлорирования. Эта колонна снабжена тарелками или заполнена кольцами Рашига [2]. В колонну 3 сверху подают в избытке 10%-ный раствор гидроокиси кальция (известковое молоко).
Для лучшего соприкосновения паров тетрахлорэтана с известковым молоком в нижнюю часть колонны 3 вводят водяной пар. Образовавшийся трихлорэтилен и вода поступают в водоотделитель 4.
Вода отводится, а азеотропная смесь, содержащая 93% трихлорэтилена и 7% воды поступает в колонну 5, где трихлорэтилен отгоняется при температуре 77° С. У дна колонны 5 Поддерживается температура 102° С.
|
Возврат Дренам SBCl2 Рис. 1. Схема производства трихлорэтилена |
Получение трихлорэтилена пиролизом проводится обычно при температуре 600° С. Однако в присутствии ВаС12 отщепление хлористого водорода может протекать и при температуре 230—320° С.
T
CHC12— CHCU—— >■ СНС1 = СС12 + НС1
Трихлорэтилен можно получить также из 1,1,1,2-тетрахлор — этана. Тетрахлорэтан обычно с трудом реагирует со щелочами, но при температуре 600° С легко выделяет НС1.
T
CCI:1—СН2С1 —— ►СНС1 = СС12 + UC1
Для получения трихлорэтилена из ацетилена требуется четыре атома хлора на молекулу, а из этилена — шесть, поэтому последний метод применяется сравнительно редко. Хлорирование этилена проводится при температуре 300—500° С. Катализатором служит активированный уголь
СН2 = СН2 + С12—— >■ СН2С1 —CHoCl
СН2С1—CHoCl + 2С12 —- >- СНС1 = СС12 + ЗНС1
Образующаяся смесь содержит 90% трихлор — и тетрахлорэтан ей а.
Трихлорэтилен не действует на целлюлозные (исключая ацетатные) и белковые волокна.
Некоторые сорта ацетилцеллюлозы растворимы в трихлор- этилене, поэтому одежду из таких волокон необходимо обрабатывать при низкой температуре.
На красители трихлорэтилен не действует, за исключением дисперсных, которые легко смываются с ацетатных и полиамидных волокон. Трихлорэтилен растворяет фурнитуру из полисти — рольных пластмасс.
Трихлорэтилен огнебезопасен, оказывает наркотическое действие, пары его умеренно ядовиты, раздражают слизистую оболочку, вызывают тошноту, дерматит. Предельно допустимая концентрация паров трихлорэтилена в воздухе 0,05 мг/л.
Трихлорэтилен согласно ГОСТ 9976—62 выпускается двух марок — А и Б, плотность технического трихлорэтилена при температуре 20° С—1,461—1,466 г/см3; температурные пределы кипения при нормальном давлении 85—88° С.
Трихлорэтилен транспортируется и хранится в сухих, чистых герметичных оцинкованных цистернах, оцинкованных бочках или флягах, изготовленных из стали толщиной 1 —1,25 мм со сварными швами, или в бутылях из темного стекла, вставленных в деревянную обрешетку.
На таре с трихлорэтиленом должно быть нанесено изображение черепа и костей и сделана надпись «Яд!».
Трихлорэтилен хранят в крытых складских неотапливаемых помещениях в стальных оцинкованных бочках или в футерованных диабазовой плиткой емкостях, защищенных от воздействия прямых солнечных лучей. Срок хранения трихлорэтилена не более трех месяцев.
В качестве стабилизатора чаще всего применяют триэтил- амин, но можно применять и гексилрезорцин и бутилмер — каптан.
Как уже было сказано выше, трихлорэтилен под действием солнечного света может разлагаться с образованием хлористого водорода и фосгена. Наличие их в трихлорэтилене проверяют следующим образом: 0,1 г бензидина растворяют в 20 мл трихлорэтилена и раствор оставляют стоять на 24 ч без доступа воздуха. Образование мути указывает на наличие хлористого водорода, а выпадение желтого осадка — на наличие фосгена.
Если в трихлорэтилен попала вода, то его сушат перед дистилляцией обезвоженным Na2S04 или СаС12. Если трихлорэтилен сильно загрязнен маслами, жирами или моющими средствами (усилители), то он при дистилляции сильно вспенивается. Чтобы избежать этого, к нему следует прибавлять 1 % поваренной соли.
Весьма опасно допускать взаимодействие трихлорэтилена с едким натром или едким кали (см. уравнение реакции на стр. 10).
Трихлорэтилен содержит примесь стабилизатора, относящегося к классу алкиламинов, который в присутствии едких щелочей действует как катализатор.
Под действием катализатора трихлорэтилен разлагается с образованием хлорацетилена, который воспламеняется и, соприкасаясь с воздухом, может взорваться.
Трихлорэтилен применяют для общего обезжиривания одежды и для удаления жировых пятен, а также пятен воска, парафина, смолы, асфальта, каучука, серы, фосфора и многих других органических и неорганических соединений.
Первоначальный способ производства трихлорэтилена был запатентован в 1905 г.; в химической чистке его стали применять с 1920 г.
Перхлорэтилен (тетрахлорэтилен) СС12 = СС12 d420= 1,619; мол. вес. 165,848.
Бесцветная тяжелая малолетучая жидкость со слабым запахом эфира, Тпл —22,35° С; Ткип 121,2° С; давление паров 14,4 мм рт. ст. (20°С); теплота парообразования 8,3 ккал/моль (Ткип); теплоемкость при постоянном давлении Ср = = 35,8 кал/моль (20°С); вязкость rj = 0,798 с-пуаз (30°С); ди — польный момент равен нулю.
Перхлорэтилен хорошо растворим в органических растворителях, плохо в воде. Так, например, в 100 г воды при температуре 20° С растворяется 0,015 г перхлорэтилена и, наоборот, при той же температуре в 100 г перхлорэтилена растворяется 0,01 г воды.
Перхлорэтилен образует с водой азеотропную смесь, которая содержит 84,2% перхлорэтилена и кипит при температуре 87,7° С.
Перхлорэтилен смешивается со спиртами, бензином, бензолом, хлороформом и др.
Перхлорэтилен более устойчив, чем трихлорэтилен. Однако на воздухе под действием света (особенно дневного) перхлор — этилен медленно реагирует с кислородом, разлагаясь на фосген и трихлоруксусную кислоту.
ЗСС12 = СС12 + 2 Н20 + 202——- > 2НС1 + 2СОС12 + 2СС13~СООН
Сухой кислород на солнечном свету или серный ангидрид могут окислить перхлорэтилен до хлорангидрида трихлоруксус — ной кислоты
СС13 —СОС1
Перхлорэтилен менее подвержен гидролизу, чем трихлорэтилен, поэтому с ним безопасно применять мыла и моющие сродства, содержащие влагу.
Перхлорэтилен присоединяет хлор, образуя гексахлорэтан:
Cci2=ccio + С12—>■ ес13—cci3
Будучи устойчив по отношению к щелочам, перхлорэтилен реагирует с крепкими серной и азотной кислотами.
По отношению к металлам перхлорэтилен малоактивен. Перхлорэтилен получают различными способами, но наиболее распространенным является многостадийный синтез из ацетилена.
Вначале к ацетилену присоединяют две молекулы хлора, при этом образуется симметричный тетрахлорэтан; затем при дехлорировании тетрахлорэтана с цинковой пылью получают симметричный дихлорэтилен, при дегидрохлорировании которого гидратом окиси кальция получают трихлорэтилен. Трихлорэтилен хлорируют и получают пентахлорэтан, при дегидрохлорировании которого гидратом окиси кальция получают перхлорэтилен. Схематично этот процесс можно представить так:
Zn Ca(OHb;CI.
СН=СН + 2 С12—- >- CHCI2-CHCI2 _ >-СНС1=СНС1—————- >
CUMM. ~ CUMM-
Тетрахлорэтан дихлорэтилен CI, Са(ОН)2 —> СНС1 = СС12—СНС12 — СС13 ►СС12 = СС1,
Трихлорэтилен пентахлорэтан перхлорэтилен
Существует и более короткая схема получения перхлорэти — лена из ацетилена:
СНн=СН + 2С12—— >■ СНС12—СНС12
2СНС12 — СНС12 + СаО—— > 2СНС1 = СС12 + CaCU + Н20
СНС1 = СС12 + Cl2—— СНС12-СС13
2СНС12—СС1з + СаО——— >■ 2СС12=СС12 + СаС12 + НаО
Последняя реакция протекает при температуре 110°С и давлении 200 мм рт. ст.
Имеет промышленное значение получение перхлорэтилена пиролизом из четыреххлористого углерода (без доступа воздуха) или тетрахлорэтана.
2CClj—СС12 = СС!2 + 2С1„ t
СНС12—СНС12 + С12— ^СС12 = СС12 + 2НС1
Легко получить перхлорэтилен, нагревая гексахлорэтан в присутствии хлористого алюминия:
AlClj
СС13—СС13—-—СС12 = СС12 + С12
С хорошим выходом можно получить перхлорэтилен путем хлорирования хлористого винила в присутствии четыреххлори — yi-CToro углерода при температуре 800°С:
V)
Ссь,
СН2 = СНС1 + ЗС12— СС12 = СС12 + 3HCI
^ t = 8оо°
При непрерывном пропускании через реактор смеси хлористого винила, хлора и четыреххлористого углерода (в молярном отношении 1:4,57:0,58) перхлорэтилен является основным продуктом реакции.
Подобно трихлорэтилену перхлорэтилен можно получить, хлорируя этилен:
СН2 = СН2 + С12—— >~ СН2С1-СНоС1
СН2С1-СНоС1 + ЗС1о— >- СС12 = СС12 f 4HCI
Хлорируя пропилен, можно также получить перхлорэтилен:
СН2=СН—СН3 + 7 С12——- >■ СС12=СС12 + СС14 + 6НС1
2 Заказ № 22i7 ‘ Уяраннскии Ияучн*’
:тит/Г
§К» Л ‘A 1) Т.£ К &
Процесс некаталитический, идет при температуре около 500° С без избытка хлора, чтобы не способствовать образованию побочных реакций присоединения.
СС12=СС12 + С1г — >- CCI3- — СС1з
Недостаток этого способа — большой расход хлора, который уходит в виде хлористого водорода, преимущество — получение вместе с перхлорэтиленом и другого ценного растворителя — четыреххлористого углерода.
Перхлорэтилен можно получить и хлорируя насыщенные углеводороды, например пропан:
С3Н5 + 8С12 —-—СС12 = СС12 + СС14 + 8НС1
Эта реакция проводится при высоких температурах в расплавленной солевой бане.
По сравнению с трихлорэтиленом перхлорэтилен менее активен как растворитель. Поэтому он гораздо слабее действует на ацетатные вещи и фурнитуру. При обработке в перхлорэтилене изделий из натуральной шерсти в них сохраняются естественные жиры, присущие шерсти, одежда после чистки имеет мягкий гриф.
Перхлорэтилен неогнеопасен, оказывает наркотическое действие.
Из всех растворителей, относящихся к группе хлорированных углеводородов, перхлорэтилен наименее токсичен. Предельно допустимая концентрация его паров в воздухе 0,02 мг/л.
Перхлорэтилен транспортируется и хранится в стальных оцинкованных бочках или в бутылях из темного стекла, вставленных в деревянную обрешетку. Как уже было сказано выше, перхлорэтилен хотя и медленно, но окисляется до фосгена и трихлоруксусной кислоты. Ингибиторами этого разложения служат небольшие добавки этанола и эфира.
Если перхлорэтилен загрязнен или имеет кислую реакцию, к нему следует добавлять для связывания кислоты примерно 1 % известкового молока (гашеной извести).
Не следует для этой цели пользоваться содой и особенно каустиком (едкий натр), так как при известных условиях может образоваться хлорацетилен, который самопроизвольно
Взрывается. Аналогично действует на перхлорэтилен и попадание в него небольших количеств порошкообразного алюминия.
В химической чистке перхлорэтилен впервые стали применять в 1935 г. В настоящее время перхлорэтилен является одним из основных растворителей, применяемых для общего обезжиривания одежды.
В 1954 г. в США было выпущено 150 тыс. т трихлорэтилена, из которых 90—93% пошло на обезжиривание металлических изделий и только 5% для химической чистки. Производство перхлорэтилена составило 75 тыс. т, из них 80% было использовано для химической чистки. Перхлорэтилен является превосходным растворителем жиров, масел, восков, парафина, асфальта, серы и т. д.
Дихлорэтилен (ацетилендихлорид) СНС1=СНС1, мол. вес. 96,95.
Дихлорэтилен представляет собой прозрачную (со временем желтеющую) жидкость со слабым запахом, напоминающим хлороформ. Существует в виде двух геометрически изомерных форм
Трансдихлорэтилен
Н —С—С1
II
Ci—с—н
Wi‘c
!,гб5
По химическим свойствам дихлорэтилен напоминает трихлорэтилен. Так, он присоединяет хлор и превращается в тетрахлорэтан
СНС1 = СНС1 + С12—— СНС12-СНС1о
Обычно дихлорэтилен является весьма стойким соединением, но в соответствующих условиях (при действии растворов щелочей), он отщепляет, соляную кислоту и переходит в хлорацети — лен CHsCCl, который при перегонке может дать взрыв.
|
Цисдихлорэтилен Н-с— С1 |
|
Н—С—С1 IT 60.3В-С Ц !,№ |
Дихлорэтилен получается из тетрахлорэтана при нагревании с влажной цинковой пылью или железными стружками при температуре 100° С:
|
19 |
СНС12—СНС12 + Zn 1 > СНС1=СНС1 + ZnCl2
2*
Его можно получить также и непосредственно, хлорируя ацетилен при температуре 40°С. Для этой реакции предлагались различные катализаторы — хлорная медь, никель, осажденный на активированном угле и другие
СН= СН + С12————- >-СНС1=СНС1
Дихлорэтилен на металлы не действует. По своим свойствам как растворитель дихлорэтилен очень близок к три — и перхлор — этилену.
Он может заменить также серный эфир и ацетон.
Дихлорэтилен практически не горит, но горячие пары его воспламеняются. Дихлорэтилен является наркотическим веществом, его пары раздражают слизистую оболочку глаз и носа, могут вызвать головокружение.
Максимально допустимая концентрация дихлорэтилена в воздухе составляет 0,01 мг]л.
Дихлорэтилен, поступающий в продажу, обычно представляет собой смесь цис- и транс-Изомеров, которая кипит при 55° С.
Дихлорэтилен хорошо растворяет каучук. Кроме того, его применяют для удаления пятен масел, жиров, смол, олифы, лака и масляных красок.
Дихлорэтан (1,2-дихлорэтан, хлористый этилен). СН2С1—СН2С1 (ГОСТ 1942—63); d4,8 = 1,260; мол. вес. 98,97.
Прозрачная бесцветная или желтоватая жидкость без осадка и взвешенных частиц, с сильным запахом, напоминающим хлороформ; Гкип 83,483°С; Тцл — 35,87°С; Твосая 21,1°С. В воде не растворяется, с большинством органических растворителей смешивается в любых соотношениях (спирты, ацетон, эфиры).
При нагревании с водой, раствором соды или суспензией гашеной извести дихлорэтан образует этиленгликоль
150-200°
СН, С1-СН2С1 + 2НгО ————- СН2ОН—СН2ОН + 2НС1
При действии щелочи или пиролизе (^=600°С) дихлорэтан образует хлористый винил:
CHgCl-CHgCl + NaOH——- >-СНг = СНС1 t NaCl + НгО
При нагревании с аммиаком дихлорэтан переходит в этилен — диамин:
СН2С1— СН2С1 + 2NH3 ► NH2CH2 — CH2NH2 + 2НС1
СН2С1—СН2С1 -1- 4NH3 NH2CH2— CH2NH2 + 2NH4C1
С бензолом в присутствии хлористого алюминия дихлорэтан образует дибензил:
2 + сн2С1~СН2С1 —— ► QCH2-CH2-^3 + 2НС1
При нагревании дихлорэтана с растворами полисульфидов натрия образуется каучукоподобное вещество — тиокол
ЯСН2С1 —СН2С1 + NNa2S4
— S-S—— + 2я NCI
II II
|
* — С Н2 — С Hg |
|
S — S — С Но—сн? II II S S |
S S
Дихлорэтан был открыт в 1795 г. Однако промышленное производство дихлорэтана было начато только в 1923 г.
Дихлорэтан получают хлорированием этилена в трубчатом реакторе а присутствии катализаторов А1С13 или FeCl3
Сн2=сн2 + CU———— >~ CHoCl—CHoCl,
Побочно получается также и трихлорэтан.
В качестве исходного сырья для производства дихлорэтана применяют отходящие газы крекинга нефти, коксохимического производства, пиролиза керосина, содержащие этилен.
Дихлорэтан растворяет ацетатные волокна. Он является сильным наркотическим средством, вдыхание его паров и прием внутрь может вызвать отравление, поражение печени. Предельная допустимая концентрация паров в воздухе — 0,01 мг/л.
Дихлорэтан является продуктом, стоящим на грани между воспламеняемыми и невоспламеняемыми жидкостями. Он с трудом загорается, горит коптящим пламенем и легко гасится водой в начальный период горения благодаря своему удельному весу, превышающему удельный вес воды.
При интенсивном горении дихлорэтана тушение водой может вызвать взрыв вследствие образования при высокой температуре водяного газа (СО + Н2).
Пределы взрывчатости в воздухе 6,2—15,9 об.%.
Технический дихлорэтан согласно ГОСТ 1942—63 выпускается двух марок А и Б.
Дихлорэтан имеет плотность при температуре 20°С и давлении 760 мм рт. ст. в пределах: марки А 1,2545— 1,2565; марки Б 1,249— 1,258.
Температура кипения колеблется в пределах, °С: марки А 82,5 — 84,0; марки Б 81,0 — 86,0.
Дихлорэтан перевозят в герметично закрытых железнодорожных цистернах, стальных бочках или стеклянных бутылях. Тару заполняют дихлорэтаном на 90±3% объема. Бутыли с дихлорэтаном помещают в обрешетку или корзины и уплотняют древесной стружкой.
На таре, в которой перевозится или хранится дихлорэтан, должна быть надпись «Яд!».
Хранить дихлорэтан следует в сухом темном помещении.
Применяется дихлорэтан для выведения пятен жирового происхождения, естественных смол, каучука, серы, йода, асфальта, канифоли и др.
Хлороформ (трихлорметан) СНС13 (ГОСТ 1539—64); d420 = 1,488; мол. вес. 119,389.
Бесцветная прозрачная легколетучая жидкость с характерным, приторно-сладким запахом, Ткип. 61,15° С; Тпл- —63,55°С. В воде хлороформ практически не растворяется. Растворяется в большинстве органических, растворителей (спирт и эфир этиловый, ацетон, бензол и др., за исключением глицерина).
Хлороформ на свету медленно окисляется кислородом воздуха
2СНС13 + 02 ———- >- 2 COClo + 2 НС1
Пли
СНС13 + 02 ——— > НС! + С02 + С12
При добавлении к хлороформу разбавленных щелочей хлороформ гидролизуется:
СНС1а 4- 4 NaOH—- >- HCOONu + 3N;iCI + 2НгО,
Обработка смеси хлороформа с первичным амином спиртовым раствором щелочи приводит к образованию изо-нитрилов, органических производных синильной кислоты:
RNH2 + СНС1з——— >- R-C = N + ЗНС1
Хлороформ получают последовательным хлорированием метана на свету
СН4 + С12—— >- CH3CI + I1CI
СН3С1 + Cl2—— >-СН2С12 + HCI
СН2С12 + С12—— > СНС13 +. HCI
А также при действии гипохлорита кальция на этиловый спирт, уксусный альдегид или ацетон:
2 CII3CH0OH + 4 Са(ОС1)2——- 2СС1;,—СОН + ЗСа(ОН)2 +
Мораль + 2НгО + СаС12
2СС13 —СОН + Са(ОН)2——— >■ 2СНС13 + (НСОО)2Са
2СН3-СО-СН3 + ЗСа(ОС1)2———— > 2СНС13 + 2Са(ОН)2 +
|
А при добавлении концентрированных щелочей разлагается по реакции: |
|
СНС1;, + 3NaOH——- > 3NaCl + СО + 2Н-Ю |
|
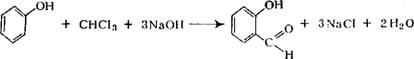
При взаимодействии хлороформа с фенолом в присутствии щелочи образуется оксиальдегид: |
|
|
+ (СН3СОО)2Са
На текстильные волокна хлороформ не действует (за исключением ацетатных) и не смывает красители (за исключением дисперсных).
Хлороформ негорюч и не образует взрывоопасных смесей с воздухом. Он обладает сильным наркотическим действием, при вдыхании может вызвать потерю сознания и нарушение обмена веществ, токсически действует на внутренние органы, особенно на печень. Предельно допустимая концентрация хлороформа в воздухе — 0,01 мг/л. Технический хлороформ выпускается согласно ГОСТ 1539—64 трех марок А, Б и В.
Плотность при температуре 20° С, не менее:
Марка А…………… Не нормируется
» Б……………… 1,470
» В……………… 1,478
Температура кипения в пределах, °С:
Марка А… . 60,9—61,2
» Б……………… Не нормируется
» В……………… 59,5—62,5
В качестве стабилизатора в технический хлороформ добавляют 0,5—1% этилового спирта.
Технический хлороформ транспортируют в стальных бочках емкостью 100—250 л, испытанных на избыточное давление 1 кГ/см2.
Хранить хлороформ необходимо в плотно закрытой таре, в прохладном сухом и темном месте.
Хлороформ является одним из лучших растворителей жиров, застарелых пятен масляной краски, смол, лаков, каучука, сургуча, а также пятен фармацевтических мазей и косметических кремов.
Четыреххлористый углерод (тетрахлорметан, перхлорметан) СС14 (ГОСТ 4—65); d? = 1,593; мол. вес 153,84.
Бесцветная, легколетучая, негорючая жидкость с запахом, напоминающим хлороформ; Гцип 76,79° С; ТпЛ —22,87° С.
Не растворим в воде, растворим в органических растворителях (ацетоне, спирте, бензоле, сероуглероде, этиловом эфире, скипидаре).
В обычных условиях четыреххлористый углерод химически инертен, он устойчив к действию света, воздуха, концентрированной серной кислоты и других реагентов. Однако в присутствии железа или алюминия гидролизуется:
ССЦ + 2Н20 ~ ► С02 + 4НС1
Со спиртами четыреххлористый углерод образует в присутствии щелочи ортоугольные эфиры:
СС14 + 4С2Н5ОН + 4NaOH——— >-С(ОС2Н5)4 + 4NaCI + 4Н20
Четыреххлористый углерод получают так же, как и хлороформ, хлорированием метана, этана, пропана и других углеводородов при их одновременном расщеплении.
Кроме того, четыреххлористый углерод получают при хлорировании сероуглерода в присутствии хлористого алюминия, пятихлористой сурьмы или йода.
CS2 + ЗС12— ► СС14 + S2C12
2S2C12 + CS2 ГеЬ > СС14 + 6S
Четыреххлористый углерод не влияет на прочность волокон, за исключением ацетатных, которые незначительно разрушаются. Он растворяет полистирольную фурнитуру, не смывает красители, за исключением дисперсных.
Четыреххлористый углерод огнебезопасен, он обладает меньшим наркотическим действием, чем хлороформ, но по токсичности превосходит его, вызывая тяжелые поражения печени и почек.
Из всех органических растворителей, применяемых в химической чистке одежды, четыреххлористый углерод наиболее токсичен. Предельно допустимая концентрация его паров в воздухе не должна превышать 0,02 мг/л. Технический четыреххлористый углерод выпускается двух марок: А и Б.
Плотность при температуре 20°С в пределах:
Марка А…………………… 1,593—1,596
» Б……………………… 1,591—1,597
Температура кипения в пределах, °С:
Марка А…………………… 76,2—77,2
» Б……………………… 75,5—77,5
Четыреххлористый углерод транспортируют в железнодорожных цистернах, стальных бочках емкостью по 100—250 л, А также в стеклянных бутылях. Заполнение тары не должно превышать 90±3% ее вместимости.
На боковой поверхности цистерн, бочек и бутылей с четы — реххлористым углеродом должна быть сделана надпись «Яд!». Хранить четыреххлористый углерод следует в крытых складских
Неотапливаемых помещениях, защищенных от воздействия прямых солнечных лучей и влаги.
Четыреххлористый углерод хорошо растворяет жиры, масла, лаки, смолы и т. д. С водными растворами ализаринового масла образует растворимые в воде моющие средства, обладающие хорошим обезжиривающим действием и высокой стойкостью.
Для удаления пятен четыреххлористый углерод целесообразно применять в смеси с бензолом, ацетоном и хлороформом.
 19 ноября, 2012
19 ноября, 2012  admin
admin 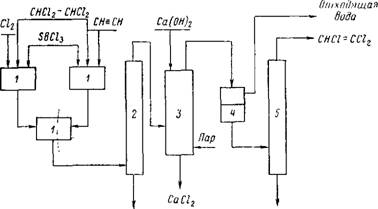
 Опубликовано в рубрике
Опубликовано в рубрике 