Растворы высокомолекулярных веществ, равно как и лиозоли, в известных условиях теряют свою текучесть, т. е. переходят в студни. Застудневание может происходить спонтанно (самопроизвольно), в результате изменения температуры, при концентрировании раствора или при добавлении к нему не слишком больших количеств электролита. Как правило, под действием этих факторов структурная вязкость системы возрастает, что приводит к превращению жидкости в студень — систему, проявляющую ряд свойств твердого тела.
Студни и процесс застудневания имеют большое значение в медицине и биологии, так как из студней в основном состоит орга-
Низм животных и растений. Большое значение имеет застудневание растворов высокомолекулярных веществ и в технике. Образование клеевого слоя при склеивании, желатинирование пироксилина, получение искусственного волокна представляют собой не что иное, как процессы застудневания. С застудневанием связан также ряд процессов в пищевой и хлебопекарной промышленности. Студнем является голье, лишенная волосяного покрова и специально подготовленная животная шкура, из которой получается кожа при дублении.
Застудневание
Причина застудневания состоит в возникновении связей между молекулами высокомолекулярного вещества, которые в растворе представляли собою кинетические отдельности. Между молекулами полимера в растворе могут образовываться кратковременные связи, приводящие к возникновению ассоциатов. Однако если средний период существования связей между макромолекулами становится очень большим (практически бесконечным), то ассоциаты не будут распадаться и возникшие образования проявляют в некоторой степени свойства твердой фазы. Постоянные связи между молекулами в растворах высокомолекулярных веществ могут образовываться в результате взаимодействия полярных групп макромолекул или ионизированных ионогенных групп, несущих электрический заряд различного знака, и, наконец, между макромолекулами могут возникать химические связи (например, при вулканизации каучука в растворе). Таким образом, застудневание есть не что иное, "как процесс появления и постепенного упрочнения в застудневающей системе пространственной сетки. При этом для застудневания растворов высокомблекулярных веществ характерно, что связи образуются не по концам кинетических отдельностей, как это происходит при переходе в гель лиозолей с удлиненными жесткими частицами, а могут возникать между любыми участками гибких макромолекул, лишь бы на них имелись группы, которые могут взаимодействовать друг с другом.
Очень часто при образовании студня наблюдается упорядочение отдельных участков молекул, взаимодействующих друг с другом. Эти участки обычно ориентируются параллельно друг другу, так как такая’ориентировка способствует уменьшению свободной энергии системы. При этом степень ориентации зависит как от природы высокомолекулярного вещества, так и от условий студне- образования. На рис. XIV, 17 схематически показаны различные типы ориентации участков макромолекул в студне, расположенные в порядке увеличения их прочности.
Существует непрерывный переход от простейших точечных контактов макромолекул друг с другом к кристаллитам, т. е. областям с упорядоченной кристаллической структурой. Поскольку в одном и том же студне контакты могут иметь самый различный характер, целесообразно пользоваться понятием о спектре моле
кулярных контактов для данного студня. Этот спектр может быть представлен кривой распределения, характеризующей фракционный состав контактов либо по их прочности, либо по их размеру.
Весьма вероятно, что структурными единицами пространственной сетки студней могут являться не только отдельные молекулы, но и их пачки. К сожалению, этот вопрос остается до сих пор совершенно не исследованным.
Если образовавшиеся между макромолекулами связи не слиш—N Ком прочны, то механическое воздействие (перемешивание или встряхивание) может разрушить структуру и студень (так же, как и коллоидный гель) превращается в жидкость. При устранении внешнего воздействия полученные растворы обычно снова самопроизвольно застудневают. Однако когда соединение молекул
|
Рнс. XIV, 17. Типы контактов макромолекул в студне (расположенные в порядке увеличения их прочности). |
В одну сплошную пространственную сетку обусловлено возникновением химических связей, сильные механические воздействия вызывают необратимое разрушение студня.
Повышение температуры, если только при этом в системе ие происходит необратимых химических изменений, обычно препятствует застудневанию из-за возрастания интенсивности микроброуновского движения сегментов и уменьшения вследствие этого числа и длительности существования связей, возникающих между макромолекулами. Наоборот, понижение температуры, как правило, способствует застудневанию, так как при этом спектр контактов между макромолекулами расширяется и сдвигается в сторону большей прочности. Следует заметить, что переход раствора в студень, равно как и студня в раствор, с изменением температуры совершается непрерывно, т. е. в этом случае не существует температур, подобных температурам кристаллизации или плавления.
Иногда нагревание способствует застудневанию и, наоборот, охлаждение приводит к разжижению системы. Подобное явление, наблюдающееся, например, для метилцеллюлозы в воде и нитрата целлюлозы в спирте, связано с отрицательным температурным коэффициентом растворимости высокомолекулярного вещества в данном растворителе.
Застудневанию растворов высокомолекулярных веществ всегда способствует повышение концентрации, так как при этом возрастает частота столкновений между макромолекулами или их участками и увеличивается число связей, образующихся в единице объема студня. Однако благодаря вытянутой форме макромолекул застудневание может происходить и в очень разбавленных растворах. Так, при обычной температуре раствор агара застудневает уже рри содержании в нем 0,2% сухого вещества.
Чем выше концентрация, тем выше температура, при которой растворы высокомолекулярных веществ переходят в студни. Например, достаточно концентрированные (30—45%-ные) растворы желатина способны застудневать уже при температуре около 30 °С, более разбавленные (10%-ный) растворы переходят в студень при температуре около 22 °С. Растворы агара застудневают при еще более высоких температурах, и студни при этом получаются более прочными, чем студни желатина. Наоборот, растворы каучука застудневают только при температурах, лежащих значительно ниже нуля. Так, 3%-ный раствор натурального каучука переходит в студень при температуре —41 °С. Плохое застудневание растворов каучука объясняется, конечно, отсутствием в его молекулах полярных групп, способных, вступая друг с другом в контакт, образовы — ‘ вать достаточно прочную связь.
Объем системы при застудневании обычно уменьшается. Впрочем, при застудневании раствора кремневой кислоты наблюдается увеличение объема системы. Это увеличение, протекающее параллельно с полимеризацией кремневой кислоты, объясняется выделением воды, которая ранее была химически связана с БЮг.
В отдельных случаях застудневание сопровождается выделением тепла. Это может быть объяснено образованием кристаллитов и выделением теплоты кристаллизации. Однако при застудневании растворов высокомолекулярных веществ кривые охлаждения не претерпевают резкого скачка, так как процесс кристаллизации как бы размыт из-за неодновременного образования кристаллитов.
На способность к застудневанию водных растворов амфотерных высокомолекулярных электролитов, например белков, весьма сильно влияет рН раствора. Застудневание лучше всего идет при значении рН, отвечающем изоэлектрической точке, так как при этом по всей длине молекулярной цепи расположено одинаковое число противоположно заряженных ионизированных групп, что способствует установлению связи между отдельными макромолекулами. С изменением рН (в обе стороны от изоэлектрической точки)’ макромолекулы приобретают одноименный заряд, что препятствует образованию между ними связи. При добавлении больших количеств кислоты или щелочи степень ионизации ионогенных групп уменьшается и тенденция к застудневанию снова увеличивается. Короче говоря, — способность к застудневанию у растворов белков при изменении рН изменяется по седлообразной кривой, как и другие свойства.
Действие низкомолекулярных нейтральных электролитов на застудневание растворов белков прямо противоположно действию
Этих электролитов на набухание. Ионы, увеличивающие набухание, замедляют застудневание или делают его вообще невозможным. Наоборот, ионы, уменьшающие объем набухшего студня, способствуют застудневанию. Как и на набухание, на застудневание в основном влияют анионы.
Помимо образования связей между молекулами в известных условиях могут возникать связи и между участками одной и той же макромолекулы, если она имеет несколько групп, способных взаимодействовать, и молекулярная цепочка настолько гибка, что отдельные части ее в результате теплового движения могут вступать в контакт. При этом образуются так называемые глобулярные или корпускулярные студни (В. А. Каргин и П. И. Зубов).
Образование глобулярных студней, у которых каждая глобула состоит только из одной макромолекулы, является предельным случаем. Глобулярные студни могут образовываться в определенных условиях и в результате ассоциации двух и более молекул полимера.
Следует отметить, что глобулярные студни можно называть студнями только условно, так как они способны течь. Благодаря тому, что макромолекулы в этом случае свернуты в плотный клубок и участки их не могут совершать микроброуновского движения, вязкость таких систем обычно даже меньше, чем растворов соответствующей концентрации, в которых макромолекулы образуют рыхлые клубки.
Примером глобулярных студней могут служить системы, которые получаются из 0,1%-ных растворов нитрата целлюлозы в ацетоне при добавлении к ним воды. При выпаривании таких растворов под вакуумом могут быть получены устойчивые студни, содержащие до 2% сухого остатка. Эти системы обладают рядом коллоидных свойств: обнаруживают способность к опалесценции, с помощью ультрамикроскопа в них можно определить численную концентрацию, при добавлении к ним электролитов они подчиняются правилу Шульце — Гарди, при достаточном разбавлении системы водой резко возрастает электрокинетический потенциал их частиц и резко падает вязкость системы.
Другим примером глобулярных студней может служить раствор желатина, приготовленный в строго определенных условиях. При охлаждении достаточно концентрированного раствора желатина ниже температурного интервала «плавления» студня в результате образования межмолекулярных связей получается обычный, нетекучий студень. Однако если охлаждать сильно разбавленный раствор желатина, в котором молекулы удалены друг от друга и вследствие этого возникают, главным образом, внутримолекулярные связи, то раствор остается текучим. Если осторожно сконцентрировать такой раствор, не нагревая его выше температурного интервала «плавления» студня, то получается глобулярный студень, остающийся текучим при тех концентрациях и температурах, которые отвечают существованию обычного студня. Если эту систему затем нагреть, то в результате увеличения интенсивности микроброуновского движения связи, возникшие между отдельными участками молекулы, разрушаются и глобулярный студень переходит в обычный вязкий раствор желатина, который при охлаждении дает уже нормальный нетекучий студень. Таким образом, переход глобулярного студня в обычный является обратимым процессом.
Аналогичные системы, вероятно, образуются при охлаждении раствора желатина при интенсивном перемешивании. Бунгенберг де йонг еще в 1932 г. показал, что в этих условиях образуется не студень, а раствор, содержащий мельчайшие частицы желатина, способные медленно седиментировать. Возможно, что эти частицы являются не чем иным, как свернутыми в плотный клубок молекулами желатина.
Глобулярные студни могут существовать весьма долго, т. е. оци являются практически устойчивыми системами. Таким образом, возможно существование и неравновесных растворов высокомолекулярных веществ. Последнее объясняет тот известный факт, что различно приготовленные растворы высокомолекулярных соединений одной и той же концентрации часто обладают разными свойствами — вязкостью, осмотическим давлением и’т. д.
Из всего сказанного о глобулярных студнях ясно, что оии по своим свойствам являются промежуточными системами между растворами полимеров и коллоидными растворами.
Свойства студией
Наиболее интересными особенностями обычных студней являются их механические свойства, в частности эластичность.
Растворы высокомолекулярных веществ, в которых межмолекулярные связи чрезвычайно непрочны, способны течь, т. е^ реагируют даже на очень слабые сдвиговые усилия. Однако если время существования хотя бы части контактов между макромолекулами становится очень большим, образовавшийся студень уже способен противостоять течению вплоть до какого-то определенного значения напряжения сдвига и ведет себя при сдвиговых усилиях ниже этого критического значения, как эластическое твердое тело. Значение критического напряжения сдвига зависит от числа и прочности молекулярных контактов.
На механические свойства студней сильно влияет их концентрация. Студни, содержащие в единице объема малое число постоянных межмолекулярных связей, обычно весьма эластичны, Наоборот, студни с большим числом связей между макромолекулами сравнительно мало эластичны, так как чем больше связей между цепями полимера, тем меньше возможность изменения формы макромолекулы, тем более жестка образовавшаяся сетка.
Ниже приведены значения критического напряжения сдвига раствора различных концентраций типичного высокомолекулярного вещества — агара:
Концентрация агара, %……………………… 0,05 0,06 0,08 0,10 0,20 0,40
Критическое напряжение сдвига, гс/см2 … 0,004 0,036 0,32 1,23 27 525
Можно видеть, что критические напряжения весьма быстро увеличиваются с концентрацией, и уже при очень малом содержании агара в растворе система проявляет свойства студня, т. е. система нетекуча.
При температуре выше тех температур, при которых происходит «плавление» студня, ни разбавленные, ни концентрированные студни не обнаруживают критического напряжения сдвига. Неза — студневающие растворы, например растворы нитрата целлюлозы в ацетоне, не обнаруживают критического напряжения сдвига ни при каких концентрациях. Они текут при самых малых напряжениях сдвига, хотя это течение вследствие высокой вязкости растворов и происходит весьма медленно.
Релаксационные процессы в студнях обычно протекают с большей скоростью, чем в растворах полимеров, так как в студнях могут перемещаться только отдельные, сравнительно короткие отрезки цепей. Поэтому студни обладают всегда более ярко выраженной эластичностью, чем структурированные растворы.
Некоторые студни полимеров обладают явно выраженными тиксотропными свойствами. У таких студней прочность связей между макромолекулами должна быть достаточно малая, чтобы они могли легко разрушаться под действием приложенного усилия сдвига. Кроме того, у подобных студней должен быть достаточно узкий спектр молекулярных контактов. Студни, у которых этот спектр размыт, обычно не проявляют тиксотропии. В самом деле, когда связность структуры нарушается путем механического воздействия, при узком спектре молекулярных контактов большинство связей разрушается и затем восстанавливается при стоянии системы. Это и составляет сущность явления тиксотропии. Если же спектр контактов широкий, разрушается только небольшое-число связей, обладающих наименьшей прочностью. Система распадается на большие куски, которые не могут соединиться и образовать структуру с первоначальным значением критического напряжения сдвига.
Поскольку макромолекулярные системы обычно обладают широкими спектрами молекулярных контактов, то тиксотропия проявляется только при особых условиях, способствующих сужению спектра, например, при значительном разбавлении или в начальной стадии студнеобразования, когда не наступило еще образования. структур из ориентированных участков макромолекул.
К, своеобразным свойствам студней следует отнести их «память» к тому,, как они были получены. Например, если высушить при низкой температуре до одного и того же содержания влаги два студня, из которых один получен из разбавленного, а другой из концентрированного раствора желатина, и затем дать этим подсушенным студням снова набухнуть в воде, то первый студень набухает гораздо больше, чем второй. Причина этого заключается в том, что при высушивании до известной степени в студнях сохраняется внутренняя структура, возникшая при их образовании.
Во многих случаях студни обладают большой способностью рассеивать свет. Это можно объяснить образованием в студне кристаллитов или межмолекулярных контактов с большой площадью. Наличие в студнях высокомолекулярных веществ кристаллитов можно также доказать тем, что рентгенограммы таких студней указывают на присутствие в них кристаллов.
Интересные особенности наблюдаются при диффузии в студни низкомолекулярных веществ и частиц коллоидной степени дисперсности. Так как не слишком концентрированные студни представляют собой трехмерные сетки со сравнительно большими петлями, диффузия в них малых молекул или ионов идет практически с той же скоростью, что и в чистой среде, если только диффундирующее вещество не способно взаимодействовать с высокомолекулярным веществом студня. Диффузией в студень, а не в жидкость иногда пользуются при определении коэффициента диффузии для того, чтобы исключить влияние конвективных потоков или сотрясений.
Низкодисперсные системы не обладают способностью диффундировать в студни, так как частицы не могут проникнуть в петли молекулярной сетки, если размер их больше размера петель. В этом случае складываются такие же условия, как и при ультрафильтрации. Сходство еще более увеличивается благодаря тому, что полупроницаемые мембраны обычно являются типичными студнями.
Высокодисперсные коллоидные системы, а также растворы высокомолекулярных веществ с неслишком большими молекулами диффундируют в студни с различной скоростью, зависящей от размера диффундирующих кинетических отдельностей и частоты молекулярной сетки студня.
Диффузия в студни имеет место при крашении и дублении, так как набухшее волокно и голье являются типичными студнями.
Весьма своеобразные явления наблюдаются, если в студень, содержащий какое-нибудь низкомолекулярное вещество, диффундирует другое вещество, способное с низкомолекулярным веществом образовывать нерастворимое соединение. В этом случае, как установил Лизеганг еще в прошлом столетии, реакция осаждения часто идет только в определенных зонах системы, чередующихся с зонами, в которых осадка не образуется вовсе (образование «ритмических осадков»).В результате получаются слои, если диффузия идет в глубь студня, или кольца, если диффузия начинается в центре поверхности студня и продолжается параллельно последней.
Роль самого студня при образовании таких «ритмических осадков», очевидно, сводится к предупреждению образования в системе конвективных потоков. Это подтверждается тем, что «ритмические осадки» могут возникать и при диффузии низкомолекулярного вещества в порошки, пропитанные раствором другого низкомолекулярного вещества, способного давать осадок с первым.
Несмотря на множество работ, посвященных изучению слоев и колец Лизеганга, причина их образования еще не совсем ясна. Следует отметить, что слои и кольца Лизенганга очень часто встречаются в природе. Так, полосатость или слоистость описанного выше характера можно наблюдать у некоторых минералов (агаты), у мускульной ткани (поперечно-полосатые мышцы).
Электропроводность студней близка к электропроводности растворов, из которых эти студни были получены, несмотря на то, что вязкость системы резко возрастает при застудневании. Это объясняется тем, что трехмерная сетка, образующаяся в студне, не мешает движению сравнительно малых ионов в растворителе; иначе говоря, «микровязкость» системы при ее застудневании остается неизменной.
Специфичным свойством некоторых студней является возможность вытеснения жидкости, находящейся в петлях молекулярной сетки, какой-нибудь другой жидкостью. Если вторая жидкость смешивается с первой, то процесс можно осуществить простым погружением студня во вторую жидкость. Если жидкости не смешиваются, то необходимо использовать какую-нибудь третью жидкость, смешивающуюся с обеими. Так, если нужно заменить воду в водном студне углеводородом, то сначала воду вытесняют спиртом, который затем можно вытеснить смешивающимся с ним углеводородом.
Примечательно, что студень, в котором жидкая среда заменена чужеродной жидкостью, часто обладает повышенной жесткостью и не претерпевает усадки при высушивании. Молекулярная сетка такого модифицированного студня как бы теряет эластичность и способность сокращаться при удалении из нее среды. Кроме того, в таких студнях, как показал Германе, даже после их тщательного высушивания остается некоторое количество жидкости, что, вероятно, обусловлено чисто стерическими причинами. Ниже определенной степени набухания молекулярные цепи в студне весьма плотно упакованы и молекулы среды остаются как бы окклюдированными между ними. Продвигаться между тесно сблизившимися макромолекулами могут только молекулы жидкости, растворяющейся в высокомолекулярном соединении. Все вышеуказанное в некоторой степени объясняет тот общеизвестный факт, что остатки (следы) жидкостей, находящихся в пленках высокомолекулярных веществ, удаляются из них с большим трудом.
Большинство студней, встречающихся в растительном и животном мире, обладают анизотропией, обусловленной условиями образования этих студней. Причиной анизотропии искусственно полученных студней обычно является неравномерная деформация их при образовании или неравномерная усадка при высушивании. Примером может служить студень, полученный высушиванием раствора желатина на стеклянной пластинке. Очевидно, усадка в таких условиях может происходить только по толщине пленки студня, в результате чего макромолекулы желатина будут ориентированы преимущественно параллельно плоскости пластинки. Естественно, что у анизотропных студней такие свойства, как изменение линейных размеров образца студня при набухании или усадке, преломление и поглощение света, двулучепреломление, а также механические свойства разные в различных направлениях.
В заключение необходимо указать, что студни высокомолекулярных веществ при малом содержании в них растворителя очень близки по свойствам к самим высокомолекулярным веществам. Конечно, высокомолекулярное вещество, не содержащее растворителя, не является студнем или гелем, но оно может быть получено из студня путем высушивания и легко превращено в студень в результате набухания. Поэтому высокомолекулярные вещества, способные набухать, часто рассматривают как предельное состояние геля при удалении из него растворителя и называют ксерогеля — м и, т. е. «сухими» гелями (ксерос — по-гречески сухой). Высокомолекулярные вещества, не способные к набуханию, обычно называют смолами.
В качестве примеров ксерогелей можно назвать сухой желатин, полистирол, каучук, целлюлозное волокно, примером смол является бакелит.
Синерезис
Свежеприготовленные студни высокомолекулярных веществ при стоянии часто претерпевают синерезис: их объем уменьшается и среда спонтанно выпрессовывается из эластичного студня. В результате образуются две макрофазы — жидкая и студнеобразная, причем последняя сохраняет форму сосуда, в котором находился первоначальный студень. Синерезис очень распространенное явление и может наблюдаться не только в студнях с сеткой из макромолекул, но, как мы видели в гл. X, и в лиогелях, сетка которых состоит из кристаллических частиц. Многие явления синерезиса детально исследованы С. М. Липатовым.
Общей причиной синерезиса является то, что при образовании студня не достигается еще равновесия системы и в ней продолжаются процессы, связанные с его установлением. У лиогелей эти процессы могут сводиться к рекристаллизации. У высокомолекулярных студней эти процессы сводятся к установлению связей между макромолекулами, что способствует дальнейшему уменьшению объема студня. Синерезис может являться также следствием достижения равновесия в студне при его охлаждении, если высокомолекулярное вещество не полностью растворимо в среде. Наконец, в некоторых случаях непосредственной причиной синерезиса являются химические процессы, протекающие в веществе студня. Например, водные студни ксантогената целлюлозы претерпевают синерезис в результате разложения ксантогената.
Синерезис "свойствен не только водным студням (например, студню желатина и крахмала), но и студням, где средой являются органические жидкости (например, каучуковому студню).
Предел, к которому стремится объем студня при синерезисе, зависит от концентрации студня. Синерезис обычно тем больше, чем выше концентрация растворителя в исходном студне. Определенной зависимости скорости синерезиса от концентрации исходного студня нет. Например, при высоких концентрациях синерезис каучукового студня ускоряется, а студня крахмада и агара замедляется. Предельным объемом студня при синерезисе, по С. М. Липатову, является сумма объемов самих макромолекул и объема растворителя, сольватно связанного с высокомолекулярным веществом. Незначительное повышение температуры, как правило, спог собствует синерезису, облегчая перемещение молекул, необходимое для усадки студня. Однако при значительном повышении температуры может произойти переход студня в раствор. Внешнее давление на студень, конечно, всегда способствует синерезису.
Для студней амфотерных белков максимальный синерезис наблюдается в изоэлектрической точке, так как в таком состоянии молекулы несут равное число разноименных зарядов, что способствует сжатию молекулярной сетки студня. С изменением рН среды (относительно изоэлектрической точки) синерезис уменьшается, так как молекулярные^цепочки приобретают одноименный заряд, обусловливающий их распрямление и отталкивание друг от друга.
Влияние на синерезис студня низкомолекулярных электролитов весьма сложно. Однако, как правило, электролиты, способствующие набуханию, уменьшают синерезис и наоборот.
Найдено, что синерезис зависит от размеров образца студня, и причем синерезис тем меньше, чем больше образец. Это вполне понятно, так как жидкость, которая должна быть выпрессована при синерезисе из образцов студня большего размера, должна преодолеть большее сопротивление.
Явления синерезиса имеют очень большое значение в биологии, медицине и технике. Его можно рассматривать как положительное явление при получении некоторых синтетических смол, поскольку при этом происходит самопроизвольное отделение смолы от растворителя. Положительное значение имеет синерезис и в молочной промышленности, так как на нем основано получение творога. В крахмало-паточной, мармеладной и некоторых других отраслях пищевой промышленности это явление имеет отрицательное значение, и усилия технолога направлены на его предупреждение. В производстве взрывчатых веществ синерезис (например, выделение из студня, которым является бездымный порох, самовзрывающегося нитроглицерина) чрезвычайно опасен.
[1] В некоторых руководствах необратимые, или лиофобиые, коллоидные системы называются также суспензоидами, а обратимые, или лиофильиые, си — Ьтемы—Эмульсоидами нз-за сходства некоторых свойств этих систем с суспензиями или эмульсиями. Однако эта терминология малообоснована.
[2] Ряд интересных примеров, в которых показана роль коллоидных систем и процессов в природе и технике, можно найтн в книге Во. Оствальда «Мир обойденных величин» (Науч.-хнм.-техн. изд. Всехнмпром, ВСНХ СССР, 1930). Конечно, эта книга сильно устарела.
Пусть при неизменной весовой концентрации дисперсной фазы объем частиц в результате дробления уменьшится в х раз. Тогда численная концентрация увеличивается в х раз, и будем иметь:
/Р = kx (vfx)* IQ = (kvv2/x) I0
Т. е. светорассеяние уменьшится также в х раз. Это полностью Совпадает с результатами эксперимента, показывающими, что дем выше дцсперсность золя, тем он _меньше рассеивает свет. При молекулярной степени раздробления опалесценция становится совершенно визуально незаметной.
При увеличении частиц до размера, значительно превышающего длину световой волны, светорассеяние, как было указано выше, переходит в отражение света и по мере увеличения частиц интенсивность рассеянного света уменьшается. На рис. 11,2 показано выраженное в условных единицах рассеяние света суспензией сульфата бария в зависимости от дисперсности системы (при постоянной весовой концентрации). Светорассеяние характеризуется начальной, восходящей частью кривой.
[3] Исследование формы и строения коллоидных частиц, основанное на опреДелении двойного лучепреломления в потоке, рассмотрено в первом издании Книги: С. С. Воюцкнй «Курс коллоидной хнмнн», М., «Хнмня», 1964, 574 с. См.
[4] Например. Курс физической химии Под общей редакцией Я. И. Герасимова, Т. I, М„ «Химия», 1969. См. с, 460,
[5] Другой способ графического решения уравнения Ленгмюра, пожалуй, несколько менее точный, можно найти в 1-ом издании «Курса коллоидной химии», С С Воюцкого М, «Химия», 1964 См с. 110,
[6] Радиус капилляра R, как это следует из молекулярной физики, связан с радиусом кривизны шаровидного мениска г смачивающей стенки капилляра жидкости простым уравнением R — r соз 0, где 0 — краевой угол
[7] Термин «пленки» в данном случае применяется условно На самом деле молекулы двухмерного газа не образуют на поверхности воды сплошную пленку, а обладают тепловым движением, сходным с тепловым движением молекул трехмерного (обычного) газа. Иногда такие пленки называют слоями поверхностно-активных веществ, хотя и это название не совсем удачно.
[8] Полная энергия единицы поверхности Е является суммой свободной энергии поверхности а и связанной энергии Qs:
Е = а + Qs
Величина Qs представляет собой теплоту, необходимую для поддержания постоянной температуры прн изотермическом растяжении поверхности на единицу площади Более подробно см. Н. К Ада м. Физика и химия поверхности, М., ОГИЗ, 1947, с. 25.
[9] Более подробные сведения о гистерезисе смачивания можно найти в работах: П. А. Р е б и н д е р и др. Исследования в области поверхностных явлений. М„ ОНТИ, 1936, 299 с. "
[10] Более подробно о гистерезисе см. G. С. Воюций, Физико-химические основы пропитывания и импрегнироваиия волокнистых материалов дисперсиями полимеров. Л., «Химия», 1969, с. 13,
[11] Более подробно о механизме стирки см. П. А. Ребиндер и др. Физико — химия моющего действия. М., Пищепромиздат, 1935, 178 с.
[12] Теория адгезии изложены в следующих монографиях (приводятся только главнейшие); Б. В. Дерягин, Н. А. Кротова, Адгезия. М. — Л. Изд. АН СССР, 1949. с. 244; Адгезия, цементы, прнпон. Сборник под ред. Н. Дебройна и Р, Гувинка. Пер. с англ. М., Издатинлит, 1954, 584 е.; С. С. Воюцяий. Адгезия. Энциклопедия полимеров, т. 1. М., «Советская энциклопедия», 1972. См. с 22; С. С. Воюцкий. Аутогезия и адгезия высокополимеров. М, Ростехиздат, 1960. с. 244; Б. В. Дерягин, Н. А. Кротова, В. П. Смилга. Адгезня твердых тел. М., «Наука», 1973, с. 270; А. А. Берлин, В. Е. Б а син. Основи, адгезии полимеров. М., «Химия», 1974, с. 392.
В большинстве случаев адсорбируется частицей из внешней среды. Второй способ указывает на то, что адсорбированный потенциалобразующий ион достроил частицу и составляет с ней одно целое. Учитывая, что ни один из этих способов размещения ионов не имеет явных преимуществ, в дальнейшем будем прибегать к первому способу, поскольку он используется в большинстве отечественных учебников и был применен в первом издании этой книги.
[13] Здесь следует заметить, что величину 1/х, получившую в теории сильных электролитов название радиуса ионной атмосферы (или дебаевского радиуса)* нельзя понимать геометрически, как радиус сферы, за которой действие поля рассматриваемого иона становится равным нулю. Физическая величина радиуса ионной атмосферы, строго говоря, неограннчена. Однако потенциал поля убывает с удалением от рассматриваемого иона экспоненциально и на расстоянии, много большем 1/х, влиянием этого потенциала можно пренебречь.
[14] На рис. VII, 15 по оси ординат вверх от нуля отложены отрицательны? значения ^-потенциала, а вниз от нуля — его положительные значения. Такой прием графического изображения часто применяется в коллоидной химии в связи с тем, что в большинстве коллоидных систем частицы заряжены отрицательно
[15] Метастабильным состоянием в термодинамике называют такое состояние системы, которое не отвечает устойчивому равновесию в данных условиях, но сохраняется во времени. Таково, например, состояние пересыщенного пара или раствора, переохлажденной илн перегретой жидкости, малоустойчивой кристаллической модификации. МетастабилЬиое состояние способно переходить под влиянием сравнительно слабых внешних воздействий или при внесений в систему зародышей более устойчивой фазы в устойчивое, стабильное состояние.
8 Зак, 664
[16] Вследствие этого изоэлектрическая точка для золя нодида серебра отвечает не строгой эквивалентности взятых количеств исходных веществ, а некоторому небольшому избытку ионов Ag+ над ионами I",
[17] Глава написана совместно с Б В. Дерягиным.
259
[18] С понятиями потенциальный или энергетический барьер и потенциальная яма учащиеся должны быть знакомы из курса физической химии. Более подробно об этих понятиях в приложении их к коллоидным системам сказано в следующих разделах этой главы.
[19] Применительно к металлам эта формула была дана еще раньше Казимиром и Польдером.
[20] Соответствующий математический аппарат дан в книге Шелудко, Коллоидная химия. Пер. с болг., под ред. Б. В. Дерягина и С. С. Воюцкого, М., Издатннлит, 1960. См. с. 109.
[21] Краткое изложение сущности этих теорий и нх критику можно найти в первом издании этого учебника, с. 304—308,
10 Зак. 664 289
[22] Согласно уточненным представлениям область сил отталкнвання определяется не потенциалом <р0, а потенциалом <((,, отвечающим границе слоя Штерна. Существенно, что фб < фо.
[23] Некоторые сведения о гетероадагуляции и о ее применении в практике можно найти в монографии С С Воюцкого «Физико-химические основы пропитывания и импрегнирования волокнистых материалов дисперсиями полимеров». Л., «Химия», 1969. 336 с.
[24] Согласно принятой в настоящее время терминологии, гелеобразованием или желатинированием называют переход коллоидного раствора из свободно — дисперсного состояния (золя) в связнодисперсное (гель). Термином «застудневание» пользуются для обозначения аналогичного перехода раствора высокомолекулярного вещества в студень,
[25] И. Ф. Ефремов, Периодические коллоидные структуры. Л., « Химия», 1971, 192 с,
[26] Вывод этого уравнения путем интегрирования уравнения Ньютона дается в учебниках физики; см. также С. С. Воюцкий. Курс коллоидной химии, М., «Химия», 1964. 574 с. См. с. 342.
[27] Более подробно о возникновении капелек на ионах см. А. Шелудцо. Коллоидная химия. Пер. с англ. под ред. Б. В. Дерягина и С. С. Воюцкого. М„ Издатинлит, 1960, с. 299—307.
[28] Некоторые сведения о взаимодействии частнц латексов с волокном можно найти В монографии: С. С. Воюцкий. Физико-химические основы пропитывания и импрегнирования волокнистых материалов дисперсиями полимеров. Л., «Химия», 1969. 336 с,
[29] Много сведений о коллоидном строении горных пород и о значении коллоидных процессов при образовании земной коры можно найти в кн.: Ф. В. Чухров. Коллоиды в земной коре. М„ изд-во АН СССР, 1955, 672 с.
[30] Осмотический коэффициент Бьеррума равен отношению фактического числа частиц в растворе к тому, которое имело бы место при полной диссоциации электролита.
[31] К высокомолекулярным веществам относятся и высокополимеры или, просто, полимеры, т. е. высокомолекулярные вещества, получаемые в результате полимеризации или конденсации и обладающие обычно линейным строением молекул и часто высокой эластичностью.
14 Зак, 664
[32] Конформациями называются формы молекул, переходящие друг в друга за счет свободного внутримолекулярного вращения,
[33] На эластические свойства высокомолекулярных углеводородов в сильной степени может влиять их способность кристаллизоваться. Естественно, что кристаллизующиеся высокомолекулярные углеводороды будут проявлять малую эластичность и обладать достаточно высокой жесткостью,
[34] Даже при растворении веществ с жесткими, сильно вытянутыми молекулами в низкомолекулярной жидкости с изодиаметрическими молекулами эи* тропия смешения будет больше идеальной, поскольку число размещений таких вытянутых молекул намного превысит чйсло размещений того же числа изо — диаметрических молекул двух сортов.
[35] С набуханием нельзя смешивать процесс капиллярного впитывания, при котором жидкость заполняет микроскопические пустоты, имеющиеся в твердом теле Размеры твердого тела при этом обычно не увеличиваются.
 1 ноября, 2012
1 ноября, 2012  admin
admin 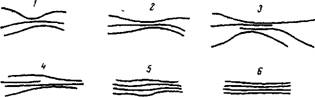
 Опубликовано в рубрике
Опубликовано в рубрике 