Истинные растворы ПАВ. Максимально возможная концентрация, при которой коллоидные ПАВ еще находятся в водном растворе в молекулярной (ионной) форме, т. е. критическая концентрация мицеллообразования, не велика и изменяется в пределах Ю-5— 10_3 моль/л. Мыла, которые являются слабыми электролитами, могут существовать в растворе не только в виде ионов (RCOO-, М+), но и в виде недиссоциированных молекул (RCOOM) и продуктов их гидролиза — молекул жирной кислоты (RCOOH), Соли сильных кислот, например сульфокислот, находятся в растворе в виде ионов, а неионогенные ПАВ — в виде недиссоциированных молекул.
Причины мицеллообразования. Выше критической концентрации мицеллообразования ПАВ в водных растворах начинается агрегация молекул и образуются мицеллы.
Состояние раствора при мицеллообразовании можно рассматривать как обратимое равновесие, подчиняющееся закону действия масс. Это равновесие для простейшего случая недиссоциированных молекул, например молекул НПАВ, может быть описана уравнением*
Тх (х)т
Другой подход к этому явлению основан на предположении, что — мицеллообразование заключается в возникновении новой фазы в системе вода —ПАВ. При этом мицеллы рассматривают как своеобразную фазу с предельной дисперсностью (псевдофазу), поскольку в отличие от истинного фазового разделения мицеллообразование не приводит к бесконечно большому числу молекул в агрегате (число молекул в агрегате сокращенно называют числом агрегации). Подтверждением фазовой теории мицеллообразования, которой придерживается большинство ученых, являются по крайней мере, два обстоятельства: во-первых, постоянство концентрации молекулярно растворенного ПАВ выше ККМ и, во — вторых, наличие в области ККМ резкого излома на кривых зависимости физико-химическое свойство — концентрация. Термодинамическое рассмотрение показывает, что при больших числах агрегации (25 и больше) оба подхода равноценны.
Агрегат из молекул ПАВ образуется из углеводородных цепей, а гидрофильные части молекул располагаются на внешней поверхности мицеллы. Основной причиной возникновения в водных растворах агрегатов из углеводородных цепей являются когезионные силы между молекулами воды, которые больше, чем взаимное притяжение молекул воды и углеводородных цепей. Молекулы воды как бы «вытесняют» углеводородные цепи из раствора, что сопровождается уменьшением энтальпии системы. Образованию мицелл препятствуют силы взаимного отталкивания гидрофильных частей молекул ПАВ. Для ионных ПАВ это отталкивание обусловлено электростатическим взаимодействием одноименно заряженных ионогенных групп, для НПАВ — осмотическими силами, которые возникают из-за повышения концентрации оксиэтиленовых цепей в периферической части мицеллы. Кроме того, образованию мицелл препятствует падение энтропии из-за возрастания при агрегации упорядоченности системы. Возрастание энергии отталкивания полярных групп и падение энтропии компенсируют убыль энергии системы при агрегации углеводородных цепей и приводят к установлению равновесных значений К. КМ и размера мицелл.
Согласно этим традиционным представлениям, уменьшение свободной энергии системы при мицеллообразоваиии связано с падением энтальпии системы и, — следовательно, мицеллообразоваиие должно сопровождаться выделением тепла. — Однако при экспериментальном определении теплот мицеллообразоваиия было установлено, что эти теплоты малы, а в некоторых случаях даже имеют отрицательное значение, т е мицеллообразовачие сопровождается поглощением тепла. Этот результат можно объяснить особыми свойствами воды, обусловленными существованием в воде структур ближнего порядка
Предложено много различных моделей состояния воды, но во всех этих моделях признается образование льдоподобной ажурной тетраэдрической структуры — каркаса, в котором молекулы воды соединены друг с другом водородными связями В такой структуре каждая молекула воды в среднем окружена четырьмя другими молекулами воды Наличие тетраэдрической структуры воды было впервые предсказано в классической работе Бернала и Фаулера и подтверждено позже рентгенографическими исследованиями Наряду с молекулами, входящими в каркас, существуют свободные молекулы воды, ие связанные водородными мостиками Эти молекулы частично заполняют области неплотной упаковки виутрн структуры воды, перемещаясь в иих В результате теплового движения между молекулами каркаса и свободными молекулами происходит постоянный тепловой обмен Понижение температуры приводит к уменьшению числа свободных молекул, тек упрочнению, или иначе, к стабилизации структуры воды Повышение температуры дает обратный эффект — уменьшается число молекул, входящих в каркас, и тетраэдрическая структура воды ослабляется.
Области неплотной упаковки внутри льдоподобной структуры воды можно приближенно рассматривать как пустоты, которые играют существенную роль чри растворении в воде иеполяриых органических веществ При растворении молекулы этих веществ внедряются в структуру воды, что приводит к стабилизации структуры и к уменьшению внутренней энергии системы Одно из возможных объяснений этого явления, предложенное О Я Самойловым, состоит в том, что молекулы иеполяриых органических веществ, заполняя пустоты, ограничивают перемещение свободных молекул воды и их тепловой обмен с молекулами воды каркаса Это способствует стабилизации структуры воды Ввиду того что ПАВ содержат неполярную, углеводородную цепочку, их растворение также приводит к стабилизации структуры воды
Одновременно с растворением ПАВ происходит объединение углеводородных частей молекулы ПАВ в водной среде — так называемое гидрофобное взаимодействие Причиной гидрофобного взаимодействия является ослабление структуры воды при переходе углеводородных цепочек из водных растворов ПАВ в ядро мицеллы, где между ними возникают ваи-дер-ваальсовы связи Разрушение структуры воды, а также увеличение конформациоиной энтропии углеводородных цепочек в ядре мицеллы по сравнению с их энтропией в водной фазе приводят к повышению энтропии системы В работах Немети и Шерага, а также в исследованиях П А Ребиидера и З Н Маркиной показано, что процесс образования мицелл является типичным случаем гидрофобного взаимодействия Это означает, что в энергетическом балансе мицеллообразовання появляется новая составляющая — увеличение энтропии системы, что и определяет во многих случаях энтропийный характер мицеллообразоваиия Конечно, ие следует забывать, что при образовании мицелл идет и противоположный процесс — падение энтропии В результате в качестве компромисса возникают малые мицеллы, так как при образовании крупных мицелл происходила бы значительная убыль энтропии.
Образование мицелляриых растворов ионных ПАВ возможно лишь выше некоторого критического значения температуры, так называемой точки Крафтй (рис XIII, 2) Прн низких температурах гидратированное твердое ПАВ образует набухший гель, равновесный с истинным раствором (участок I) В точке Крафта
углеводородные цепи ПАВ переходят как бы в жидкое состояние При этом1 в результате теплового движения углеводородных цепей ориентированные слои молекул ПАВ в геле распадаются на частицы коллоидных размеров — мицеллы. Образование мицелл из геля сопровождается возрастанием энтропии, способствующим протеканию этого процесса Общая растворимость ПАВ резко возрастает (участок 2), тогда как истинная растворимость, характеризуемая критической — концентрацией мицеллообразования, существенно не изменяется (участок 3). Точка Крафта ие совпадает с температурой плавления твердого ПАВ, а лежит — ниже, так как в набухшем геле ПАВ гидратироваио и это облегчает плавление — То, что мицеллы образуются лишь выше точки Крафта, позволяет рассматривать, их как жидкую фазу Жидкое состояние углеводородного ядра мицелл подтверждается также и тем, что они могут образовывать смешанные мицеллы с различными добавками Большинство гидратированных неионогенных ПАВ являются, жидкими при достаточно низких температурах, и поэтому для них точка Крафта отсутствует
Строение мицелл. При критической концентрации мицеллообразования в системе из отдельных молекул ПАВ образуются так называемые мицеллы Гарт — ли. Эти мицеллы представляют собой сферические агрегаты, в которых-углеводородные цепи молекулы переплелись, а полярные группы обращены наружу (в воду). Число молекул ПАВ в одном таком агрегате обычно находится в пределах 50—100, но может доходить и до 1000. Диаметр подобного сферического агрегата, по Гартли, примерно вдвое больше длины молекулы ПАВ, из которого он образован.
Нетрудно видеть, что для ионогенных ПАВ строение такого сферического агрегата полностью сходно со строением типичной коллоидной мицеллы. В самом деле, агрегированные углеводородные цепи, которые образуют как бы капельку жидкого углеводорода, играют в мицелле роль агрегата обычной мицеллы, а частично диссоциированные ионогенные группы, находящиеся в воде, образуют двойной электрический слой.
|
Рис XIII,2. Фазовая диаграмма растворов ПАВ вблизи точки Крафта (с — Концентрация ПАВ в растворе, T — температура). 1 — кривая молекулярной растворимости ПАВ ниже точки Крафта; 2—кривая растворимости (молекулярной и мицеллярной) выше — точки Крафта, 3— кривая молекулярной растворимости (ККМ) выше точки Крафта, 4—точка. Крафта. |
При более высоких концентрациях ПАВ в растворах образуются мицеллы уже иного строения По мере повышения концентрации раствора размер мицелл увеличивается и углеводородные цепи располагаются в них все более и более параллельно друг другу. В результате образуются пластинчатые мицеллы, состоящие из двух слоев молекул ПАВ, обращенных друг к другу углеводородными цепями, а ионогенными группами наружу Эти мицеллы напоминают по своему строению двухмерный кристалл и могут иметь неограниченно большие размеры в двух направлениях. Пластинчатые мицеллы ионогенных ПАВ заряжены гораздо более слабо, чем сферические, поскольку при сравнительно высокой концентрации ПАВ, при которой они образуются, уменьшается
диссоциация ионогенных групп. Благодаря этому пластинчатые мицеллы располагаются параллельно друг другу, причем соседние мицеллы обращены одна к другой своими поверхностями, на которых находятся гидратированные группы молекул ПАВ. Вследствие образования пластинчатых мицелл и их характерного расположения достаточно концентрированные растворы способны переходить в гель, показывающий под микроскопом своеобразную структуру, состоящую как бы из лент и пленок.
Существование пластинчатых мицелл в достаточно концентрированных растворах мыла впервые предположил Мак-Бен, поэтому их часто называют мицеллами Мак-Бена. Впоследствии существование пластинчатых мицелл мыла было доказано рентгенографи^ чески.
Образование различных мицелл в растворах ПАВ по мере повышения их концентрации изображено схематически на рис. XIII, 3.
Определение критической концентрации мицеллообразоваиия
Основано на том, что при образовании мицелл, как уже отмечалось выше, происходит изменение всех свойств раствора ПАВ, тем более резкое, чем больше число агрегации молекул. Нефелометрическим методом установлено, что образование мицелл приводит к резкому увеличению светорассеяния раствором ПАВ вследствие того, что он становится гетерогенным.
Мак-Бен показал, что концентрационная зависимость осмотического коэффициента [30] для растворов мыл выражается кривой, схематически изображенной на рис. XIII, 4. Эта кривая в отличие от монотонной кривой, характерной для слабых электролитов, не образующих мицелл, состоит из трех участков, соответствующих предкритической области, области, в которой осмотический коэффициент резко изменяется с концентрацией, и послекритической области, где кривая идет почти параллельно оси концентраций. Характер первого участка кривой изменяется в той точке, которая соответствует уменьшению осмотической активности раствора в результате образования сферических мицелл, т. е. отвечает ККМ.
Аналогично этой кривой изменяется с концентрацией и эквивалентная электропроводность, раствора ПАВ. На рис. XIII, 5 показаны типичные концентрационные кривые эквивалентной электропроводности для растворов обычных мыл. Выбранный масштаб графика не позволяет изобразить на нем начальные участки кривых, отвечающие предкритической области. Однако по форме второго и третьего участков можно видеть, что эквивалентная электропроводность растворов мыл, содержащих 12 и более атомов углерода в цепи, резко падает в области небольших концентраций и достигает минимального значения в точке, отвечающей образованию мицелл, а затем несколько увеличивается. При этом с уве
личением молекулярного веса ПАВ этот минимум сдвигается в сторону меньших концентраций и становится более выраженным. Понижение эквивалентной электропроводности с повышением
Концентрации мыла в растворе, согласно Гартли, обусловливается частичным присоединением противоионов к ионизированным мицеллам. Это присоединение происходит под действием значительных электрических сил, вызванных присутствием образовавшихся в системе высокозаряженных ионных мицелл. Причины повышения эквивалентной электропроводности после достижения минимума не вполне ясны,
. Наконец, ККМ можно определять по изменению поверхностного натяжения коллоидного раствора ПАВ при повышении его концентрации. С увеличением содержания ПАВ поверхностное натяжение раствора всегда падает, достигая в точке, отвечающей ККМ, обычно предельного постоянного значения.
На ККМ в растворах ПАВ может влиять ряд факторов. Так, ККМ снижается с увеличением молекулярного веса углеводородной цепи ПАВ. Такая зависимость вполне понятна, потому что о увеличением длины углеводородной цепи уменьшается истинная растворимость и возрастает склонность молекул ПАВ к ассоциации. Влияние температуры на ККМ различно для ионогенных и неионогенных ПАВ. Для ионогенных ПАВ ККМ обычно повышается с увеличением температуры вследствие дезагрегирующего действия теплового движения молекул. Однако этот эффект невелик, так как он ослаблен гидрофобными взаимодействиями, сопровождающимися увеличением энтропии системы. Поэтому влияние температуры на ККМ проявляется тем слабее, чем" больше выражены гидрофобные свойства мыл. Для неионогенных ПАВ ККМ всегда уменьшается при повышении температуры. Это вызвано тем, что при повышении температуры водородные связи между эфирным атомом кислорода и молекулами воды разрушаются, оксиэтиленовые цепи дегидратируются и уменьшается их взаимное отталкивание, препятствующее агрегации.
Заканчивая рассмотрение процесса мицеллообразоваиия, отметим, что мицеллы могут образоваться не только в водных растворах коллоидных ПАВ, но и в растворах ПАВ в углеводородах. При этом молекулы ПАВ в мицелле ориентированы полярными группами внутрь мицеллы, а углеводородными концами обращены к растворителю. Вместе с тем необходимо указать, что в спирте ПАВ обычно дают молекулярные растворы. Это объясняется тем, что спирт по своей полярности стоит между водой и углеводородами и, следовательно, является растворителем как для полярной, так и для неполярной части молекул ПАВ.
 1 ноября, 2012
1 ноября, 2012  admin
admin 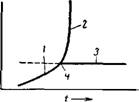
 Опубликовано в рубрике
Опубликовано в рубрике 