Представления о молекулярных силах притяжения и электростатических силах отталкивания лежат в основе современной теории устойчивости и коагуляции ионностабилизованных коллоидных систем. Однако существуют и иные причины устойчивости коллоидных систем. Так, устойчивость коллоидных систем с жидкой дисперсионной средой может быть обусловлена образованием на поверхности частиц достаточно развитых сольватных слоев из молекул дисперсионной среды. Способность подобных сольватных оболочек препятствовать слипанию частиц П. А. Ребиндер объясняет тем, что оболочки обладают сопротивлением сдвиґ-у, мешающим их выдавливанию из зазора между частицами, а также тем, что на границе сольватного слоя и свободной среды отсутствует сколько-нибудь заметное поверхностное натяжение. По Б. В. Деря- гину, причина нерлипания двух сольватиррванных частиц при их сближении заключается в возникновении расклинивающего давления, обусловленного отличием структуры граничных сольватных слоев от свойств объемной фазы.
Сольватные оболочки образуются на границе раздела фаз. Между сольватными оболочками отсутствует молекулярное притяжение, поскольку сила взаимодействия молекул слоя практически равна силе взаимодействия молекул среды. При сближении частиц необходимо совершить работу, расходуемую на удаление сольватного слоя (работа десорбции), что приводит к появлению значительных сил отталкивания между частицами. Наиболее убедительно подтверждают существование граничных слоев с особой структурой исследования Б. В. Дерягина, Н. В. Чураева, С. В. Нерпина, Ю. М. Поповского, М. С. Мецика, Г. М. Зорина и др.
Образование достаточно развитых сольватных оболочек маловероятно для коллоидных систем с лиофобной дисперсной фазой вследствие слабого энергетического взаимодействия среды с дисперсной фазой. Сольватация может иметь место только в том случае, когда поверхностные молекулы дисперсной фазы достаточно сильно взаимодействуют с молекулами дисперсионной среды за счет химических сил или, по крайней мере, прочных водородных мостиков.
Примером систем, устойчивость которых можно объяснить сольватацией, являются гидрозоли Si02 и гидратов окисей некоторых многовалентных металлов. Эти системы, поскольку они не подчиняются обычным закономерностям коагуляции лиофобных золей, в известной мере обратимы и способны существовать без стабилизатора, можно отнести к лиофильным коллоидным системам. Однако при суждении о причине устойчивости подобных систем надо быть очень осторожным, так как работами последних лет показано, что во многих случаях эти системы являются не золями, а растворами, содержащими макромолекулы.
Другим примером систем, в которых сольватация, по-видимому, оказывает существенное влияние на устойчивость, могут служить дисперсные системы с неполярной углеводородной средой, играющие важную роль при производстве и применении нефтепродуктов. Такие системы, например, растворы поверхностно-активных веществ и высокодиснерсные взвеси в углеводородах подробно изучены Г. И. Фуксом и его сотр. Оказалось, что устойчивость этих систем зависит от структуры молекул углеводорода и ее соответствия структуре молекул частиц дисперсной фазы, а также от диэлектрической проницаемости среды и от наличия следов веществ с полярными и дифильными молекулами. Впрочем, для этих систем, как показал Овербек, нельзя пренебрегать двойным электрическим слоем и электростатическими взаимодействиями.
Были сделаны попытки объяснить устойчивость лиофобных коллоидных систем и с помощью индуцированной сольватации их частиц
Согласно этим представлениям агрегативная устойчивость лиофобных золей, связанная с возникновением на частицах двойного электрического слоя, объясняется не отталкиванием частиц в результате действия электростатических сил, а тем, что противоионы двойного слоя сольватируются и таким образом создают вокруг каждой лиофобной частицы сольватную оболочку
Легко видеть слабые стороны такого объяснения агрегативной устойчивости. Весьма трудно представить себе возникновение в результате сольватации противоионов вокруг лиофобных частиц сплошных сольватных оболочек, препятствующих слипанию частиц при их сближении. В самом деле, сольватные оболочки из полярных молекул среды образуются отдельно вокруг каждого про — тивоиона двойного слоя. Это должно приводить к тому, что на границе, разделяющей оболочки двух соседних одноименно заряженных противоионов, молекулы среды, представляющие собой диполи, будут обращены друг к другу — одноименно заряженными концами и, следовательно, будут испытывать взаимное отталкивание. Кроме того, следует помнить, что микроструктура окружающего частицы слоя непрерывно меняется в результате теплового движения ионов. Понятно, что при таких условиях говорить о создании в результате притяжения и ориентации диполей какого-то сплошного слоя из сцепленных друг с другом ионов и молекул среды, нужного для обеспечения положительного расклинивающего давления или упругости сольватной оболочки, просто невозможно. Положительное расклинивающее давление, обусловливающее агрегативную устойчивость лиофобных коллоидов, может возникать лишь в результате деформации ионных атмосфер, т. е. может определиться только электростатическими силами
Кроме того, с тем, что устойчивость типичных лиофобных ионностабилизо — ванных коллоидных систем может определяться сольватацией, не согласуются способность этих систем коагулировать под влиянием ничтожных количеств электролитов и вообще все закономерности, наблюдающиеся при электролитной коаіуляции, о которых мы скажем несколько ниже Далее, при объяснении устойчивости лиофобных систем сольватацией ионов становится непонятным, как могут происходить электрокинетнческие явлення.’ Для того чтобы воспрепятствовать коагуляции, сольватный слой вокруг частицы должен быть достаточно толстым и уж во всяком случае простираться за плоскость скольжения мицеллы Однако в этом случае невозможен разрыв мицеллы по плоскости скольжения прн наложении на нее электрического поля Наконец, объяснение устойчивости коллоидных систем сольватацией противоионов двойного электрического слоя не позволяет объяснить явление взаимной коагуляции золей с разноименно заряженными частицами Если же для объяснения устойчивости и коагуляции коллоидных систем использовать силы электростатического взаимодействия, явление взаимной коагуляции не требует особых пояснений и может трактоваться строго количественно
Более приемлемым кажется взгляд, согласно которому устойчивости лиофобных коллоидных систем способствует сольватация потенциалопределяющих ионов Однако и в этом случае возникает ряд вопросов, на которые трудно ответить
На основании приведенных рассуждений следует сделать заключение, что сольватация может обеспечивать устойчивость лиофобных, в частности гидрофобных, коллоидных систем только в особых случаях или может служить фактором, дополняющим действие электрических сил. К этому следует добавить, что даже когда роль сольватации для устойчивости коллоидной системы несомненна, строгий учет этого фактора весьма затруднен ввиду отсутствия количественной теории сольватации.
Наряду с термодинамическими факторами устойчивости, к которым следует отнести двойной электрический слой и сольватную оболочку вокруг коллоидной частицы, на устойчивость коллоидных систем может влиять и прочность структурно-механическога барьера, возникающего по тем или иным причинам на поверхности частицы. Этот фактор, согласно П. А. Ребиндеру, нельзя назвать термодинамическим, поскольку при удалении или разрыве оболочки, представляющей структурно-механический барьер, она не обязательно должна восстанавливаться самопроизвольно. Кроме того, у этой оболочки отсутствует равновесие с окружающей средой.
Уже давно высказывалось мнение, что устойчивость пен и эмульсий должна сильно возрастать, когда на поверхности раздела между дисперсной фазой и дисперсионной средой образуется слой из молекул стабилизатора, обладающий повышенной структурной вязкостью или даже известной механической прочностью и являющийся как бы структурно-механическим барьером, препятствующим сближению частиц.
Наиболее широко учение о структурно-механическом факторе стабилизации развито П. А. Ребиндером. Согласно П. А. Ребиндеру, стабилизующими свойствами обладают насыщенные или близкие к насыщению адсорбционные слои ориентированных мо — < лекул поверхностно-активных веществ, образующие двухмерные’г структуры>©собенно сильным стабилизующим действием обладают коллоидные адсорбционные слои, являющиеся своеобразными пленочными (двухмерными) студнями — лиогелями, сильно — сольватированными дисперсионной средой и диффузно переходящими в межмицеллярную жидкость. Веществами, способными образовывать такие слои, являются белки и щелочные мыла в гидрозолях, в олеозолях — смолы, мыла поливалентных металлов и липоиды.
По П. А. Ребиндеру, стабилизующее действие гелеобразных адсорбционных слоев стабилизатора обусловливается тем, что высоковязкая прослойка между частицами не успевает выдавиться за время столкновения частиц дисперсной фазы в результате броуновского движения или в потокедВ известных условиях стабилизация дисперсных систем адсорбционно-сольватными слоями, обладающими упругостью и механической прочностью, может безгранично повышать устойчивость системы вплоть до полной фиксации ее частиц. Примером этому может служить отвердевание жидких прослоек между воздушными пузырьками пены в результате геле — образования или полимеризационных процессов. П. А. Ребиндер отмечает, что образования структурно-механического барьера достаточно для стабилизации только тогда, когда на наружной границе адсорбционного слоя поверхностная энергия мала и не резко возрастает на подступах к частице. При наличии хотя и структурированной, но не лиофильной, а лиофобной оболочки все же может происходить слипание частиц путем сцепления оболрчек наружными поверхностями. Такого рода явления можно наблюдать при флотации в результате адсорбции поверхностно-активных веществ полярными группами на поверхности гидрофильных твердых( частиц. Направленные в водную среду углеводородные цепи связываются друг с другом своеобразной местной коалесценцией гидрофобных оболочек.
Согласно П. А. Ребиндеру, структурно-механический фактор является наиболее сильным фактором стабилизации и его использование якобы неизбежно при получении высокоустойчивых, особенно концентрированных дисперсных систем (например, технических пен, эмульсий и суспензий).
Однако о структурно-механических свойствах адсорбционного слоя можно, очевидно, говорить лишь тогда, когда молекулы стабилизатора типа мылообразных веществ или адсорбирующихся полимеров присутствуют в системе и могут образовывать двухмерный гель или студень.
Исходя из этого, можно полагать, что эмульсии могут быть устойчивыми за счет структурно-механического фактора лишь при достаточно больших концентрациях стабилизатора, когда на межфазной поверхности образуются компактные, хорошо сольватиро — ванные гелеобразные слои, обладающие высокой прочностью.
Г. А. Мартынов представляет себе действие адсорбционных полислоев поверхностно-активных веществ следующим образом. Молекулярные силы притяжения универсальны, т. е. действуют между любыми телами. Представим теперь себе две одинаковые частицы, дисперсную фазу которых обозначим через 1, а полимолекулярно адсорбционный слой через 2 (рис, IX, 8), Очевидно, энергия взаимодействия самих частиц будет равна:
С/!« «,_,///* (IX, 39)
Где /сі—і — константа, характеризующая взаимодействие обеих частиц: Н — расстояние между частицами,
Энергия взаимодействия адсорбционных слоев (пленок) очевидно составит:
U2 « /с2_2/(Я — 2Л)2 (IX, 40)
Где К2-2 — константа, характеризующая взаимодействие адсорбционных слоев; Fi—толщина адсорбционного слоя. Как можно видеть, закономерности взаимодействия в обоих случаях качественно одинаковы, меняются лишь константы взаимодействия и знаменатели уравнений.
На малых расстояниях нельзя пренебречь вкладом пленки в энергию взаимодействия частиц, и тогда энергия притяжения частиц будет равна:
А = к,_,/Я%-к2_2/(Я-2Л)2 (IX, 41)
Таким образом, адсорбционный слой, представляющий нечто иное, как структурно-механический барьер, влияет на взаимодействие частиц, не устраняя их притяжения. Следовательно, адсорбционные пленки не должны были бы привести к повышению устойчивости системы. Однако если к2_2 = 0, то молекулярным притяжением между пленками можно пренебречь. В то же время стабилизующие пленки могут являться препятствием, мешающим тесному сближению частиц. Если частицы не могут приблизиться друг к другу, то молекулярные силы притяжения между ними будут малы, поскольку расстояние велико. Это и приводит к повышению устойчивости.
В отсутствие двойного электрического слоя эффективность адсорбционных стабилизующих пленок определяется следующими условиями. Во-первых, стабилизующая пленка должна быть достаточно лиофильной, т. е. к2_2 ~ 0; во-вторых, чем длиннее молекулы вещества, образующего защитную пленку, тем больше то расстояние, на которое могут приблизиться частицы, и тем меньше значение молекулярных сил притяжении между ними (т. е. тем выше устойчивость системы).
В заключение рассмотрим представления о так называемом энтропийном факторе устойчивости.
В работах Симха, Эйриха, Фриша и многих других исследователей было показано, что достаточно длинные и гибкие молекулы поверхностно-активных веществ и полимеров способны адсорбироваться на поверхности твердого тела своими отдельными звеньями. При этом большая часть концов цепей или петель, образуемых адсорбированными молекулами, находится в дисперсионной среде и может совершать микроброуновское движение (рис. IX, 9а), что обусловливает стабилизацию системы. Согласно Овербеку, стабилизация коллоидных частиц в этом случае происходит в результате «отталкивания» друг от друга гибких участков цепных молекул, «торчащих» в среду.
|
|
|
Рис. IX, 8. Схема взаимодействия частиц, стабилизованных полислоями поверхностно-активного вещества: 1 — частицы; 2 —адсорбционный слой по — верхностно-актиэного вещества; Н — расстояние между частицами, ft—толщина адсорбционного слоя. |
Согласно другому мнению при сближении частиц, на поверхности которых адсорбированы отдельные звенья макромолекул, уменьшается число конформаций, осуществляемых гибкими цепями стабилизатора (рис. IX, 96). Такое уменьшение конформаций вследствие «стесненности» макромолекул между сблизившимися частицами приводит к снижению энтропии, а следовательно, и
к увеличению свободной энергии системы. Конечно, это будет способствовать раздельному существованию коллоидных частиц, т. е. будет являться фактором, обусловливающим агрегативную устойчивость — системы.
Третье объяснение стабилизующего действия частично адсорбированных макромолекул предложено А. В. Бромбергом еще в 1946 г. Согласно А. В. Бромбергу, стабилизация в этом случае определяется осмотическими силами, действующими в адсорбционных слоях. Неппер также отметил, что перекрытие слоев частично свободных макромолекул должно приводить к возникновению осмотических снл. Таким образом, изменение энтропии полимерных
А 6
Рис. IX, 9. Схематическое изображение коллоидных частиц, адсорбировавших отдельные звенья цепных макромолекул, совершающих микроброуновское движение: а—отдельная частица; б—две сблизившиеся частицы.
Молекул, находящихся в зазоре между сближаемыми поверхностями, должно обусловливать приток жидкости из объема раствора в зазор и возникновение расклинивающего давления, стабилизующего систему.
 1 ноября, 2012
1 ноября, 2012  admin
admin 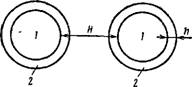
 Опубликовано в рубрике
Опубликовано в рубрике 