Скорость физической адсорбции на непористых адсорбентах обычно весьма велика, и поэтому часто ее измерить очень сложно. Во многих случаях адсорбционное равновесие достигается за 10— 20 с, причем 90—95% адсорбтива связываются адсорбентом уже за 1—2 с. Практически принимают, что скорость адсорбции определяется скоростью, с которой адсорбтив достигает поверхности адсорбента, т. е. скоростью диффузии.
Причину наблюдающейся иногда замедленной физической адсорбции следует искать в строении адсорбента. Адсорбенты часто являются пористыми, и проникновение молекул адсорбтива в поры требует иногда длительного времени. Иногда причина замедленной адсорбции заключается в том, что физическая адсорбция сопровождается хемосорбцией, требующей более длительного времени. Наконец, причиной замедленной адсорбции может быть присутствие на поверхности адсорбента адсорбированного воздуха или паров воды.
Типичные кинетические кривые адсорбции изображены на рис. IV, 14. Форма этих кривых имеет то же объяснение, что и форма изотермы адсорбции. Вначале величина адсорбции практически пропорциональна времени, так как поверхность адсорбента свободна от адсорбтива. После установления равновесия адсорбции последняя перестает зависеть от времени и соответствующие участки кривых идут почти параллельно оси времени.
Уравнение скорости адсорбции обычно имеет вид:
Da/dr = K (аравн — Ах) (I V, 27)
Где аРавв — количество адсорбврованного вещества, отвечающее адсорбционному равновесию при данных условиях; ах—количество вещества, адсорбированного ко времени т; K — константа уравнения.
Физический смысл этого уравнения вполне понятен: чем ближе система к равновесию или чем больше насыщенность поверхности, характеризуемая множителем (аравн — dx), тем медленнее идет адсорбция. Константа K зависит от размера адсорбирующей поверхности и от коэффициента диффузии адсорбтива.
Иногда в качестве уравнения скорости адсорбции принимают параболическое уравнение, напоминающее по виду уравнение Фрейндлиха:
A = K т1/п (IV, 28)
Недостатки этого уравнения те же, что и уравнения Фрейндлиха.
Экспериментально скорость адсорбции исследуют либо путем определения в намеченные моменты времени количества газа, оставшегося в системе еще не адсорбированным, либо по привесу
Адсорбента. Особенно широкое применение для исследования кинетики адсорбции получили весы Мак — Бена, представляющие собой миниатюрную чашечку, подвешенную на очень чувствительной пружинке. На чашечку кладут кусочек адсорбента и пружинку вместе с чашечкой помещают в сосуд с адсорбтивом, В результате адсорбции масса этого кусочка возрастает, и растяжение пружинки соответственно увеличивается. По растяжению заранее откалиброванной пружинки во времени можно судить о кинетике адсорбции количества адсорбированного вещества.
Интересно влияние температуры на скорость адсорбции. С повышением температуры скорость адсорбции возрастает, так как нагревание всегда способствует ускорению установления равновесия в системе. С другой стороны, при повышении температуры адсорбция, отвечающая равновесному состоянию, падает. Таким образом, кинетические кривые адсорбции при разных температурах должны пересекать друг друга, как это и показано на рис. IV, 14.
|
Рис. IV, 14. Зависимость количества адсорбированного вещества от времени адсорбции т при различных температурах: І—кривая, отвечающая температуре Tt; 3—кривая, отвечающая температуре Т, (Г, < тц. |
Температурный коэффициент скорости физической адсорбции невелик. Это связано с тем, что энергия активации физической адсорбции близка к нулю, и ускорение адсорбции с повышением температуры обусловлено, главным образом, только увеличением скорости подвода адсорбтива к поверхности адсорбента в результате роста скорости диффузии. При хемосорбции температурный коэффициент скорости адсорбции имеет тот же порядок, что и при хи
мических процессах, так как энергия активации хемосорбции достаточно велика и температура значительно ускоряет химическое взаимодействие.
 1 ноября, 2012
1 ноября, 2012  admin
admin 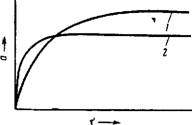
 Опубликовано в рубрике
Опубликовано в рубрике 